
微小 RNA(microRNA)由 19-25 个核苷酸组成,是一类高度保守的内源性非编码小分子 RNA,其主要功能是通过"种子序列"与特殊 mRNA 靶基因非编码区的反向互补结合,形成 miRISC 络合物,导致翻译抑制或 mRNA 降解,参与转录后基因的表达调控[1].mRNA 在细胞的分化、发育、增殖、迁移、凋亡、形态形成及癌症形成、脂肪代谢等许多生理过程中发挥了重要作用,而哺乳动物基因组中,30% 以上基因的 mRNA 表达受到 microRNA 的调节[2].因此,microRNA 通过 mRNA 介导调控细胞分化、增殖、脂类代谢等生物学过程.miR-143 作为动物体内广泛表达的一类 micro-RNA,通过调控靶基因的表达参与脂肪细胞分化、脂类代谢等过程.本文综述了 miR-143 的合成与表达、脂类代谢靶基因预测以及其靶基因的调控机制,阐述了 miR-143 在脂类代谢中的调控作用,为相关疾病的诊断、治疗提供新思路.
1 miR-143的合成与表达
人类 miR-143(又称为 hsa-mir-143)位于第 5号染色体 5q32 上,其序列是 5'-UGAGAUGAAGCAC-UGUAGCUC-3'.具体位置在 5 :148808481-148808-586.has-mir-143 在结构上与其他 microRNA 一样,不编码蛋白,不含开放阅读框,具有高度的保守性.miR-143 的合成包含 3 个部分 :首先,miR-143在 RNA 聚合酶Ⅱ的作用下形成 pri-microRNA(包含单一的 microRNA 或 microRNA 集群);随后,在与Drosha 酶有关的 DGCR8 蛋白作用下形成更小的具有(70 nt)双链发夹结构的 pre-microRNA ;最后,在Exportin 5 和 GTP 依赖蛋白的作用下,由细胞核转运到细胞质,经过 Dicer 酶的加工,形成 21 个核苷酸的成熟microRNA,它是含有反义链的双链RNA分子.茎环结构的 miR-143 前体根据剪切位点的不同可生成 miR-143-3p(21 nt)和 miR-143-5p(22 nt).
miR-143 是 一 类 在 动 物 体 内 广 泛 性 表 达 的microRNA,在许多组织器官中都能检测到它的表达,但不同组织器官 miR-143 的表达丰度存在较大差异.miR-143 组织表达谱的研究显示,其在人类心脏、肾脏、胸腺、白色脂肪组织和主动脉中表达水平比较高,而在脾脏、脑及肝脏中表达水平比较低[6].
2 miR-143调控靶基因的预测
以人类基因组为背景对 miR-143 靶基因进行预测,生物信息学预测包括 :miRanda,Targetscan和 PicTar3 种计算机辅助算法.因为 miRanda 是比较早的算法,假阳性率比较高,为了减小计算机辅助算法可能产生的大量误差,将后两种方法结合,可以更准确地评估 microRNA 的靶基因.张晓东等根据以上两种算法预测出 miR-143 潜在调控靶基因 279 和 216个,取两者 53 个交集基因进行基因功能注释(GeneOntology,GO)富集分析[7,8].miR-143 与脂类代谢相关的靶基因,见表 1.
3 miR-143对脂肪细胞分化和脂类代谢的调控作用
3.1 miR-143促进脂肪细胞分化Esau 等[1]在前脂肪细胞中转染 miR-143 反义寡核苷酸(ASOs),抑制了 miR-143 的表达,阻止脂肪细胞的分化,是第一个被试验证实的对脂肪细胞分化有调控作用的 microRNA.miR-143 可能通过3 种方式参与脂肪细胞分化,分别为 :(1)miR-143可以直接与靶基因细胞外信号调节激酶 5(Extracel-lular-regulated kinase 5,ERK5)的 3'UTR(3' 非编码区)结合 ;(2)间接的通过其他靶基因之间的相互作用调控脂肪细胞分化 ;(3)通过微效(或精细)调节酪氨酸激酶(MAP)信号通路来维持分化状态.

miR-143 可以直接与靶基因 ERK5 的 3'UTR 结合,影响脂肪细胞分化.确切地讲,miR-143 通过下调 ERK5 基因表达,抑制前脂肪细胞的分化.而有的研究认为[5],在高脂饮食饲喂小鼠的脂肪组织中,ERK5 基因表达水平仅稍稍降低(约 20%),说明其表达水平和 miR-143 的表达水平没有显着相关性.因此,有人认为小鼠 ERK5 可能不是 miR-143的直接靶基因,也可能 miR-143 对人类和小鼠脂肪代谢的调控作用存在着差异,但这也可能是由于miR-143 在肥胖小鼠的脂肪组织中表达水平过高造成的[5].利用体外过表达或基因敲除技术[10]研究发现,miR-143 在不同哺乳动物分化的脂肪细胞中均表达上调,可能是一个保守的调节器,调控脂肪细胞的分化进程[11,12].所以 miR-143 对靶基因的调控作用还有待进一步的研究.
miR-143 可以通过靶向作用于多种基因,对脂肪细胞的数量产生影响,所以进一步分析 miR-143在肥胖发展中的作用是十分必要的.通过在脂肪细胞中转染反义核苷酸(ASO),抑制 miR-143 的表达,观察 miR-143 的表达水平与脂肪细胞分化相关标志物间的关系,如过氧化物酶体增殖物激活受体γ(Peroxisome proliferators-activated receptors gamma,PPAR-γ)、 增 强 子 结 合 蛋 白 -α(CCAAT element-binding protein-beta,C / EBPA)、葡萄糖转运蛋白4(Glucose transporter 4,GLUT4)、脂肪酸结合蛋白(Fatty acid binding protein,aP2)和成纤维细胞生长因子 7(Fibroblast growth factor 7,FGF7)等,发现 miR-143 的过表达能够促进脂肪细胞分化标志物基因的表达,而沉默 miR-143 抑制脂肪细胞分化标志物基因的表达[5].Esau 等[1]发现,miR-143 的反义寡核苷酸(ASO)转染诱导分化的人前脂肪细胞,10 d 后检测脂肪细胞标志基因 GLUT4 和 FABP-4 的表达,miR-143 的 ASO 抑制脂肪细胞标志基因的表达,且与对照组相比抑制程度高达 40%.进一步研究显示,脂肪细胞分化标志基因的表达水平与miR-143 的 ASO 抑制剂的浓度成正相关,浓度 300nmol/L 时效果最显着;同时,Northern 印迹试验表明,miR-143 在脂肪细胞中的表达明显高于前脂肪细胞.
李慧霞等[13]对荷斯坦公牛的大理石纹肌肉组织中成纤维前体脂肪细胞进行体外培养时发现,成纤维前体脂肪细胞向成熟的脂肪细胞分化时,miR-143 表达水平上调.用 miR-143 的 ASO 处理该成纤维前体脂肪细胞,脂肪细胞的分化进程受到明显的抑制,而脂滴存储逐渐减少,重要的脂肪细胞调节基因 CCAAT / 增强子结合蛋白 -α(C/EBPA,CCAATelement-binding protein-beta)和 FABP4 基因的表达水平显着下调.同时,转染 miR-143 的 ASO 4 d 后,肌内脂肪细胞(包括前体脂肪细胞)的数目达到最高水平,且细胞的增殖随着 miR-143 的 ASO 抑制剂转染浓度的增加而增加.此研究在某种程度上证实了内源性 miR-143 刺激牛肌内脂肪细胞的分化调节基因,促进肌内脂肪细胞的分化.综上所述,miR-143 能够促进脂肪细胞分化标志物基因表达,促进脂肪细胞分化.
miR-143 通过微效(或精细)调节酪氨酸激酶(MAP)信号通路来维持脂肪细胞分化的状态.MAP激酶属于一种 Ser/Thr 蛋白激酶,在多种不同的信号转导途径中充当信号转导成份,在生长因子、激素、紫外线等刺激下,诱导相关基因的表达,参与细胞的反应、分裂、生长和分化过程.miR-143 对脂肪细胞分化的调节可通过 MAP 信号通路来促进细胞生长和增殖,调节脂肪细胞增殖和分化间的平衡[1].
He 等[17]通过双荧光素酶报告和定量 RT-PCR 法,确定成纤维细胞生长因子 7、成纤维细胞生长因子 2是 miR-143 的靶基因,它们是成纤维细胞生长因子家族的成员,这个家族的大部分成员都能通过激活受体酪氨酸激酶(MAP)信号通路来促进人前脂肪细胞的增殖和分化.成纤维细胞生长因子 7 可作为一个微调分子,平衡脂肪细胞增殖与分化间的关系,但是它在脂肪细胞分化中的确切作用还不清楚.成纤维细胞生长因子 2 在人前脂肪细胞中表达水平较高,分化诱导后明显降低,这与细胞内可见脂滴的第一外观一致.成纤维细胞生长因子 7 与成纤维细胞生长因子 2 的作用类似,只是前者可能更偏向于促进前脂肪细胞的分化而不是生成.
以前的研究中[1],人们在体外培养脂肪细胞,诱导分化后转染 miR-143 的抑制剂和模拟物,使其低表达或过表达,测定 miR-143 对脂肪细胞分化的影响.但是 He 等的研究发现,直接在体外敲除miR-143 的小鼠,表型没有发生异常的变化[14],小鼠的体重、脂肪组织的形态和脂肪细胞的大小都没有发生改变.此外,将体外敲除 miR-143 小鼠和对照组小鼠脂肪细胞分化标志物 mRNA 的表达水平进行比较,发现体外和体内试验中得到的结果是有一定差异的,这说明体外进行的测定试验相对比较简单,但有时候却不能真实地反映生物体内复杂的自我适应机制.microRNA 的功能无论是在无脊椎动物还是脊椎动物中都是重要且高度保守[15],但是即使独立敲除最保守的 microRNA,仍没有导致明显的缺陷[16],这可能是因为其他相关 microRNA 的调控功能,也可能是因为复杂调控网络的其他缓冲机制.miR-143 可能只是充当微调分子,而不是小鼠脂肪生成调控的网络开关,所以它在脂肪组织发育中的作用可能是微乎其微的[17].
3.2 miR-143和脂类代谢的关系Takanabe 等[5]发现,miR-143 在人类和小鼠的心脏、肾脏及胸腺中均有表达,在 ob/ob 小鼠的白色脂肪组织中表达最强烈.培养人前脂肪细胞时,发现在诱导分化 7-10 d miR-143 的表达水平不断增加[1].同样将诱导分化 9 d 与 5 d 小鼠 3T3-L1 细胞相比,前者 miR-143 的表达水平明显高于后者.高脂饮食饲喂的小鼠肠系膜脂肪组织中 miR-143 的表达水明显高于限饲小鼠,且其表达水平与小鼠的体重和肠系膜脂肪重量成正相关.这些研究结果表明miR-143 的表达主要发生在分化后期,所以它可能控制成熟脂肪细胞的功能,而不是影响细胞分化[9].
miR-143 在人类和啮齿类动物脂肪细胞脂质代谢中发挥着重要作用,简单地说,就是 miR-143 能促进甘油三酯的合成[8].在小鼠前脂肪细胞中 miR-143 的过表达可以加速脂滴聚集,抑制甘油及游离脂肪酸的合成,促进脂肪组织的形成[18,19].
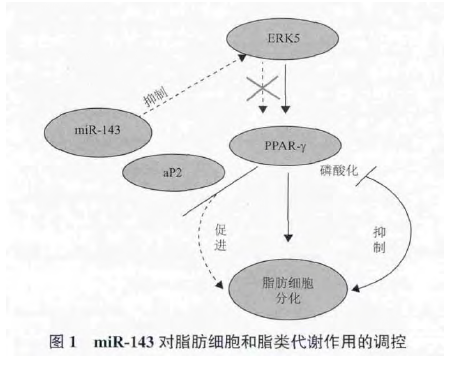
miR-143 可以和其他 microRNA 共同作用于同一个靶基因,也可以单独作用于不同的靶基因,以形成复杂的调控网络,在某些信号通路的作用下,调控有机体的脂类代谢(图 1).一般来说,miR-143通过调控 PPARγ、FABP4、ERK5 等脂肪代谢相关基因的表达,参与甘油的合成和脂质代谢.PPARγ 是脂肪细胞分化的关键调控因子,调控脂肪酸合成与相关转运基因的启动表达,影响脂肪酸的合成途径,可使脂肪细胞数量增加并促进脂肪细胞甘油三酯合成,也是脂质活化的转录因子,调节脂质代谢与糖代谢、脂肪细胞分化和能量之间的平衡 ;FABP4 能够亲和不饱和与饱和长链脂肪酸,与脂类储存和脂类代谢密切相关 ;ERK5 是丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)家族中一个独特的激酶,可以通过磷酸化作用和 C 端物理性结合使底物激活,活化下游因子,引起基因转录和表达,参与调节细胞增殖、分化、转化、凋亡等一系列生命活动[20-22].同时三者之间也存在一定的联系,氧化物酶体增殖物激活受体 γ 是细胞外信号调节激酶 5 的下游基因,其转录需要细胞外信号调节激酶 5 的激活,所以只有当通路激活后,氧化物酶体增殖物激活受体 γ 才能发生磷酸化,降低转录活性,抑制脂肪细胞的分化.活化的氧化物酶体增殖物激活受体 γ 可以调节其下游基因脂肪酸结合蛋白,参与脂类存贮与代谢过程[23-25].
4小结
miR-143 是一类广泛性表达的 microRNA,在脂肪细胞细胞分化和脂类代谢中起着重要的作用.其调控作用也是十分复杂的,不仅可以和其他microRNA 共同作用,还可以作用于不同靶基因,且其靶基因的调控作用也是相互的,这样就形成了一个复杂的调控网络.深入探索 miR-143 在脂肪细胞分化和脂类代谢中的作用和机制,为疾病临床诊断和预后判断的提供分子标志,具有广阔的应用前景.
从现在的研究成果看还有许多问题亟待解决 :(1)miR-143 与其他 microRNA 之间的关联、靶基因间的相互调控作用需要明确.(2)miR-143 在脂质代谢中的实际应用需要进一步扩展.(3)miR-143 对靶基因复杂的网络调控需要明确.
参 考 文 献
[1]Esau C, Kang X, Peralta E, et al. MicroRNA-143 regulates adipocytedifferentiation[J]. Biol Chem, 2004, 279(50):52361-52365.
[2]Huntzinger E, Izaurralde E. Gene silencing by microRNAs :contributions of translational repression and mRNA decay[J]. NatRev Genet, 2011, 12 :99-110.
[3]Iorio MV, Piovan C, Croce CM. Interplay between microRNAs andthe epigenetic machinery :an intricate network[J]. BiochimBiophys Acta, 2010, 1799 :694-701.
[4]Kajimoto K, Naraba H, Iwai N. MicroRNA and 3T3-L1 pre-adipocytedifferentiation[J]. RNA, 2006, 12 :1626-1632.
[5]Takanabe R, Ono K, Abe Y, et al. Up-regulated expression ofmicroRNA-143 in association with obesity in adipose tissue of micefed high-fat diet[J]. Biochem Biophys Res Commun, 2008, 376 :728-732.





