目前,应用神经组织工程学的方法来促进面神经的再生和修复已成为当今研究的新热点,我们在前期实验中应用神经干细胞(neural stem cells,NSCs)移植到可吸收的神经导管修复面神经的缺损取得的不错的效果,但在实验中发现来源于中枢的髓磷脂相关抑制物 (Nogo-A,myelin associat-ed inhibitors Nogo),髓磷脂相关糖蛋白 (myelinassociated glycoprotein,MAG),少突细胞-髓磷脂糖 蛋 白 (oligodendrocyte-myelinglycoprotein,Omgp)是阻碍神经再生的重要因素,这些因子都通过共同受体Nogo受体(Nogo receptor,NgR)起作用,因此,我们应用RNAi抑制NSCs中NgR的表达来探讨修复大鼠面神经缺损。
1材料与方法
1.1材料和试剂
pGCsi载体、感受态大肠杆菌DH5α购自上海吉凯公司、LipofectamineTM2000、NgR、MAP-2抗体购自Invitrogen公司,各种胎牛血清、EGF、bF-GF购自R﹠D公司,PLGA导管购自上海天清生物公司,其规格为内径0.8mm,外径1.2mm。
1.2方法
1.2.1 NSCs培养及鉴定 孕10d左右的SD大鼠,取其胚胎海马组织,进行NSCs的原代培养、3~4d半量换液,5~7d传代。种植NSCs于涂有多聚赖氨酸的小玻片上,采用甲醛固定,血清封闭,分别加入相应抗体等步骤后在显微镜下观察染色情况。具体步骤见文献〔1〕。
1.2.2 NgR shRNA表达载体的构建、扩增及鉴定 根据shRNA的设计原则、载体pGCsi的酶切位 点 以 及GenBank中NgR的 编 码 序 列(12407650),参考文献〔3〕合成针对NgR编码区360-380bp和1205-1225bp(AATCTTCCTG-CATGGCAACCG)(AAGCCTCAGTACTGGAA-CCCG)为小发夹的靶向的DNA片段。设计好的发夹送由上海生工有限公司定制合成,将人工合成的DNA序列的两条链,进行等浓度的退火结合,95℃加热5min,然后降至室温,形成具有粘性末端的互补双链,3h后与酶切后pGCsi载体产物在T4连接酶作用下连接,转化大肠杆菌感受态细胞,然后将150μl已转化的感受态细胞转移到琼脂培养液上,37℃过夜培养,克隆产物测序鉴定。
1.2.3脂质体介导NgR shRNA转染NSCs按照Invitrogen LipofectamineTM2000的说明书进行脂质体转染。转染前1d,于六孔板内接种1×105细胞,加入15% FBS的DMEM 2ml进行培养,将2μg NgR shRNA质 粒 和4μl LipofectamineTM2000先 分 别 用250μl不 含 抗 生 素 和 血 清 的DMEM稀释,后将稀释的质粒和LipofectamineTM2000混合,室温孵育20min。把这500μl混合物加入六孔板的培养液中,来回摇晃以混匀。设立实验组、空质粒对照组。细胞于37℃、5% CO2的培养箱中继续培养,转染6h后更换为含抗生素和血清的DMEM培养液,3d后在荧光显微镜下观察GFP的表达,计算其转染效率。
1.2.4 Western Blot检测NSCs中NgR的表达分别取实验组和空质粒对照组的NSCs,转染3d后见明显荧光,用冰预冷的PBS洗2次,加入细胞裂解液裂解抽提蛋白,按照Western Blot实验技术操作说明分别进行蛋白定量,SDS-PAGE电泳、转膜、封闭,及加入羊抗的NgR抗体和兔抗羊的二抗进行杂交、洗膜等操作后,把膜与Super SignalWestern Blotting化学发光底物室温孵育5min,曝光X光片,然后显影定影。
1.2.5经NgR shRNA干扰后NSCs的分化干扰后3d把有明显荧光的NSCs直接接种于涂有多聚赖氨酸的盖玻片上,置于35mm培养皿,待细胞贴壁后加入NSCs的分化培养液,2周后进行干细胞的分化鉴定,用甲醛固定,血清封闭,分别加入MAP-2抗体等方法进行神经元的鉴定,以未干扰的NSCs分化作为对照。在Leica QW3图像分析软件下在200倍视野下进行细胞计数,每组观察5张盖玻片,每张盖玻片观察6个不重复视野,计算各组神经元占总细胞数的比例,数据以x珚±s表示,应用SPSS 12.0统计软件,两组间数据比较采用t检验,以P<0.05为差异有统计学意义。
1.2.6干扰后NSCs移植入PLGA管,进行场扫描电镜观察干扰后的NSCs生长至培养瓶的70%~80%密度后,离心5min,去除上清液,加入1ml培养液,吹打后,计数板计数,得到细胞数约为(0.5~1.0)×105/ml,取出细胞悬液100μl加入细胞外基质200μl,形成混合液,将混合液注入培养液浸泡的PLGA管内,将PLGA管置于培养皿中,移入培养箱。种植后4h后发现细胞贴壁后加入干细胞的分化培养液,2周后,送至同济大学电镜室进行场扫描电镜观察。
2结果
2.1 NSCs培养结果
培养7d左右可见数十个乃至数百个细胞组成的神经球,细胞免疫化学结果示Nestin阳性,诱导分化可见大量形态各异的神经细胞,这些结果证实了所培养的细胞为NSCs。
2.2重组质粒的构建结果及转染结果
构建了2个NgR-shRNA表达载体质粒,分别命名为P1、P2,并经测序鉴定证实,所含目的基因序列准确无误,重组质粒构建成功。
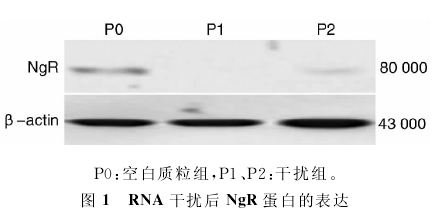
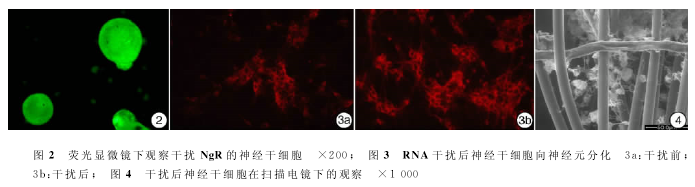
NgR-shRNA经脂质体介导转染NSCs,Western Blot检测结果:转染72h后,脂质体组可抑制NgR蛋白的表达,而裸质粒组对NgR蛋白的表达无明显影响(图1)。转染72h后在倒置荧光显微镜下观察细胞,P1、P2、阴性对照组均可见较多细胞表达绿色荧光,初步计算转染效率为40%~50%,各组间差异无统计学意义(图2)。NSCs转染后神经元的分化结果:沉默了NgR的NSCs,分化2周后向神经元分化的比例明显高于未转染组(图3),神经元比例分别为46.79±4.10、22.26±4.54,差异有统计学意义。
2.3场扫描电镜观察种植
NSCs的PLGA管在分化2周后可见导管壁上生长着各种形态的神经细胞(图4)
3讨论
目前,面神经断伤后的再生与修复仍是一项挑战性难题。近年来组织工程修复神经缺损已越来越受到重视,我们在前期实验中应用NSCs移植到可吸收的神经导管修复面神经的缺损取得的不错的效果,但在实验中发现来源于中枢的Nogo-A、MAG、Omgp是阻碍神经再生的重要因素,这些因子都通过共同受体NgR起作用,现已经证实它们对损伤后中枢神经的再生具有抑制作用,如果在基因水平下抑制NgR的表达,可直接减轻髓磷脂相关抑制物的抑制作用。近2年来发展迅速的小分子RNA干扰技术,提供了这种可行性。
RNA干扰是指通过人为地引入与内源靶基因具有相同序列的小的双链RNA,诱导内源性靶基因降解,达到阻止基因表达的目的,如何干扰NgR成为当前研究的重点。以siRNA实现基因沉默是将关于髓隣脂相关抑制因子的基础研究转化为基因干扰策略,NgR被认为是目前的最佳干预靶点。Li等将可溶性的大鼠NgR1蛋白进行膜内注射,该蛋白融入了大鼠的IgG1区,观察脊髓脊髓胸段半切断的大鼠脊髓轴突变化。发现经sNgR1-Ig治疗后轴突再生明显,而且功能明显的。
Kim等的研究也发现NgR基因缺陷小鼠脊髓全部横断14周后行为学评估有了很大改善。在周围神经损伤修复中,有文献报道坐骨神经切断后局部应用MAG可以减少损伤促进能够的恢复,但较少涉及到NgR的表达。我们前期实验应用NSCs移植修复周围性面神经的损伤,虽然实验证实有较好的神经修复结果,但由于原代培养的细胞来自于中枢的海马组织,体内外分化成胶质细胞的比例要大于神经元,髓磷脂相关抑制物的存在也进一步抑制了神经修复的结果。因此我们在本实验中成功构建了NgR-shRNA表达载体质粒,并通过稳定的脂质体介导成功转染NSCs,Western Blot的结果显示干扰后NSCs中NgR基因的表达较前减弱,转染后神经元的分化比例也明显高于转染前,从而为我们下一步的体内实验提供更好的神经营养支持。
总之,本研究成功干扰了NSCs中NgR的表达,使NSCs向神经元进一步分化,能更有效促进神经轴突的再生,为促进周围性面神经再生修复提供更好的种子细胞。
参考文献
[1] 施勇,周梁,田洁,等.神经干细胞移植到神经导管修复大鼠面神经缺损的研究[J].临床耳鼻咽喉头颈外科杂志,2012,26(22):1040-1042.
[2]GRANDPRE T,NAKAMURA F,VARTANIAN T,etal.Identification of the Nogo inhibitor of axon regenera-tion as a Reticulon protein[J].Nature,2000,403:43-44.
[3] 王朝鲁,孙红辉,杨有庚.Nogo受体基因干扰RNA表达载体的构建[J].中国实验诊断学,2006,10(11):1253-1254.
[4]WANG Y T,LU X M,ZHU F,et al.The use of agold nanoparticle based adjuvant to improve the thera-peutic efficacy of hNgR-Fc protein immunization inspinal cord-injured rats[J].Biomaterials,2011,32:7988-7998.
[5]SARAH C,BORRIE BASTIAN E,BAEUMER CH-RISTINE E,et al.The Nogo-66receptor family inthe intact and diseased CNS[J].Cell Tissue Res,2012,349:105-117.
[6]GITLIN L,KARELSKY S.Short interfering RNAconfers intracellular antiviral immunity in human cells[J].Nature,2002,418:430-434.
[7]MCDONALD C L,BANDTLOW C,REIND M.Tar-geting the nogo receptor complex in diseases of thecentral nervous system[J].Current Medicinal Chemis-try,2011,18:234-244.
[8]LI W,WALUS L,RABACCHI SA,et al.A neu-tralizing anti-Nogo66receptor monoclonal antibody re-verses inhibition of neurite outgrowth by central nerv-ous system myelin[J].J Biol Chem,2004,279:43780-43788.
[9]KIM J E,LIU B P,PARK J H,et al.Nogo-66re-ceptor prevents raphe spinal and rubro spinal axon re-generation and limits functional recovery from spinalcord injury[J].Neuron,2004,44:439-451.
[10]KOICHI T,TATEKI K,KEN M,et al.Myelin-as-sociated glycoprotein reduces axonal branching andenhances functional recovery after sciatic nerve tran-section in rats[J].Glia,2007,55:1498-507