摘 要: 12/15-脂氧合酶 (12/15-LOX) 是LOX的家族成员, 可通过对多不饱和脂肪酸的酶促氧化反应生成多种具有生物活性的脂质代谢产物, 如羟基二十碳四烯酸、脂氧素等。免疫细胞是免疫系统的重要组成部分, 主要发挥免疫防御、免疫自稳和免疫监视作用。越来越多的研究表明, 12/15-LOX及其代谢产物通过调节多种免疫细胞的发育及生物活性, 在炎症和免疫反应中发挥重要作用。有大量报道在疾病 (腹膜炎、哮喘、糖尿病、心血管疾病等) 进展过程中, 12/15-LOX对固有免疫和适应性免疫均有调节作用。在不同的病理生理状态下, 12/15-LOX对不同免疫细胞调控的具体作用及机制十分复杂且互相关联。
关键词: 12/15-脂氧合酶; 免疫细胞; 免疫调节;
Abstract: 12/15-lipoxygenase (12/15-LOX) are members of the LOX family, which mediate the enzymatic oxidation of polyunsaturated fatty acids, thereby contributing to the generation of various bioactive lipid mediators, like hydroxyeicosatetraenoic acids and lipoxins. Immune cells are an indispensable part of the immune system and play an important role in immune defense, immune homeostasis and immune surveillance. More and more studies have addressed the role of 12/15-LOX and its metabolites on inflammation and immunity by regulating the development and biological activity of various immune cells. There have been numerous reports indicating 12/15-LOX′s regulatory effects on innate and adaptive immunity during different disease progression, such as peritonitis, asthma, diabetes, cardiovascular diseases, etc. However, the biochemical mechanisms by which 12/15-LOX regulates immune cell function are complex and interrelated under different pathological and physiological conditions.
Keyword: 12/15-lipoxygenases; Immune cells; Immunoregulation;
人类有6种编码脂氧合酶 (lipoxygenase, LOX) 的基因, 包括花生四烯酸 (arachidonic acid, AA) 5-脂氧合酶 (arachidonate 5-lipoxygenase, ALOX5) 、ALOX12、ALOX12B、ALOX15、ALOX15B、ALOXE3, 其中由ALOX15基因编码的15-LOX-1是人类脂类代谢的关键酶, 可将花生四烯酸 (arachidonic acid, AA) 、亚油酸 (linolenic acid, LA) 、二十二碳六烯酸 (docosahexaenoic acid, DHA) 及其他多不饱和脂肪酸 (polyunsaturated fatty acids, PUFAs) 转变为有生物活性的脂质代谢产物, 如脂氧素、保护素、消退素、Maresins、12-羟基二十碳四烯酸 (12-hydroxyeicosate-traenoic acid, 12-HETE) 、15-HETE等, 从而影响细胞结构、代谢及信号转导。近年来, 将不同物种由ALOX15基因编码的产物统称为12/15-LOX, 它们结构不同但功能相似, 例如小鼠12-LOX、15-LOX和兔15-LOX-1等。尽管12/15-LOX与多种慢性炎性疾病的发病机制有关, 但它的生理功能包括强大的免疫调节特性, 在生理学上有助于消炎和清除炎症相关组织损伤, 代表产物为促炎症消退介质 (specialized pro-resolving lipid mediators, SPMs) , 这是一类具有相似促炎症消退作用的12/15-LOX的代谢产物, 包括脂氧素、消退素、保护素、Maresins[1,2]。可见, 12/15-LOX在免疫和组织稳态中的双刃剑作用, 免疫细胞在其中的作用不可忽视, 现就12/15-LOX代谢及其产物对免疫细胞的具体调控作用及机制予以综述。
1、 12/15-LOX及其代谢产物的关系
12/15-LOX的具体代谢过程, 如图1所示: (1) 若代谢底物为DHA, 12/15-LOX可将其转化为氢过氧化衍生物17S-过氧化DHA (17S-hydroperoxy-docosahexaenoic acid, 17S-HpDHA) 和14S-HpDHA, 前者经进一步代谢可生成消退素和保护素, 后者主要形成maresins; (2) 若底物为AA, 12/15-LOX可将其催化为12S-过氧化二十碳四烯酸 (12S-hydroperoxy-eicosatetraenoic acid, 12S-HpETE) 和15S-HpETE的混合物, 不同物种两者比例不同。12S-HpETE和15S-HpETE可在磷脂氢谷胱甘肽过氧化物酶 (phospholipid-hydroperoxide glutathione peroxidase, phGPx) 的作用下分别转化为12S-HETE和15S-HETE, 且15S-HpETE也可经5-LOX的作用生成脂氧素; (3) 若代谢底物为LA, 12/15-LOX可将其代谢为13S-氢过氧化十八碳二烯酸 (13S-hydroperoxy-9z, 11E-octadecadienoic acid, 13S-HpODE) , 后者在phGPx的作用下生成13S-羟基十八碳二烯酸 (13S-hydroxyoctadecadienoic acid, 13S-HODE) ; (4) 若底物为酯化PUFAs, 则在12/15-LOX的作用下生成对应的酯化代谢产物, 称为12/15-LOX源性氧化磷脂 (oxidized phospholipids, OxPL) , 如磷脂酰胆碱 (phosphatidylcholine, PC) 和磷脂酰乙醇胺 (phosphatidyl ethanolamine, PE) 酯化产物:12-HETE-PC、15-HETE-PC、12-HETE-PE、15-HETE-PE等[3]。
图1 12/15-LOX及其代谢产物的关系
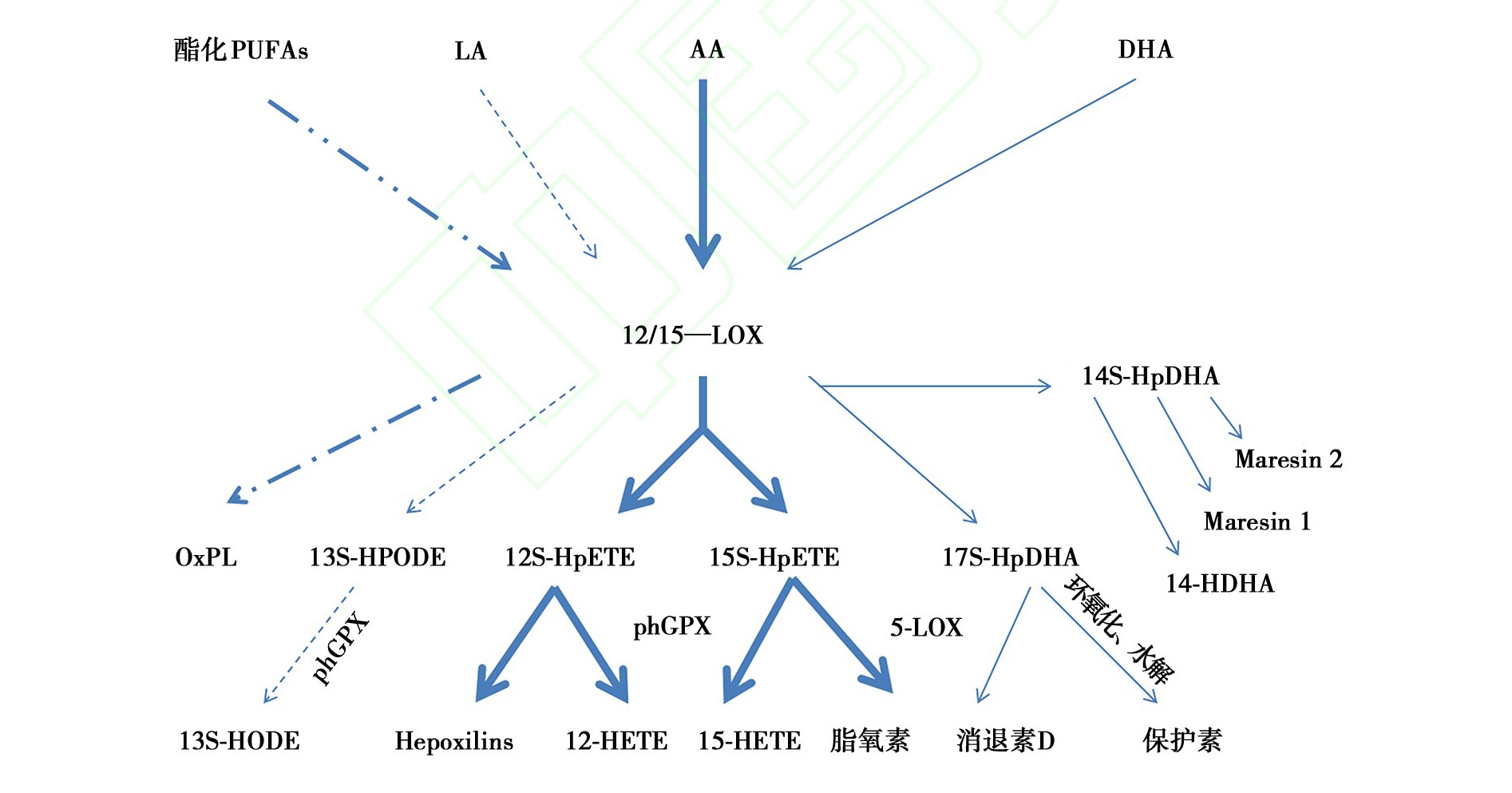
12/15-LOX:12/15-脂氧合酶;PUFAs:多不饱和脂肪酸;LA:亚油酸;AA:花生四烯酸;DHA:二十二碳六烯酸;OxPL:12/15-LOX源性氧化磷脂;13S-HPODE:13S-氢过氧十八碳二烯酸;13S-HODE:13S-羟基十八碳二烯酸;phGPx:磷脂氢谷胱甘肽过氧化物酶;12S-HpETE:12S过氧化二十碳四烯酸;15S-HpETE:15S过氧化二十碳四烯酸;Hepoxilins:羟基环氧素;12-HETE:12-羟基二十碳四烯酸;15-HETE:15-羟基二十碳四烯酸;5-LOX:5-脂氧合酶;17S-HpDHA:17S-过氧化二十二碳六烯酸;14S-HpDHA:14S-过氧化二十二碳六烯酸;14-HDHA:14-羟基二十二碳六烯酸
2、 不同代谢产物对免疫细胞的调节作用
2.1、 脂氧素
脂氧素主要由脂氧素A4 (lipoxins A4, LXA4) 、脂氧素B4 (lipoxins B4, LXB4) 、阿司匹林诱生型脂氧素组成。脂氧素的合成需要12/15-LOX和5-LOX两种酶共同完成, 由于这两种酶不是总由相同类型的细胞表达, 所以从AA到脂氧素的转化不仅可以在同一类型细胞中发生, 而且可以通过不同类型细胞合作完成。脂氧素可以通过与2型甲酰肽受体2 (formyl peptide receptor 2, FPR2) , 又称脂氧素A4受体 (lipoxin A4 receptor, ALX) 结合触发各种细胞信号级联反应, 包括磷脂酰肌醇-3-激酶/蛋白激酶B (phosphatidylinositol 3-kinase/protein kinase B, PI3K/Akt) 、细胞因子信号转导抑制分子、磷脂酶C、肌醇多磷酸5-磷酸酶、亚硝酸盐、RAS蛋白超家族、髓过氧化物酶 (myeloperoxidase, MPO) 等。脂氧素对不同类型细胞产生不同效应: (1) 自然杀伤 (natural killer, NK) 细胞和2型固有淋巴细胞 (innate lymphoid cell 2, ILC2) 表面均表达ALX/FPR2。对重症哮喘患者的临床分析及细胞实验表明, LXA4通过与NK和ILC2细胞表面ALX/FPR2结合, 增强NK细胞对嗜酸粒细胞的促凋亡作用, 减少ILC2分泌IL-13, 而已知IL-13在IgE介导的Ⅰ型变态反应中具有重要意义[4]。 (2) 急性肺损伤 (角叉菜胶、MPO及大肠埃希菌诱导) 小鼠模型中, 中性粒细胞首先被募集到感染部位, 阿司匹林诱导LXA4可以促进中性粒细胞凋亡小体的形成, 防止中性粒细胞过度浸润, 促进炎症消退[5]。体外细胞实验与此结果一致, El Kebir等[5]观察到阿司匹林诱导LXA4促进MPO共孵育的人中性粒细胞的凋亡发现有关机制包括下调αMβ2整合素 (macrophage-1 antigen, Mac-1) 的表达;减弱MPO诱导的细胞外信号调节激酶的活化和Akt介导的Bcl-2相关促凋亡蛋白磷酸化;减少抗凋亡蛋白Mcl-1的表达。 (3) 随着疾病进展, 巨噬细胞被募集到感染部位, 脂氧素可促进单核/巨噬细胞趋化和黏附, 通过快速激活巨噬细胞PI3K/Akt和胞外信号调节蛋白激酶/核转录因子2信号转导通路, 保护细胞线粒体功能, 强化抗氧化防御系统, 延迟巨噬细胞凋亡, 有助于巨噬细胞对中性粒细胞凋亡小体和病原体的吞噬, 促进炎症消退[6]。 (4) Tani等[7]在对酵母多糖诱导的腹膜炎小鼠模型的研究中发现, LXA4存在时, 嗜酸粒细胞促进巨噬细胞生成趋化因子CXCL13, 后者在抗炎过程中促使引流淋巴结肿大和病原菌的吞噬。 (5) Ramon等[8]在对人和小鼠外周血B细胞及鸡卵白蛋白抗原刺激小鼠进行研究后发现, LXA4通过与B细胞表面ALX/FPR2受体结合, 发挥抗B细胞增殖及减少记忆B细胞抗体数量的作用。研究发现, 小鼠骨髓12/15-LOX可以调节体内B细胞数量和先天性免疫抗体水平, 12/15-LOX基因剔除小鼠脾脏B细胞数量和肝、肺、血清中的总IgM显着高于野生型小鼠, 但具体调控机制未明, 可能也与脂氧素相关[9]。 (6) LXA4和白三烯B4 (leukotriene B4, LTB4) 能促使幼稚CD4+T细胞向T辅助滤泡细胞转化, 后者活化幼稚B淋巴细胞形成生发中心[10]。 (7) LXA4对树突状细胞的作用多样, 如LXA4不仅可抑制病原体刺激后树突状细胞的增殖和IL-12的产生, 还可以通过芳香烃受体和ALX上调细胞因子信号传导抑制因子2的表达来阻断炎症信号[11,12]。
2.2、 保护素
保护素是一类由12/15-LOX催化DHA形成的脂质代谢产物, 具有抗炎和器官保护效应。保护素可分为保护素D1 (protectin D1, PD1) 、保护素DX (protectin DX, PDX) 、阿司匹林诱生型PD1、反式阿司匹林诱生型PD1四类, 其中对前两种研究较多。PD1可由神经胶质细胞、中性粒细胞、巨噬细胞、T细胞、视网膜色素上皮细胞等产生, 在众多炎症模型中被证实有抗炎作用, 如在缺血性脑卒中小鼠模型中发现PD1抑制白细胞浸润、核因子κB (nuclear factor kappa B, NF-κB) 和环加氧酶2的产生[13]。在哮喘小鼠模型中减少气道嗜酸粒细胞和T淋巴细胞的招募、减少黏液分泌和促炎细胞因子产生, 可降低气道高反应性[14]。在脂多糖 (lipopolysac-charide, LPS) 诱导的急性肺损伤小鼠, PD1可加快中性粒细胞凋亡, 加速炎症的消退[15]。Ariel等[16]通过体外细胞实验 (人外周T淋巴细胞) 证实, PD1减少T细胞分泌肿瘤坏死因子 (tumor necrosis factor, TNF) 和γ干扰素 (interferon, IFN) , 促进T细胞凋亡, 促凋亡机制与PD1诱导细胞膜脂筏聚集和CD59聚集有关, 两者共同介导T细胞凋亡的信号转导。PD1不仅直接促进巨噬细胞对凋亡中性粒细胞的非炎症性吞噬, 还可上调中性粒细胞和T细胞表面C-C趋化因子受体5 (C-C chemokine receptor 5, CCR5) 的表达, 均有利于凋亡中性粒细胞的快速清除[17,18]。PDX是PD1的同分异构体, 在术后肠梗阻小鼠、LPS诱导的急性肺损伤小鼠及脓毒症小鼠均观察到PDX减少中性粒细胞浸润, 增加巨噬细胞比例, 发挥抗炎与器官保护作用[19,20,21,22]。此外, PDX还可以促使腹腔巨噬细胞向抗炎型M2型转化, 增强巨噬细胞的吞噬功能, 转化机制与过氧化物酶体增殖物激活受体γ (peroxisome prolifera-tor-activated receptor gamma, PPARγ) 信号通路激活有关[21]。体外细胞实验发现, PDX减少人中性粒细胞活性氧类 (reactiveoxygen species, ROS) 的产生, 抑制还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶的激活和MPO的释放[23]。
2.3、消退素
消退素包括E类消退素 (E-seriesresolvins, RvE) 即RvE1-RvE3、D类消退素 (D-seriesresolvins, RvD) 即RvD1-RvD6、阿司匹林触发消退素 (aspirin-triggered lipoxin, AT-Rv) , 其中RvE3和RvD的合成与12/15-LOX密切相关。Isobe等[24]首次分离并报道RvE3, 嗜酸粒细胞中的12/15-LOX催化二十碳五烯酸生成中间代谢产物17, 18-diHEPE, 17, 18-diHEPE有两种立体异构体, 均可以进一步生成RvE3。细胞和动物实验均表明, RvE3对中性粒细胞的炎性浸润有强大的抑制作用。RvD1、AT-RvD1、RvD3、AT-RvD3、RvD5均可以通过G蛋白偶联受体32 (G protein-coupled receptors 32, GPR32又称RvD1受体) 激活靶细胞发挥生物学作用[25,26,27]。GPR32蛋白是一种G蛋白偶联受体, 主要在人外周血中中性粒细胞、活化CD+8T细胞、CD+4T细胞、Th17细胞、组织巨噬细胞、小气道上皮细胞和脂肪组织中表达[28,29,30]。RvD1还可以通过G蛋白偶联受体FPR2/ALX发挥抗炎作用[31]。RvD1对免疫细胞的调节作用多样, 如抑制中性粒细胞趋化, 降低巨噬细胞Toll样受体介导的巨噬细胞活化, 降低脓毒症小鼠胸腺CD3+T淋巴细胞的凋亡率, 抵消脓毒症对免疫细胞的部分抑制作用[32]。另据报道, RvD1不仅可以直接抑制人B细胞产生IgE, 还可抑制幼稚淋巴细胞向分泌IgE型B细胞转化, 机制为RvD1特异性阻断IgE的重链基因 (εGLT) 的表达, 这种抑制作用在哮喘和过敏性疾病中对机体有重要的保护作用[33]。研究发现GPR18为RvD2的一种G蛋白偶联受体, 在人中性粒细胞、单核巨噬细胞均有表达, RvD2通过与GPR18结合抑制中性粒细胞浸润, 增强巨噬细胞对细菌的吞噬作用, 促进炎症快速消退[34]。有研究表明, RvD1和RvD2在器官再灌注损伤过程中发挥器官保护作用, GPR18缺陷小鼠的RvD2保护作用显着降低, 可能与抑制中性粒细胞浸润有关[34,35,36]。RVD1和RVD2还可以抑制促炎因子释放, 增加抗炎因子产生。Gu等[37]发现, RVD1、RVD2与相应受体结合后均可通过PI3K-Akt-糖原合成酶激酶3β (glycogen synthase kinase 3β, GSK3β) 发挥抗炎作用, 被PI3K激活的Akt通过磷酸化GSK3β强有力地抑制GSK3β的促炎作用, 磷酸化的GSK3β可抑制促炎细胞因子 (如TNF、IL-1β、IL-8、IL-12p40) 的产生, 磷酸化GSK3β还可以通过活化IL-10转录增强子-环腺苷酸反应元件结合蛋白 (cAMP-response element binding protein, CREB) 促进抗炎因子IL-10的转录。RvD3在炎症晚期出现时, 与人巨噬细胞表面GPR32受体结合, 增强巨噬细胞对外源性病原体颗粒的吞噬功能, 同时RvD3还可抑制中性粒细胞跨越上皮细胞, 减少中性粒细胞浸润, 减少炎症趋化因子, 如单核细胞趋化因子1 (monocytechemoattractant protein-1, MCP-1) 、角质细胞趋化因子等的释放。外源性补给RvD3和AT-RvD3可降低酵母聚糖刺激的小鼠炎性物质LTB4、前列腺素D2和血栓烷素B2水平, 同时增加抗炎物质前列腺素E2水平, 表明RvD3不仅可以直接调节免疫细胞功能, 还可以通过调节其他炎性介质水平间接调控免疫细胞及炎性因子水平, 阻断机体的炎症瀑布反应[38]。
2.4、 Maresins
Maresins主要包括Maresin 1 (MaR-1) 、Maresin 2 (MaR-2) 。由DHA转化为MaR-1的过程中, 13S, 14S-环氧化物中间体 (13, 14-epoxy-maresin, 13, 14-eMaR) 可以通过直接抑制LTA4水解酶, 选择性减少LTB4的生成。MaR-1和13, 14-eMaR都可以调节巨噬细胞亚型, 促使巨噬细胞由M1型向M2型转化[39,40]。MaR-1作为SPMs的一种, 起着与RvD1和RvD2类似的作用, 如减少急性炎症时中性粒细胞浸润、增加巨噬细胞对细菌和凋亡细胞的吞噬作用。研究发现, 在适应性免疫中SPMs同样发挥重要作用, 如抑制人外周血CD+4辅助性T细胞 (helper Tcell, Th细胞) 1和Th17细胞及CD+8T细胞活化, 减少细胞因子 (如TNF-α、IFN-γ、TNF-α、IFN-γ以及IL-17) 分泌[41]。SPMs还可以下调Th1细胞和Th17细胞的特征转录因子T-bet和Rorc, 阻止幼稚T细胞向Th1细胞和Th17细胞分化, 与GPR32和ALX/FPR2受体途径密切相关[41]。Deng等[42]将DHA在人12-LOX和可溶性环氧化物水解酶的作用下生成的产物13R、14S-diHDHA命名为MaR2。MaR2与MaR1类似, 表现出强大的抗炎作用, 如减少小鼠腹膜炎中性粒细胞的浸润, 增强人巨噬细胞对酵母多糖的吞噬作用, 但对人巨噬细胞的促吞噬及胞葬效应不如MaR1。
2.5、 15S-HETE
15S-HETE和13-HODE通过激活PPARγ通路不仅可以促进巨噬细胞表面清道夫受体CD36的表达和泡沫细胞的形成, 还可抑制IL-2的产生以及T细胞的增殖[43]。15S-HETE诱导单核细胞迁移及与内皮细胞的黏附过程, 与CREB刺激IL-17A基因转录增强有关, 且需要ROS存在。Kotla等[44]通过体内和体外实验阐明了15S-HETE介导单核细胞向炎症部位趋化的部分机制, 在ROS存在的前提下, 15S-HETE可诱导钙/钙调蛋白依赖性蛋白激酶Ⅳ (calcium/calmodulin-dependent protein kinase typeⅣ, CaMKⅣ) 的丝氨酸磷酸化, 磷酸化CaMKⅣ具有催化活化T细胞核因子3和激活蛋白1 (activator protein 1, AP-1) 转录因子亚基形成异源二聚体的能力, 该异源二聚体与组织因子的启动子近端的AP-1位点结合, 以激活组织因子的转录, 而组织因子的表达被证实与单核细胞向炎症区域迁徙和趋化密切相关, 抗组织因子抗体可抑制15S-HETE诱导的单核细胞的迁移。
2.6、 12S-HETE
12S-HETE作为促炎介质可促进MCP-1的合成, 发挥对单核细胞的趋化作用, 这与12S-HETE诱导蛋白激酶C、p38活化和增强还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶活性有关[45]。12S-HETE还能增强巨噬细胞的吞噬功能, 促进巨噬细胞分泌炎性因子IL-6、TNF-α、IL-1β和IL-12[46,47]。在P选择素或LPS存在的情况下, 12S-HETE可促进单核细胞分泌TF, 以此促进血栓形成。
2.7、 氧化磷脂 (oxidized phospholipids, OxPL)
12/15-LOX途径产生的OxPL也发挥重要的免疫调节作用。OxPL可通过抑制中性粒细胞氧化酶复合物的形成特异性抑制超氧化物的释放, 但不影响中性粒细胞的活力[48]。在LPS诱导的小鼠腹膜炎模型中观察到12-HETE-PE在炎症峰值时消失, 在炎症消退阶段可重新出现, 发现人类同系物15-HETE-PE能够抑制单核细胞在LPS刺激下细胞因子 (如TNF-α和G-CSF) 的产生, 机制可能是通过与LPS竞争模式识别受体 (如CD14和LPS结合蛋白) 以及干扰NF-κB信号转导而发挥有效的抗炎作用[49,50]。用卵清白蛋白使小鼠发生肺部过敏反应, 第6天检测小鼠的肺组织匀浆发现, 12-HETE-PE大幅度升高, 认为与嗜酸粒细胞的涌入和Th2细胞因子的诱导释放有关[49]。凋亡细胞的清除主要由选择性表达12/15-LOX的组织固有巨噬细胞完成, 12/15-LOX源性产物OxPL通过与炎性吞噬细胞表面凋亡细胞受体乳脂肪球表皮生长因子8结合, 阻断凋亡细胞与其受体的结合, 便阻断了凋亡细胞对炎性单核细胞、巨噬细胞和树突状细胞的呈递作用, 保证了凋亡细胞的非炎症性清除, 避免凋亡细胞衍生的自身抗原所致自身免疫性疾病[51]。另有研究报道, 12/15-LOX下游代谢产物氧化磷脂酰胆碱可促进树突状细胞的成熟和活化, 抑制Th17细胞分化, 进一步抑制Th17细胞诱导的自身免疫性疾病[52]。
3、 其他相关研究
心脏衰竭时, 12/15-LOX在巨噬细胞浸润、MCP-1升高、心脏纤维化中发挥重要作用[53]。12/15-LOX的表达量与巨噬细胞源性泡沫细胞的形成、动脉粥样硬化程度呈正相关, 而胰岛素生长因子可以通过下调12/15-LOX的表达来抑制脂质氧化和泡沫细胞的形成[54]。我国有学者发现, 人脐带间充质干细胞通过抑制小鼠肠腔巨噬细胞中15-LOX-1、IL-6和p-STAT3的表达, 减轻葡聚糖硫酸钠诱导的小鼠肠道炎症性疾病, 为炎症性肠病的治疗提供了参考[55]。12/15-LOX参与调控祖细胞和骨髓来源巨噬细胞的分化和增殖, 12/15-LOX缺陷的小鼠骨髓生成粒细胞增多, 而巨噬细胞减少, 这与IFN调控因子8的核周积聚有关[56]。
4、 小结
12/15-LOX及其代谢产物对免疫细胞的调节主要体现在以下3个方面: (1) 调控免疫细胞参与炎症免疫反应, 尽快清除病原菌, 减轻炎症反应。如脂氧素、消退素、保护素、Maresins减少中性粒细胞的浸润, 增强巨噬细胞对病原菌及凋亡中性粒细胞的吞噬作用, 减少炎性因子的分泌;保护素阻断T细胞向炎性部位迁移, 减少TNF和IFN-γ分泌, 促进T细胞凋亡;15S-HETE拮抗LTB4, 抑制中性粒细胞对炎症的过度反应。 (2) 减少自身免疫性疾病的发生, 维持机体免疫系统平衡与稳态。如LXA4对嗜酸粒细胞的促凋亡作用, 减少IgE介导的Ⅰ型变态反应;OxPL对AC的非炎症性清除, 避免AC衍生的自身抗原所致自身免疫性疾病, OxPL抑制Th17细胞分化, 进而抑制Th17细胞诱导的自身免疫性疾病等。 (3) 抗免疫细胞恶性增殖, 调控免疫细胞的数量及其成熟过程和亚型转化。如脂氧素抑制中性粒细胞、B细胞、T细胞、树突状细胞和肿瘤细胞增殖, 氧化磷脂酰胆碱促进树突状细胞的成熟与活化, MaR1和13, 14-eMaR促进巨噬细胞由M1型向M2型转化等。
12/15-LOX及其具有生物活性的代谢产物对免疫细胞进行精细的调控, 它们之间促炎与抗炎作用保持微妙的平衡, 最终维持机体的稳态。12/15-LOX的每个代谢产物对不同类型的免疫细胞在不同情况下发挥不同的调节作用, 12/15-LOX对免疫细胞的作用即是其所有代谢产物的作用总和, 但至今某些抗炎和促炎机制尚不明确, 仍需要进一步研究, 如何对12/15-LOX及其代谢产物进行调控来预防或治疗炎症性疾病、自身免疫性疾病以及肿瘤性疾病是今后的研究目标。
参考文献:
[1]Ivanov I, Kuhn H, Heydeck D. Structural and functional biology of arachidonic acid 15-lipoxygenase-1 (ALOX15) [J]. Gene, 2015, 573 (1) :1-32.
[2]欧唯为, 肖继, 陈泉, 等.特异性促炎症消退介质在炎症调控中的研究进展[J].临床与病理杂志, 2016, 36 (11) :1873-1877.
[3]Ackermann JA, Hofheinz K, Zaiss MM, et al. The double-edged role of 12/15-lipoxygenase during inflammation and immunity[J].Biochim Biophys Acta, 2017, 1862 (4) :371-381.
[4]Barnig C, Cernadas M, Dutile S, et al. Lipoxin A4 regulates natural killer cell and type 2 innate lymphoid cell activation in asthma[J].Sci Transl Med, 2013, 5 (174) :174ra26.
[5]El Kebir D, József L, Pan W, et al. 15-epi-lipoxin A4 inhibits myeloperoxidase signaling and enhances resolution of acute lung injury[J]. Am J Respir Crit Care Med, 2009, 180 (4) :311-319.
[6]Prieto P, Cuenca J, Través PG, et al. Lipoxin A4 impairment of apoptotic signaling in macrophages:Implication of the PI3K/Akt and the ERK/Nrf-2 defense pathways[J]. Cell Death Differ, 2010, 17 (7) :1179-1188.
[7]Tani Y, Isobe Y, Imoto Y, et al. Eosinophils control the resolution of inflammation and draining lymph node hypertrophy through the proresolving mediators and CXCL13 pathway in mice[J]. FASEB J, 2014, 28 (9) :4036-4043.
[8]Ramon S, Bancos S, Serhan CN, et al. Lipoxin A4 modulates adaptive immunity by decreasing memory B-cell responses via an ALX/FPR2-dependent mechanism[J]. Eur J Immunol, 2014, 44 (2) :357-369.
[9]Lauder SN, Tyrrell VJ, Allen-Redpath K, et al. Myeloid 12/15-LOX regulates B cell numbers and innate immune antibody levels in vivo version 1;referees:2 approved, 1 approved with reservations[J]. Wellcome Open Res, 2017, 2:1.
[10]Nagaya T, Kawata K, Kamekura R, et al. Lipid mediators foster the differentiation of T follicular helper cells[J]. Immunol Lett, 2017, 181:51-57.
[11]Aliberti J, Hieny S, Reis e Sousa C, et al. Lipoxin-mediated inhibition of IL-12 production by DCs:A mechanism for regulation of microbial immunity[J]. Nat Immunol, 2002, 3 (1) :76-82.
[12]Machado FS, Johndrow JE, Esper L, et al. Anti-inflammatory actions of lipoxin A4 and aspirin-triggered lipoxin are SOCS-2dependent[J]. Nat Med, 2006, 12 (3) :330-334.
[13]Marcheselli VL, Hong S, Lukiw WJ, et al. Novel docosanoids inhibit brain ischemia-reperfusion-mediated leukocyte infiltration and pro-inflammatory gene expression[J]. J Biol Chem, 2003, 278 (44) :43807-43817.
[14]Levy BD, Kohli P, Gotlinger K, et al. Protectin D1 is generated in asthma and dampens airway inflammation and hyperresponsiveness[J].J Immunol, 2007, 178 (1) :496-502.
[15]Li X, Li C, Liang W, et al. Protectin D1 promotes resolution of inflammation in a murine model of lipopolysaccharide-induced acute lung injury via enhancing neutrophil apoptosis[J]. Chin Med J (Engl) , 2014, 127 (5) :810-814.
[16]Ariel A, Li PL, Wang W, et al. The docosatriene protectin D1 is produced by TH2 skewing and promotes human T cell apoptosis via lipid raft clustering[J]. J Biol Chem, 2005, 280 (52) :43079-43086.
[17]Schwab JM, Chiang N, Arita M, et al. Resolvin E1 and protectin D1 activate inflammation-resolution programmes[J]. Nature, 2007, 447 (7146) :869-874.
[18]Ariel A, Fredman G, Sun YP, et al. Apoptotic neutrophils and T cells sequester chemokines during immune response resolution through modulation of CCR5 expression[J]. Nat Immunol, 2006, 7 (11) :1209-1216.
[19]Stein K, Stoffels M, Lysson M, et al. A role for 12/15-lipoxygenasederived proresolving mediators in postoperative ileus:protectin DX-regulated neutrophil extravasation[J]. J Leukoc Biol, 2016, 99 (2) :231-239.
[20]谭雯.保护素DX对急性肺损伤的保护效应及其相关机制[D].武汉:华中科技大学, 2016.
[21]夏海发. ProtectinDX对脓毒症小鼠的治疗作用及其相关机制研究[D].武汉:华中科技大学, 2016.
[22]Tan W, Chen L, Wang YX, et al. Protectin DX Exhibits Protective Effects in Mouse Model of Lipopolysaccharide-Induced Acute Lung Injury[J]. Chin Med J (Engl) , 2018, 131 (10) :1167-1173.
[23]Liu M, Boussetta T, Makni-Maalej K, et al. Protectin DX, a double lipoxygenase product of DHA, inhibits both ROS production in human neutrophils and cyclooxygenase activities[J]. Lipids, 2014, 49 (1) :49-57.
[24]Isobe Y, Arita M, Iwamoto R, et al. Stereochemical assignment and anti-inflammatory properties of the omega-3 lipid mediator resolvin E3[J]. J Biochem, 2013, 153 (4) :355-360.
[25]Krishnamoorthy S, Recchiuti A, Chiang N, et al. Resolvin D1 binds human phagocytes with evidence for proresolving receptors[J]. Proc Natl Acad Sci U S A, 2010, 107 (4) :1660-1665.
[26]Serhan CN, Chiang N, Dalli J, et al. Lipid mediators in the resolution of inflammation[J]. Cold Spring Harb Perspect Biol, 2014, 7 (2) :a016311.
[27]Orr SK, Colas RA, Dalli J, et al. Proresolving actions of a new resolvin D1 analog mimetic qualifies as an immunoresolvent[J].Am J Physiol Lung Cell Mol Physiol, 2015, 308 (9) :L904-911.
[28]Schmid M, Gemperle C, Rimann N, et al. Resolvin D1 Polarizes Primary Human Macrophages toward a Proresolution Phenotype through GPR32[J]. J Immunol, 2016, 196 (8) :3429-3437.
[29]Norling LV, Dalli J, Flower RJ, et al. Resolvin D1 limits polymorphonuclear leukocyte recruitment to inflammatory loci:Receptordependent actions[J]. Arterioscler Thromb Vasc Biol, 2012, 32 (8) :1970-1978.
[30]Hsiao HM, Thatcher TH, Levy EP, et al. Resolvin D1 attenuates polyinosinic-polycytidylic acid-induced inflammatory signaling in human airway epithelial cells via TAK1[J]. J Immunol, 2014, 193 (10) :4980-4987.
[31]Krishnamoorthy S, Recchiuti A, Chiang N, et al. Resolvin D1receptor stereoselectivity and regulation of inflammation and proresolving microRNAs[J]. Am J Pathol, 2012, 180 (5) :2018-2027.
[32]Chen F, Fan XH, Wu YP, et al. Resolvin D1 improves survival in experimental sepsis through reducing bacterial load and preventing excessive activation of inflammatory response[J]. Eur J Clin Microbiol Infect Dis, 2014, 33 (3) :457-464.
[33]Kim N, Ramon S, Thatcher TH, et al. Specialized proresolving mediators (SPMs) inhibit human B-cell IgE production[J]. Eur J Immunol, 2016, 46 (1) :81-91.
[34]Chiang N, Dalli J, Colas RA, et al. Identification of resolvin D2receptor mediating resolution of infections and organ protection[J].J Exp Med, 2015, 212 (8) :1203-1217.
[35]Kang JW, Lee SM. Resolvin D1 protects the liver from ischemia/reperfusion injury by enhancing M2 macrophage polarization and efferocytosis[J]. Biochim Biophys Acta, 2016, 1861 (9 Pt A) :1025-1035.
[36]Zhao Q, Wu J, Lin Z, et al. Resolvin D1 Alleviates the Lung Ischemia Reperfusion Injury via Complement, Immunoglobulin, TLR4, and Inflammatory Factors in Rats[J]. Inflammation, 2016, 39 (4) :1319-1333.
[37]Gu Z, Lamont GJ, Lamont RJ, et al. Resolvin D1, resolvin D2 and maresin 1 activate the GSK3beta anti-inflammatory axis in TLR4-engaged human monocytes[J]. Innate Immun, 2016, 22 (3) :186-195.
[38]Dalli J, Winkler JW, Colas RA, et al. Resolvin D3 and AspirinTriggered Resolvin D3 Are Potent Immunoresolvents[J]. Chem Biol, 2013, 20 (2) :188-201.
[39]Dalli J, Zhu M, Vlasenko NA, et al. The novel 13S, 14S-epoxymaresin is converted by human macrophages to maresin 1 (MaR1) , inhibits leukotriene A4 hydrolase (LTA4H) , and shifts macrophage phenotype[J]. FASEB J, 2013, 27 (7) :2573-2583.
[40]Serhan CN, Dalli J, Colas RA, et al. Protectins and maresins:New pro-resolving families of mediators in acute inflammation and resolution bioactive metabolome[J]. Biochim Biophys Acta, 2015, 1851 (4) :397-413.
[41]ChiurchiùV, Leuti A, Dalli J, et al. Proresolving lipid mediators resolvin D1, resolvin D2, and maresin 1 are critical in modulating T cell responses[J]. Sci Transl Med, 2016, 8 (353) :353ra111.
[42]Deng B, Wang CW, Arnardottir HH, et al. Maresin biosynthesis and identification of maresin 2, a new anti-inflammatory and pro-resolving mediator from human macrophages[J]. PLoS One, 2014, 9 (7) :e102362.
[43]Huang JT, Welch JS, Ricote M, et al. Interleukin-4-dependent production of PPAR-gamma ligands in macrophages by 12/15-lipoxygenase[J]. Nature, 1999, 400 (6742) :378-382.
[44]Kotla S, Singh NK, Kirchhofer D, et al. Heterodimers of the transcriptional factors NFATc3 and FosB mediate tissue factor expression for 15 (S) -hydroxyeicosatetraenoic acid-induced monocyte trafficking[J]. J Biol Chem, 2017, 292 (36) :14885-14901.
[45]Wen Y, Gu J, Vandenhoff GE, et al. Role of 12/15-lipoxygenase in the expression of MCP-1 in mouse macrophages[J]. Am J Physiol Heart Circ Physiol, 2008, 294 (4) :H1933-1938.
[46]Bolick DT, Orr AW, Whetzel A, et al. 12/15-lipoxygenase regulates intercellular adhesion molecule-1 expression and monocyte adhesion to endothelium through activation of RhoA and nuclear factorkappaB[J]. Arterioscler Thromb Vasc Biol, 2005, 25 (11) :2301-2307.
[47]Wen Y, Gu J, Chakrabarti SK, et al. The role of 12/15-lipoxygenase in the expression of interleukin-6 and tumor necrosis factor-alpha in macrophages[J]. Endocrinology, 2007, 148 (3) :1313-1322.
[48]Bluml S, Rosc B, Lorincz A, et al. The oxidation state of phospholipids controls the oxidative burst in neutrophil granulocytes[J].J Immunol, 2008, 181 (6) :4347-4353.
[49]Morgan AH, Dioszeghy V, Maskrey BH, et al. Phosphatidylethanolamine-esterified eicosanoids in the mouse:Tissue localization and inflammation-dependent formation in Th-2 disease[J]. J Biol Chem, 2009, 284 (32) :21185-21191.
[50]Bochkov VN, Oskolkova OV, Birukov KG, et al. Generation and biological activities of oxidized phospholipids[J]. Antioxid Redox Signal, 2010, 12 (8) :1009-1059.
[51]Uderhardt S, Herrmann M, Oskolkova OV, et al. 12/15-lipoxygenase orchestrates the clearance of apoptotic cells and maintains immunologic tolerance[J]. Immunity, 2012, 36 (5) :834-846.
[52]Rothe T, Gruber F, Uderhardt S, et al. 12/15-Lipoxygenase-mediated enzymatic lipid oxidation regulates DC maturation and function[J].J Clin Invest, 2015, 125 (5) :1944-1954.
[53]Minamino T. Role of 12/15 lipoxygenase-induced inflammation in heart failure[J]. Nihon Yakurigaku Zasshi, 2011, 138 (5) :187-191.
[54]Sukhanov S, Snarski P, Vaughn C, et al. Insulin-like growth factor I reduces lipid oxidation and foam cell formation via downregulation of 12/15-lipoxygenase[J]. Atherosclerosis, 2015, 238 (2) :313-320.
[55]Mao F, Wu Y, Tang X, et al. Human umbilical cord mesenchymal stem cells alleviate inflammatory bowel disease through theregulation of 15-LOX-1 in macrophages[J]. Biotechnol Lett, 2017, 39 (6) :929-938.
[56]Kinder M, Thompson JE, Wei C, et al. Interferon regulatory factor-8-driven myeloid differentiation is regulated by 12/15-lipoxygenasemediated redox signaling[J]. Exp Hematol, 2010, 38 (11) :1036-1046.





