摘 要: 目的 评价狂犬病疫苗脂质体冻干粉的免疫原性。方法 将狂犬病疫苗原液稀释至15 IU/mL,制备为稀释液冻干粉(Y1组);将该稀释液冻干粉与脂质体冻干粉按5∶3的体积比混合,制成物理混合物(Y2组);同时采用冻融-冻干法将狂犬病疫苗稀释液和脂质体配制成狂犬病疫苗脂质体冻干粉(Y3组)。将各组疫苗复溶后,分别于0、3、7、14、21 d经小鼠腹腔给药,0. 5 mL/只。MTT法检测小鼠脾淋巴细胞增殖能力,流式细胞术检测T淋巴细胞表面标记,ELISA法测定小鼠体液中狂犬病病毒抗体IgG(RV-IgG)浓度。结果 与Y1组及Y2组比较,Y3组初次免疫后3 d小鼠脾细胞刺激指数(stimulatingindex,SI)值明显升高(P <0. 01);初次免疫后7、14、21、28 d,CD4+/CD8+值明显升高(P <0. 05),初次免疫后7、14、21 d,RV-IgG浓度明显升高(P <0. 05)。结论 狂犬病疫苗脂质体冻干粉在小鼠体内具有良好的免疫原性,脂质体能提高疫苗免疫原性,延长疫苗的免疫时间,有望开发成为新一代广泛应用的疫苗佐剂。
关键词: 狂犬病疫苗; 冻干; 脂质体; 佐剂; 免疫原性;
Abstract: Objective To evaluate the immunogenicity of liposome lyophilized powder of rabies vaccine. Methods The bulk of rabies vaccine was diluted to a concentration of 15 IU/mL and prepared into diluent lyophilized powder(Y1).The diluent lyophilized powder was mixed with liposome lyophilized powder at a volume ratio of 5 ∶ 3 to prepare a physical mixture(Y2). Meanwhile,rabies vaccine liposome lyophilized powder(Y3) was prepared with the diluent and liposome by freezing and thawing-lyophilization. The vaccines in various groups were reconstituted and injected i.p. into mice on days 0,3,7,14 and 21 separately,0. 5 mL for each. The proliferation abilities of splenic lymphocytes of the mice in various groups were determined by MTT assay,while the surface markers of T lymphocytes by flow cytometry,and humoral anti-rabies virus IgG(RV-IgG)levels by ELISA. Results Compared with those in Y1 and Y2 groups,the stimulating index(SI)of splenocytes of mice in Y3 group 3 d after the first immunization increased significantly(P < 0. 01),while the CD4+/CD8+ ratio 7,14,21 and 28 d as well as the RV-IgG level 7,14 and 21 d after the first immunization increased significantly(P < 0. 05). Conclusion The rabies vaccine liposome lyophilized powder showed good immunogenicity in mice. The liposome enhanced the immunogenicity and prolonged the time duration of immunity of the vaccine,which was expected to be a widely used novel adjuvant.
Keyword: Rabies vaccine; Lyophilization; Liposome; Adjuvant; Immunogenicity;
狂犬病是一种传染性强、死亡率高的烈性传染病,及时接种疫苗是预防狂犬病发生和传染的有效途径。在疫苗制备中,佐剂的选择是影响疫苗使用效果的重要因素。目前,已上市的佐剂疫苗有铝佐剂疫苗[1,2,3,4,5]、磷酸钙疫苗[6]、免疫刺激复合物(ISCOMS)疫苗[7,8]、MF59疫苗[9,10,11,12]、AS03佐剂疫苗[13,14,15]、AS04佐剂疫苗[16]等,这些疫苗中的佐剂可增强疫苗免疫原性,同时也存在一些缺点,如诱导免疫类型单一[17,18,19,20,21],对机体的保护力不够[22];不良反应较严重,适用人群受限;运输、保存条件要求严格,运输成本高[11]等。脂质体是模拟生物膜的双分子层的超微球状佐剂,具有特殊的双层膜结构,可将疫苗包封于膜内,避免疫苗受到破坏,其不仅能作为疫苗佐剂提高疫苗免疫原性,还能作为运输疫苗的载体[23];另外,脂质体的主要成分磷脂及胆固醇可在机体内降解,确保了疫苗的安全性。
本课题组前期以脂质体作为疫苗佐剂及载体,对脂质体冻干粉疫苗进行了一系列免疫性和稳定性检测,结果表明,脂质体作为疫苗佐剂不仅能增强疫苗的免疫原性,还能提高疫苗的稳定性,减轻冷链运输压力[24,25,26,27,28,29];且免疫第14天,疫苗原液中和抗体水平明显低于脂质体疫苗,第28天后两组中和抗体水平相似,其原因可能是原液抗原浓度过高,导致脂质体包裹疫苗的数量少,使脂质体佐剂作用不明显[30]。本实验在狂犬病疫苗原液最佳稀释比例[31]的基础上,采用冻融-冻干法[24]制备稀释液的脂质体冻干粉,并检测其免疫原性,同时与狂犬病疫苗稀释液冻干粉及狂犬病疫苗稀释液冻干粉与脂质体冻干粉物理混合物进行比较,以评价狂犬疫苗脂质体冻干粉的免疫原性。
1、 材料与方法
1.1 、疫苗
人用Vero细胞狂犬病疫苗原液(未加人血白蛋白,RIFFIT法测定抗原含量为25.92 EU/mL,ELISA法测定效价为40 IU/mL,凯氏定氮法测定蛋白含量为22 mg/mL)购自武汉生物制品研究所有限责任公司。
1.2、 主要试剂及仪器
RPMI1640培养液购自美国HyClone公司;标准胎牛血清(FCS)购自天津灏洋生物制品科技有限公司;刀豆蛋白(ConA,SigmaC2631分装)及MTT(Amreseco793分装)购自北京科昊泽生物技术有限公司;红细胞裂解液购自碧云天生物科技有限公司;小鼠狂犬病病毒IgG(RV-IgG)ELISA试剂盒购自森贝伽生物科技有限公司;Anti-mouse CD4 PE、12-0041、Anti-mouse CD8a FITC、11-0081购自eBioscience公司;其他试剂均为市售分析纯;96孔培养板购自江苏江堰市新康医疗器械有限公司;BIO-RAD i MarkTM酶标仪购自美国伯乐公司;Cytomics FC500MPL流式细胞仪购自美国Beckman Coulter公司。
1.3 、实验动物
SPF级昆明小鼠,雌性,6~8周龄,体重18~22 g,购自昆明医科大学SPF实验动物中心,动物合格证号为:SYSK(滇)2005-0004。
1.4 、动物分组及给药
将人用Vero细胞狂犬病疫苗原液稀释至15 IU/mL,冻干制备疫苗稀释液冻干粉,即Y1组;将该稀释液冻干粉与脂质体冻干粉按5∶3的体积比进行物理混合,即Y2组;采用冻融-冻干法[28],将狂犬病疫苗稀释液和脂质体配制为狂犬病疫苗脂质体冻干粉,即Y3组。将Y1~Y3组样品复融后,分别于0、3、7、14、21 d经小鼠腹腔给药,0.5 mL/只。同时设PBS组(Y4组)及空白对照组(Y5组),每组均17只小鼠。
1.5、 脾淋巴细胞增殖能力的检测
采用MTT法[24,32]。于初次免疫后3、7、14、21、28 d处死小鼠,无菌摘取脾脏,研磨,分别用生理盐水、红细胞裂解液、RPMI1640培养液处理,每次加入处理液后均需吹打混匀,338×g离心5 min;用含10%灭活血清的完全培养液重悬脾淋巴细胞,按细胞终浓度为1.5×106个/mL接种至96孔板,100μL/孔,加入10μg/mL的ConA溶液,同时设空白对照孔(加入RPMI1640培养液),100μL/孔,均设3个复孔,于37℃,5%CO2细胞培养箱中培养48 h;加入5 mg/mL的MTT,20μL/孔,继续培养4 h;终止反应,加入100μL三联液溶解紫色结晶,37℃培养12 h,用酶标仪检测A570和A630值,按下式计算刺激指数(stimulatingindex,SI),以其判断小鼠淋巴细胞的增殖水平。
SI=(A570-A630)Con A孔/(A570-A630)空白对照孔
1.6 、T淋巴细胞表面标记的检测
采用流式细胞术[24]。取1.5项中制备的初次免疫后7、14、21、28 d脾淋巴细胞,用PBS悬浮,调整细胞数为3×106个/mL。取1 mL置于EP管中,分别加入1μL的Anti-mouse CD4 PE(L3T4,0.2 mg/mL)及1μL的Anti-mouse CD8a FITC(Ly-2,0.5 mg/mL),混匀,用锡箔纸避光标记30 min;通过Cytomics FC 500MPL流式细胞仪检测。
1.7、 小鼠狂犬病病毒抗体IgG(RV-IgG)水平的检测
采用ELISA法。于初次免疫后7、14、21、28 d无菌摘取小鼠眼球取血,分离血清,采用小鼠RV-IgG ELISA试剂盒进行检测,通过酶标仪检测A450值,并按下式计算小鼠血清中RV-IgG水平。
RV-IgG水平(IU/mL)=0.029 7×A450值(R2=0.997 2)×稀释倍数
1.8 、统计学分析
应用SPSS 17.0软件进行统计学分析,实验数据采用均值±标准差形式表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2、 结果
2.1、 脾淋巴细胞的增殖能力
初次免疫后3 d,Y3组小鼠的SI明显高于Y1、Y2、Y4、Y5组(F=31.324,P<0.01);初次免疫后7 d,Y3组SI值明显高于Y2、Y4、Y5组(F=230.158,P<0.01),与Y1比较差异无统计学意义(F=1.670,P>0.05);初次免疫后14 d,Y3组与Y1、Y2组比较,差异无统计学意义(F=1.807,P>0.05),均具有较高的SI值,表明以脂质体作为载体及佐剂的疫苗可引起较强的脾细胞增殖;初次免疫后21 d,Y3组与Y5组差异具有统计学意义(F=6.720,P<0.05),与其他各组间比较,差异均无统计学意义(F=1.37,P>0.05),表明21 d时疫苗对脾淋巴细胞增殖的刺激作用减弱。整体来看,初次免疫后7及14 d时,Y1和Y3组SI值均较高,随后逐渐降低,21 d后均趋于平稳。见表1。
2.2 、T淋巴细胞的表面标记
初次免疫后7、14、21、28 d,Y3组小鼠T淋巴细胞CD4+/CD8+值均明显高于Y1、Y2、Y4、Y5组(F分别为8.568、6.690、30.236、24.842,P<0.05),表明Y3组细胞免疫水平明显高于Y1组。Y2组小鼠T淋巴细胞CD4+/CD8+值与Y1组比较,差异无统计学意义(F分别为0.016、6.400、20.441、0.091、P>0.05),表明制备的脂质体作为佐剂需对狂犬病疫苗进行包载方可增强小鼠的细胞免疫水平。见表2。
2.3 、小鼠血清中RV-IgG的水平
初次免疫后3 d,各组小鼠血清中均未检测到RV-IgG,表明此时未产生RV-IgG抗体。除初次免疫后21 d时,Y4组小鼠血清被污染未检测外,初次免疫后7、14、21、28 d,Y3组RV-IgG均明显高于Y4和Y5组(F分别为4 061.638、5 268.680、9 486.353、787.351,P<0.01)。免疫后7、14、21 d,Y3组RV-IgG水平明显高于Y1、Y2组(F分别为52.959、148.611、21.079,P<0.05);免疫后28 d,Y3组RV-IgG水平明显高于Y1组(F=13.850,P<0.05),但与Y2组比较,差异无统计学意义(F=0.013,P>0.05)。见表3。表明Y3组在7~28 d可维持较好的免疫原性,于初次免疫后14 d小鼠血清中RV-IgG抗体水平迅速升高,较Y1和Y2组RV-IgG抗体产生得更早,水平更高。
表1 免疫后各组小鼠脾细胞的SI值
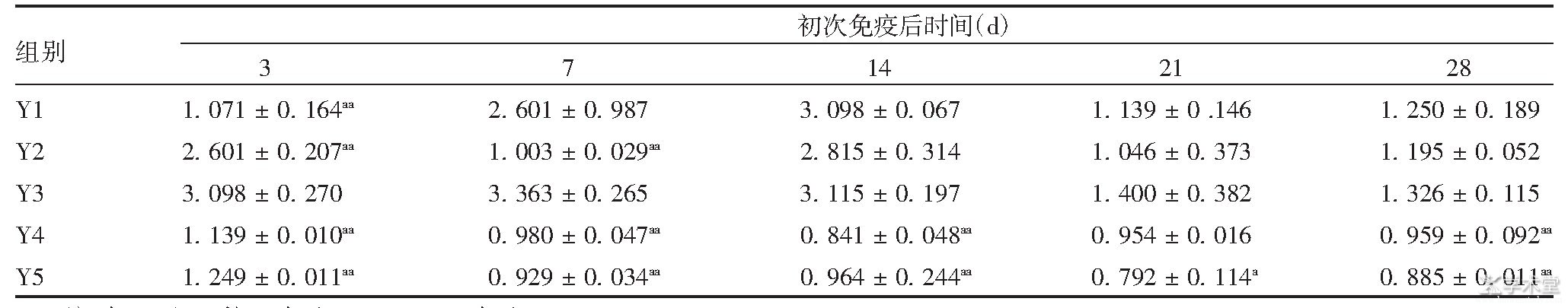
注:与Y3组比较,a表示P<0.05;aa表示P<0.01。
表2 免疫后各组小鼠脾细胞的CD4+/CD8+值
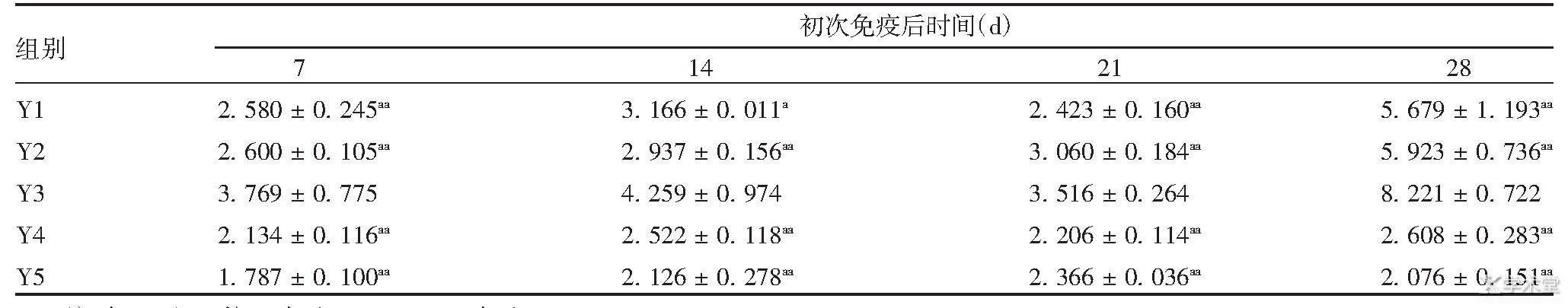
注:与Y3组比较,a表示P<0.05;aa表示P<0.01。
表3 免疫后各组小鼠血清中RV-IgG浓度
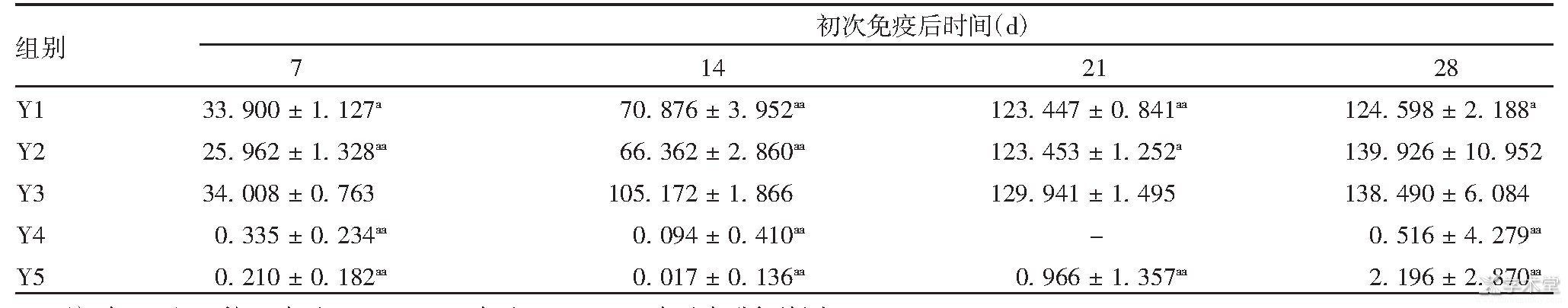
注:与Y3组比较,a表示P<0.05,aa表示P<0.01;-表示未进行检测。
3、 讨论
MTT法检测结果显示,初次免疫后3~28 d,Y3组小鼠脾淋巴细胞增殖的平均水平均高于Y1和Y2组(P<0.05);ELISA法测定结果表明,初次免疫后7~21 d,Y3组小鼠产生的RV-IgG明显高于Y1和Y2组(P<0.05);初次免疫后28 d,Y3组小鼠产生的RV-IgG明显高于Y1组(P<0.05),且Y2和Y3组小鼠产生RV-IgG的水平一致。流式细胞术检测T淋巴细胞表面标记试验结果表明,初次免疫后7~28 d,Y3组的CD4+/CD8+值明显高于Y1和Y2组(P<0.01)。表明脂质体作为狂犬病疫苗佐剂及载体能对机体产生更强的保护力。ELISA法测定RV-IgG及流式细胞仪检测T淋巴细胞表面标记试验中,初次免疫后21及28 d,Y3组较Y1组均能更显着诱导机体产生细胞免疫及体液免疫(P<0.05),表明脂质体作为疫苗载体及佐剂能延长疫苗的免疫时间。
在MTT试验结果中,初次免疫后3 d平均SI值较低,可能是由于机体刚接触抗原,仍处于非特异性免疫识别的阶段;初次免疫后7 d时SI值均较高,可能是由于巨噬细胞吞噬功能,Y3组明显高于Y1组(P<0.05),可能是由于脂质体粒径引起的天然被动靶向于网状内皮系统(reticuloendothelial system,RES)丰富的脾脏,T淋巴细胞受到刺激,迅速增殖、分化,而Y2组较低可能由于脂质体和疫苗呈现出了一种竞争关系,部分巨噬细胞吞噬了不含抗原的空白脂质体,不能引起后续T淋巴细胞的增殖分化,导致SI较低;初次免疫后21 d的平均SI值较低,表明在21 d后已不能诱发强烈的脾淋巴细胞增殖。
脂质体在作为疫苗佐剂时,较免疫相同周期的最佳稀释液能诱导更强的免疫反应,且安全性好、副作用小、具有天然靶向性、可作为半抗原的载体诱发半抗原特异性免疫应答、能降低被包裹抗原的毒性、提高抗原稳定性、延长疫苗的免疫时间等优点,有望在不久的将来成为新一代广泛应用的疫苗佐剂。
参考文献
[1]SHEN J Q.Effect of LPSp toimprove the immune efficiency of rabies vaccine[D].Nanning:Guangxi Medical University,2007.(in Chinese)申继清.LPSp增强狂犬病毒抗原免疫效果的实验研究[D].广西南宁:广西医科大学,2007.
[2]YUE Z,ZHAO Y X,WANG H.Properties and advance in research of aluminium adjuvant[J].Chin J Biologicals,2016(12):1349-1354.(in Chinese)岳卓,赵玉秀,王辉.铝佐剂的特性及其研究进展[J].中国生物制品学杂志,2016(12):1349-1354.
[3]CHEN T T,LU W G.Research progress of aluminum adjuvant[J].World Clin Med,2015(2):128-134.(in Chinese)陈婷婷,陆伟根.铝佐剂特性及其研究进展[J].世界临床药物,2015(2):128-134.
[4]LIU Y B,MAO S B,ZHOU F,et al.Aluminium adjuvants and their application in influenza vaccines[J].Int J Biologicals,2016,39(4):187-190.(in Chinese)刘玉斌,毛树宝,周锋,等.铝佐剂及其在流感疫苗中的应用[J].国际生物制品学杂志,2016,39(4):187-190.
[5]ZHANG B J.Research progress on the properties and action mechanism of aluminum adjuvants[J].Int J Biologicals,2018,41(4):185-189.(in Chinese)张冰洁.铝佐剂的性质及作用机制研究进展[J].国际生物制品学杂志,2018,41(4):185-189.
[6] 彭祥兵.WHO关于人用疫苗新左剂的第二次专题讨论会[J].国外医学预防、诊断、治疗用生物制品分册,2003,26(2):76-80.
[7]SJ觟LANDER A,DRANE D,MARASKOVSKY E,et al.Immune responses to ISCOM formulations in animal and primate models[J].Vaccine,2001,19(17):2661-2665.
[8]HUO N B.Development of human immune adjuvant[J].JPharm Res,2010,29(2):103-106.(in Chinese)霍宁波.人用免疫佐剂的前景展望[J].药学研究,2010,29(2):103-106.
[9]FREY S,POLAND G S,PODDA A.Comparison of the safety,tolerability,and immunogenicity of a MF59-adjuvanted influenza vaccine and a non-adjuvanted influenza vaccine in non-elderly adults[J].Vaccine,2003,21(27):4234-4237.
[10]GRAZIA G,MEDINI D,BORGOGNI E,et al.Adjuvanted H5N1 vaccine induces early CD4+T cell response that predicts long-term persistence of protective antibody levels[J].Proc Natl Acad Sci USA,2009,106(10):3877-3882.
[11]SIVAKUMAR S M,SAFHI M M,KANNADASAN M,et al.Vaccine adjuvants-Current status and prospects on controlled release adjuvancity[J].Saudi Pharm J,2011,19(4):197-206.
[12]O'HAGAN DEREK T,DE GREGORIO E.The path to a successful vaccine adjuvant-′The long and winding′[J].Drug Discov Today,2009,14(11-12):541-551.
[13]COFFMAN ROBERT L,SHER A,SEDER R A.Vaccine adjuvants:putting innate immunity to work[J].Immunity,2010,33(4):492-503.
[14]MBOW M L,DE GREGORIO E,VALIANTE N M,et al.New adjuvants for human vaccines[J].Curr Opin Immunol,2010,22(3):411-416.
[15]LIU Y B,CHEN Z.Application of new generation adjuvants MF59 and AS03 in influenza vaccines[J].Int J Biologicals,2016,39(5):228-232,241.(in Chinese)刘玉斌,陈则.新型佐剂MF59和AS03在流感疫苗中的应用[J].国际生物制品学杂志,2016,39(5):228-232,241.
[16] 周洋.不同类型佐剂对BALB/c小鼠免疫系统作用的研究[D].北京:中国食品药品检定研究院,2013.
[17]WEN X B,ZHANG L L,RAN X H.Update of mechanisms of action for aluminum-based adjuvants[J].Modern Animal Husbandry Veter,2016(11):47-52.(in Chinese)闻晓波,张玲玲,冉旭华.铝佐剂的作用机制研究进展[J].现代畜牧兽医,2016(11):47-52
[18]HE P,HU Z Y.Advance in study on influencing factors of action mechanism and on improvement of aluminum-based adjuvant[J].Chin J Biologicals,29(6):654-659.(in Chinese)何鹏,胡忠玉.铝佐剂效应的影响因素及铝佐剂疫苗改进的研究进展[J].中国生物制品学杂志,29(6):654-659.
[19]FANG X,LIANG Z L.Progress in research on action mechanism of adjuvant in vaccines for human use[J].Chin J Biologicals,2015,28(8):866-870.(in Chinese)方鑫.人用疫苗佐剂作用机制的研究进展[J].中国生物制品学杂志,2015,28(8):866-870.
[20]BRITO L A,MALYALA P,O′HAGAN D T.Vaccine adjuvant formulations:a pharmaceutical perspective[J].Seminars Immunol,2013,25(2):130-145.
[21]WILSON-WELDER J H,TORRES M P,KIPPER M J,et al.Vaccine adjuvants:current challenges and future approaches[J].J Pharm Sci,2010,98(4):1278-1316.
[22]LIU Y B,GENG X C,WANG J F,et al.Recent progress in researches for action mechanism of adjuvants[J].Chin J Drugs,2015,24(20):58-63.(in Chinese)刘轶博,耿兴超,汪巨峰,等.免疫佐剂作用机制研究新进展[J].中国新药杂志,2015,24(20):58-63.
[23]MUKHERJEE F,PRASAD A,BAHEKAR V S,et al.Evaluation of immunogenicity and protective efficacy of a liposome containing Brucella abortus S19 outer membrane protein in BALB/c mice[J].2016,17(1):1.
[24] 徐菀佚.狂犬病疫苗脂质体冻干粉的制备及其免疫原性研究[D].云南昆明:昆明医科大学,2015.
[25]CHEN J W.A study on immunogenicity of influenza vaccine lyophilized liposome prepared by different methods[J].Acta Univ Med Nanjing(Nat Sci),2013(7):1019-1023.(in Chinese)陈建雯.流感疫苗脂质体干粉制备方法对其免疫原性影响研究[J].南京医科大学学报(自然科学版),2013(7):1019-1023.
[26]LIN Y J.The preparation of influenza vaccine liposome and thestudy of its properties[D].Kunming:Kunming Medical College,2009.(in Chinese)林意菊.流感疫苗脂质体的制备及性质研究[D].云南昆明:昆明医学院,2009.
[27]XU Y J,MA B,DAI Y B,et al.Study on mucosal immunity of influenza vaccine lyophilized liposome[J].Suzhou Univ JMed Sci,2012,32(4):499-503.(in Chinese)徐勇军,马波,代云波,等.流感疫苗脂质体干粉黏膜免疫研究[J].苏州大学学报(医学版),2012,32(4):499-503.
[28]XU W Y,QIAO J B,MA B,et al.Cellular immunity of influenza vaccine lyophilized liposome produced by freeze-thawing[J].J Chin Pharm Univ,2015,46(6):730-733.(in Chinese)徐菀佚,乔建斌,马波,等.冻融-冻干法制备的流感疫苗脂质体的细胞免疫研究[J].中国药科大学学报,2015,46(6):730-733.
[29]LU W D,LIN Y J,MA B,et al.Stability of influenza vaccine liposome powder[J].J Chin Pharm Univ,2010,41(4):360-362.(in Chinese)鲁卫东,林意菊,马波,等.流感疫苗脂质体干粉的稳定性[J].中国药科大学学报,2010,41(4):360-362.
[30]YE H Y.The preparation and celluar immune study of rabies[D].Kunming:Kunming Medical University,2016.叶红艳.冻融-冻干法制备狂犬病疫苗脂质体及其细胞免疫研究[D].云南昆明:昆明医科大学,2016.
[31]FAN Y C,FU W,PU M D,et al.Different diluted concentrations of liposomes immunogenicity of rabies vaccine[J].JKunming Med Univ,2019,40(5):14-17.(in Chinese)范宇超,付围,普梦笛,等.不同稀释浓度对狂犬病疫苗脂质体免疫原性的影响[J].昆明医科大学学报,2019,40(5):14-17.
[32] 孙黎飞.细胞免疫学实验研究方法[M].北京:人民军医出版社,2009.





