摘 要: 目的:探讨水飞蓟宾对人口腔上皮样癌细胞KB细胞株增殖和侵袭的影响。方法:用不同浓度的水飞蓟宾和JNK抑制剂sp600125作用于体外培养的KB细胞株,应用CCK-8检测细胞24 h,48 h和72 h存活率;平板克隆形成实验检测KB细胞的增殖情况,Transwell检测KB细胞的侵袭能力,蛋白免疫印迹实验分析p-JNK,VEGF和MMP-9蛋白的表达水平。结果:CCK-8结果显示水飞蓟宾对KB细胞株的增殖具有明显的抑制作用,且呈时间剂量依赖性;平板克隆实验表明,水飞蓟宾显着抑制KB细胞的集落形成;侵袭试验结果表明,水飞蓟宾能够以剂量依赖的方式抑制KB细胞的侵袭作用;蛋白免疫印迹试验显示水飞蓟宾处理后,JNK的磷酸化水平、VEGF和MMP-9的表达水平显着下调。JNK抑制剂sp600125作用于KB细胞后,VEGF和MMP-9蛋白的表达水平明显下调,且集落的形成和侵袭均受到了明显的抑制。结论:水飞蓟宾具有明显的抑制KB细胞增殖和侵袭的作用;其作用机制可能是通过抑制JNK通路,进而下调VEGF和MMP-9的表达。
关键词: 水飞蓟宾; KB细胞株; 增殖; 侵袭;
Abstract: Objective:To investigate the effect of silibinin on proliferation and invasion in human oral epithelioid carcinoma KB cell line.Methods:The KB cells were cultured in vitro with different concentrations of silibinin and JNK inhibitor sp600125.CCK-8 assay was used for detecting the survival rate of cells at 24 h,48 h and 72 h.Plate colony formation assay was used to detect the effect of KB cell proliferation.Transwell chamber was used to detect the invasion of KB cells.The expression levels of p-JNK,VEGF and MMP-9 were analyzed by western blotting.Results:CCK-8 results showed that silibinin had a significant inhibitory effect on the proliferation of KB cell lines in a time-dose-dependent manner.Plate cloning experiments showed that silibinin significantly inhibited colony formation of KB cells.The results of the invasion test showed that silibinin could inhibit the invasion of KB cells in a dose-dependent manner.Western blotting showed that the phosphorylation level of JNK,the expression levels of VEGF and MMP-9 were significantly down-regulated after treatment with silibinin.The expression levels of VEGF and MMP-9 proteins were significantly down-regulated,and the formation and invasion of colonies were significantly inhibited after treating with the JNK inhibitor sp600125 in KB cells.Conclusion:Silibinin has obvious inhibitory effect on KB cell proliferation and invasion.The anti-tumor mechanism may be related to down-regulate the expression of VEGF and MMP-9 by inhibiting JNK pathway.
Keyword: silibinin; KB cell line; proliferation; invasion;
口腔癌是一种主要与吸烟、饮酒、慢性炎症、病毒感染及遗传有关的多因素恶性肿瘤[1],其特征为高度局部浸润性和高颈淋巴结转移率。相关研究表明口腔癌的病理病因与调节细胞生长、增殖和细胞凋亡的基因突变密切相关[2]。目前,口腔癌治疗策略最常见的是化疗、放疗和手术以及这些方法的组合[3]。单一的治疗手段容易发生术后复发和转移,远期疗效不理想,而化学药物治疗可抑制肿瘤细胞活性,为较好的预后提供可能的机会[4]。但是化疗药物的全身毒性使其在癌症治疗中的有效性受到限制,因此,通过从天然产物及其衍生物中寻找具有高效力和最小副作用的新型抗癌物质进行预防和治疗是癌症治疗的新兴领域。
大多数植物化学物质是人类饮食的组成部分并被视为膳食补充剂。水飞蓟宾是从水飞蓟(silybum marianum L.Gaertn)的果实和种子中分离的类黄酮水飞蓟素的主要活性成分,是有效的膳食植物化学物质之一,其较强的抗肿瘤活性和分子作用机制是目前研究的热点。研究表明水飞蓟宾对肝癌[5]、宫颈癌[6]、膀胱癌[7]、结肠癌[8]、肺癌[9]、卵巢癌[10]均有抑制作用,主要表现为阻滞细胞周期、诱导细胞凋亡、破坏有丝分裂和抑制血管生成等作用[11]。在口腔癌方面,李云鹏等[12]考察了水飞蓟宾对人舌癌细胞的抑制作用,并阐述其可能是阻滞G1期;Chen等[13]发现水飞蓟宾通过抑制MAPK途径抑制SCC-4舌癌细胞的侵袭;Gohulkumar等[14]将水飞蓟宾包封在纳米颗粒中并研究其在口腔癌(KB)细胞中的细胞毒性和细胞凋亡诱导的抗癌作用,结果表明水飞蓟宾纳米颗粒可用作有效药物输送系统来治疗癌症。尽管水飞蓟宾已显示作为化学治疗剂抑制口腔癌细胞的潜力,但其分子机制仍然未知。因此,本研究的目的是通过作用于KB口腔癌细胞,确定水飞蓟宾是否具有作为化疗药物的潜力并阐明水飞蓟宾在KB细胞中的作用机制。

1 、材料和方法
1.1、 细胞株
人口腔上皮癌KB细胞株,购于中科院上海细胞库。
1.2 、主要试剂
MEM 培养基、胎牛血清和胰蛋白酶购自美国Gibco公司;DMSO、CCK-8和结晶紫染料购自碧云天生物技术研究所;Transwell小室和Matrigel基质胶购于美国Corning公司;水飞蓟宾和sp600125购自美国Sigma公司;兔抗人p-JNK抗体、兔抗人JNK抗体、兔抗人MMP-9抗体、兔抗人β-actin抗体和山羊抗兔二抗购自美国CST公司,兔抗人VEGF抗体购自美国Abcam公司。
1.3、 方法
细胞培养KB细胞培养于含10%胎牛血清的MEM培养基中,置于37 ℃、5%CO2浓度的恒温培养箱中培养,每2~3天传代1次。
1.3.1、 CCK-8检测细胞存活率
消化收集对数生长期的细胞,以5×103个/孔接种于96孔板中过夜培养。待细胞贴壁后,更换含不同浓度水飞蓟宾(0,5,10,20,50 μmol/L)的培养基,置于培养箱培养24 h、48 h、72 h。终止培养前2 h在每孔中加入10 μl CCK-8溶液,继续培养2 h后,酶标仪读OD450nm,对照组设置为100%,给药组与对照组相比,计算细胞存活率。
1.3.2 、平板克隆形成实验
将KB细胞以200个/孔接种于6孔板中,在含有不同浓度的水飞蓟宾(0,5,10,20 μmol/L)或JNK抑制剂sp600125(10 μmol/L)的培养基中培养10天,待集落形成后,弃去培养液,用PBS清洗2遍,多聚甲醛固定15 min后,用结晶紫染色15 min,PBS清洗多余的结晶紫染料。
1.3.3、 Transwell侵袭实验
将KB细胞用0、5、10、20 μmol/L的水飞蓟宾或10 μmol/L的sp600125预处理24小时后,PBS清洗3次,消化收集细胞并计数;将预先铺设好基质胶的Transwell小室放入24孔板中,下室加入600 μl含5%FBS的培养基;将细胞以5×104/孔种于上室,上下室均含有实验分组浓度的药物,置37 ℃、5%CO2、饱和湿度条件下培养12 h。取出Transwell小室,用棉签擦去微孔膜上层细胞;PBS冲洗2遍;使用多聚甲醛室固定15 min,结晶紫染色15 min,PBS冲洗去除多余染料;在倒置显微镜下对迁移至微孔膜下层的细胞进行观察拍照。
1.3.4、 Westren blot蛋白印迹实验
将不同浓度(0,5,10,20 μmol/L)的水飞蓟宾作用KB细胞1 h,检测JNK的蛋白表达。使用不同浓度(0,5,10,20 μmol/L)的水飞蓟宾和10 μmol/L sp600125作用KB细胞48 h,检测VEGF和MMP-9的表达。药物处理相应的时间后,用RIPA裂解液裂解细胞,提取总蛋白,并用BCA测定总蛋白的浓度。聚丙烯酰胺凝胶电泳分离蛋白,并使用湿转将蛋白转移至PVDF膜上,用5%脱脂牛奶在37 ℃封闭1 h,一抗4 ℃过夜孵育,TBST漂洗3次后,二抗室温孵育1 h,TBST漂洗6次后,用ECL发光液曝光显影。用软件扫描蛋白条带并定量分析蛋白的表达情况。
1.4 、统计学方法
实验数据统计分析采用SPSS 13.0统计软件进行统计分析,结果以均数±标准差(x ? ±s)(x?±s)来表示,并用单因素方差分析进行处理,组间进行t检验,P<0.05认为差异具有统计学意义。
2 、结果
2.1、 水飞蓟宾对人口腔癌KB细胞增殖的影响
不同浓度的水飞蓟宾(0,5,10,20,50 μmol/L)作用于人口腔癌KB细胞后,使用CCK-8检测细胞存活率,判断水飞蓟宾对KB细胞增殖的影响。结果表明:与对照组相比,水飞蓟宾能显着抑制KB细胞的增殖(P<0.05),且随着药物浓度的升高,抑制作用逐渐增强,表现出剂量依赖性。同时随着药物作用时间的增加(24,48,72 h),抑制作用也更加明显,半数抑制浓度IC50分别为:55.36 μmol/L,22.18 μmol/L和9.64 μmol/L(图1)。
2.2 、水飞蓟宾对人口腔癌KB细胞克隆形成和侵袭的影响
根据CCK-8的结果,选取低于半数抑制浓度的5,10,20 μmol/L的水飞蓟宾作用于KB细胞,通过平板克隆形成实验和Transwell实验分别检测水飞蓟宾对KB细胞增殖和侵袭转移能力的影响。结果显示:培养10天后,随着水飞蓟宾浓度的升高,克隆形成的数量明显减少(P<0.05),表明了水飞蓟宾对KB细胞增殖的抑制作用;同时水飞蓟宾预处理24 h的细胞,在小室中培养12 h后,穿过基质胶的KB细胞数量也明显减少(P<0.05),表明KB细胞的侵袭转移能力同样受到水飞蓟宾的抑制(图2)。
图1 水飞蓟宾对人口腔上皮癌KB细胞增殖的影响
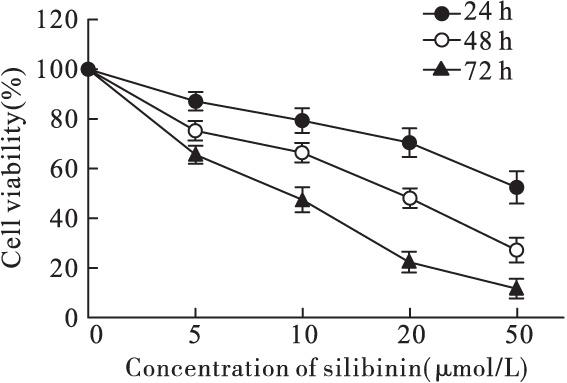
Fig.1 Cell viability of KB cells treatment with silibinin
图2 水飞蓟宾对KB细胞的集落形成和侵袭的影响(结晶紫×100)
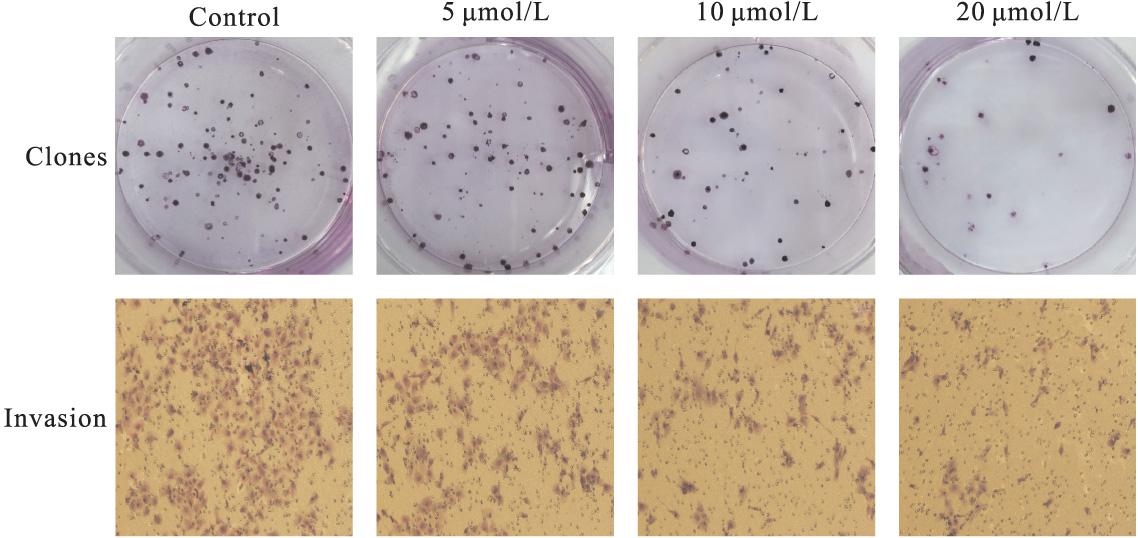
Fig.2 Inhibition of KB cells colony formation and invasion by treating with silibinin(violet crystal×100)
2.3 、水飞蓟宾对p-JNK、VEGF和MMP-9表达的影响
使用不同浓度的水飞蓟宾(5,10,20 μmol/L)作用于KB细胞,Western blot检测p-JNK、VEGF和MMP-9的表达。从图3中可以看出不同浓度的水飞蓟宾组中,JNK的磷酸化水平以及VEGF和MMP-9的表达水平较空白对照组显着降低(P<0.05)。
图3 水飞蓟宾对p-JNK、VEGF和MMP-9蛋白表达的影响
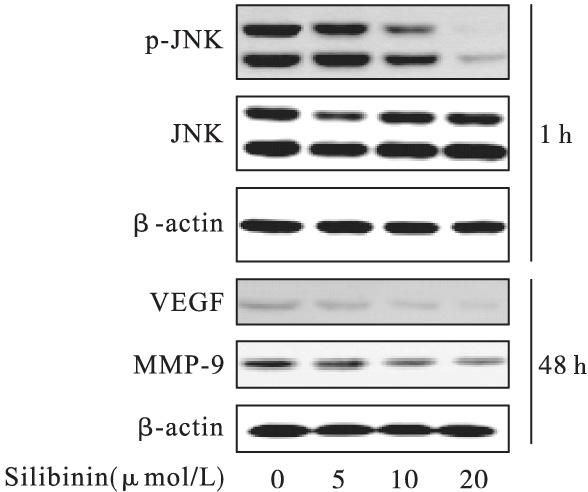
Fig.3 Expression of p-JNK,VEGF and MMP-9 in KB cells treated with 0,5,10,20 μmol/L silibinin
2.4 、JNK抑制剂sp600125对p-JNK、VEGF和MMP-9表达的影响
用10 μmol/L 的JNK抑制剂sp600125作用于KB细胞, Western blot检测VEGF和MMP-9的表达。结果表明:sp600125显着降低VEGF和MMP-9的 表达水平(P<0.05)(图4A)。
2.5、 JNK抑制剂sp600125对人口腔癌KB细胞克隆形成和侵袭的影响
用10 μmol/L 的JNK抑制剂sp600125处理KB细胞,平板克隆形成实验的结果显示:sp600125作用于细胞10天后,显着抑制KB细胞克隆数量的形成(P<0.05), Transwell实验的结果表明:sp600125预处理细 胞24 h,在小室中培养12 h后,侵袭穿过基质胶的KB细胞数量,较对照组明显减少(P<0.05)(图4B)。
3 、讨论
天然化合物一直在世界医疗保健和传统医学系统中发挥着巨大的作用。水飞蓟宾作为长期应用的保肝药被发现在抗肿瘤活性方面有良好的开发前景。研究表明水飞蓟宾可在癌变过程的不同阶段发挥作用:抑制增殖、调节细胞周期、诱导细胞凋亡、抑制新生血管生成、抑制迁移等[11]。因此,作为一种潜在的抗癌药物,水飞蓟宾的作用机制值得深入研究。本研究以人口腔上皮样癌细胞KB细胞株为研究对象,探讨水飞蓟宾对其增殖及侵袭的影响并分析其潜在的抗肿瘤作用机制。
图4 JNK抑制剂sp600125对KB细胞中VEGF和MMP-9蛋白的表达(A)以及KB细胞的集落形成和侵袭(B)的影响(结晶紫×100)
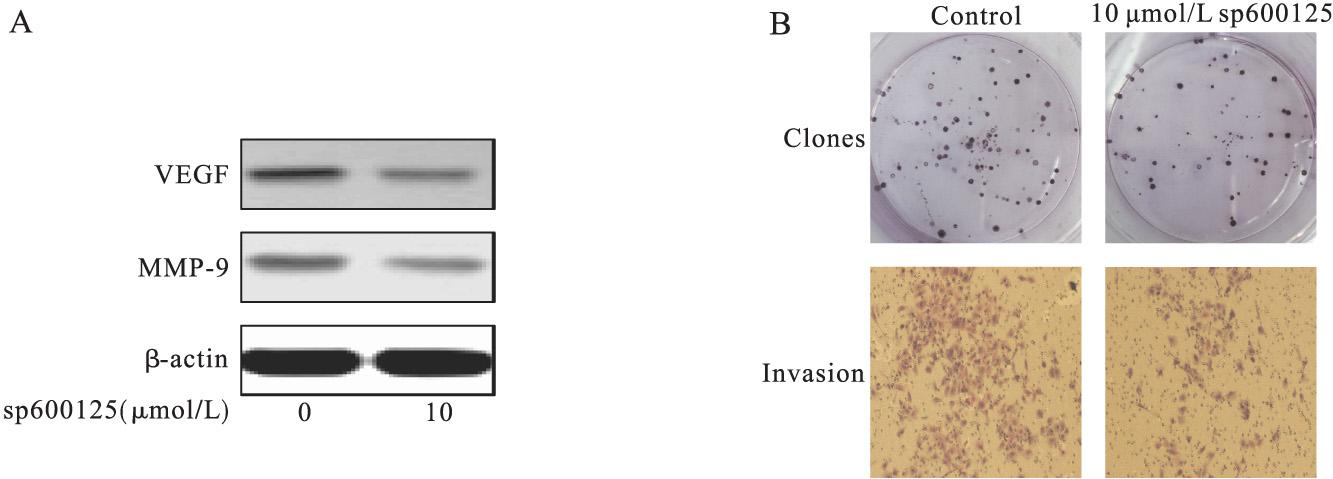
Fig.4 Inhibition of VEGF and MMP-9 expression in KB cells(A) and the KB cells colony formation and invasion by treating with 10 μmol/L sp600125(B)(violet crystal×100)
异常增殖是肿瘤细胞的基本特征,能否抑制肿瘤细胞增殖是抗肿瘤药物的前提条件[15]。本试验通过CCK-8和平板克隆试验研究水飞蓟宾对KB细胞增殖的抑制作用。CCK-8试验结果显示,水飞蓟宾能显着抑制KB细胞的增长,且随着水飞蓟宾浓度的增加和作用时间的延长,抑制作用逐渐增强,呈时间和剂量依赖性。平板克隆试验结果显示,随着水飞蓟宾浓度的升高,克隆形成的数量明显减少。两者共同表明了水飞蓟宾对KB细胞增殖具有抑制作用。侵袭与转移是肿瘤恶化的标志,本研究通过Transwell侵袭实验研究证实了水飞蓟宾对KB细胞侵袭的抑制作用。VEGF是一种重要的促血管生成因子,作用于血管内皮细胞,肿瘤组织新生血管的生成是肿瘤细胞增殖并发生侵袭与转移的关键因素[16]。此外,破坏和降解细胞外基质,是肿瘤细胞侵袭与转移过程中的关键步骤[17]。基质金属蛋白酶类MMPs是一种肿瘤细胞表面释放的蛋白水解酶,能够降解细胞外基质,破坏基底膜,从而使肿瘤细胞侵入血管并向周围组织浸润扩散[18]。本研究通过Western blot实验证实水飞蓟宾显着抑制VEGF和MMP-9的表达,并且显着抑制丝裂原活化蛋白激酶JNK的磷酸化水平,克隆形成及Transwell实验表明水飞蓟宾抑制了细胞的增殖与转移。因此推测水飞蓟宾是通过对JNK通路的抑制,从而对VEGF和MMP-9的蛋白表达产生影响,最终抑制KB细胞的增殖和转移。随后使用JNK抑制剂sp600125进行佐证,结果表明sp600125抑制JNK的活化后,VEGF和MMP-9蛋白的表达水平明显下调, KB细胞集落的形成以及Transwell侵袭的细胞数量显着降低。使用sp600125的结果提示,在KB细胞中,JNK通路在VEGF和MMP-9的表达中发挥重要作用,最终影响了KB细胞的增殖与转移。
综上所述,水飞蓟宾可能通过抑制JNK的活化,从而抑制VEGF和MMP-9的蛋白表达,最终抑制人口腔上皮癌细胞KB细胞株的增殖和转移。
参考文献
[1]St John MA.Inflammatory mediators drive metastasis and drug resistance in head and neck squamous cell carcinoma[J].The Laryngoscope,2015(125):S1-S11.
[2]Kim JS,Oh D,Yim MJ,et al.Berberine induces FasL-related apoptosis through p38 activation in KB human oral cancer cells[J].Oncology Reports,2015,33(4):1775-1782.
[3]HUANG ZH,CHEN K,ZHANG TZ.Research progress of the effects of different treatments on survival quality of patients with oral cancer [J].Hainan Medical Journal,2018,29(6):834-837.[黄泽浩,陈坤,张铁柱.不同治疗方式对口腔癌患者生存质量影响的研究进展[J].海南医学,2018,29(6):834-837.]
[4]Eid A,Li S,Garza R,et al.Chemotherapy for oral and maxillofacial tumors:An update[J].Oral and Maxillofacial Surgery Clinics,2014,26(2):163-169.
[5]Polachi N,Bai G,Li T,et al.Modulatory effects of silibinin in various cell signaling pathways against liver disorders and cancer-A comprehensive review[J].European Journal of Medicinal Chemistry,2016(123):577-595.
[6]Zhang Y,Ge Y,Chen Y,et al.Cellular and molecular mechanisms of silibinin induces cell-cycle arrest and apoptosis on HeLa cells[J].Cell Biochemistry and Function,2012,30(3):243-248.
[7]Wu K,Ning Z,Zeng J,et al.Silibinin inhibits β-catenin/ZEB1 signaling and suppresses bladder cancer metastasis via dual-blocking epithelial-mesenchymal transition and stemness[J].Cellular Signalling,2013,25(12):2625-2633.
[8]Akhtar R,Ali M,Mahmood S,et al.Anti-proliferative action of silibinin on human colon adenomatous cancer HT-29 cells[J].Nutricion Hospitalaria,2014,29(2):388-392.
[9]Mateen S,Raina K,Agarwal R.Chemopreventive and anti-cancer efficacy of silibinin against growth and progression of lung cancer[J].Nutrition and Cancer,2013,65(sup1):3-11.
[10]Momeny M,Ghasemi R,Valenti G,et al.Effects of silibinin on growth and invasive properties of human ovarian carcinoma cells through suppression of heregulin/HER3 pathway[J].Tumor Biology,2016,37(3):3913-3923.
[11]ZHANG YX,YU M,RONG JM,et al.The pleiotropic mechanisms of silibinin against cancers[J].Guangdong Chemical Industry,2017,44(22):94-96.[张元新,于明,荣家闵,等.水飞蓟宾抗肿瘤作用机制研究进展[J].广东化工,2017,44(22):94-96.]
[12]LI YP,LI SQ,CHENG XB,et al.Inhibition effects of silibinin on human tongue cancer cell line Tca[J].Journal of Practical Stomatology,2009,25(2):281-284.[李云鹏,李绍青,程晓兵,等.水飞蓟宾对人舌癌细胞 Tca 的抑制作用[J].实用口腔医学杂志,2009,25(2):281-284.]
[13]Chen PN,Hsieh YS,Chiang CL,et al.Silibinin inhibits invasion of oral cancer cells by suppressing the MAPK pathway[J].Journal of Dental Research,2006,85(3):220-225.
[14]Gohulkumar M,Gurushankar K,Prasad NR,et al.Enhanced cytotoxicity and apoptosis-induced anticancer effect of silibinin-loaded nanoparticles in oral carcinoma (KB) cells[J].Materials Science and Engineering:C,2014(41):274-282.
[15]Jadvar H.Imaging cellular proliferation in prostate cancer with positron emission tomography [J].Asia Oceania Journal of Nuclear Medicine and Biology,2015,3(2):72.
[16]Chekhonin VP,Shein SA,Korchagina AA,et al.VEGF in tumor progression and targeted therapy[J].Current Cancer Drug Targets,2013,13(4):423-443.
[17]Sartakhti JS,Manshaei MH,Sadeghi M.MMP-TIMP interactions in cancer invasion:An evolutionary game-theoretical framework[J].Journal of Theoretical Biology,2017(412):17-26.
[18]Deryugina EI,Quigley JP.Tumor angiogenesis:MMP-mediated induction of intravasation-and metastasis-sustaining neovasculature[J].Matrix Biology,2015(44):94-112.





