摘 要: 目的:探讨沙利霉素(salinomycin)对口腔鳞癌细胞增殖和凋亡的影响,并初步探讨沙利霉素对信号通路的影响。方法:培养口腔鳞状细胞癌细胞系CAL-27,将1、2、4、8、16和32 μmol/L沙利霉素和1.25、2.5、5、10、20、40和80 μmol/L顺铂与CAL-27细胞共同培养,24h和48h后用细胞计数试剂盒-8(cell counting kit-8,CCK-8)法检测沙利霉素和顺铂对CAL-27细胞增殖的影响;0、2、4、8 μmol/L沙利霉素和0、5、10、20μmol/L顺铂与CAL-27细胞共培养48h后,通过流式细胞术检测沙利霉素和顺铂对CAL-27细胞周期的影响,蛋白免疫印迹法(Western blot)检测CAL-27细胞中天冬氨酸特异性半胱氨酸蛋白酶-3(cysteine-containing aspartate-specific proteases-3,Caspase-3),天冬氨酸特异性半胱氨酸蛋白酶-9(cysteine-containing aspartate-specific proteases-9,Caspase-9),脱氧核糖核酸(deoxyribonucleic acid,DNA)修复酶(poly ADP-ribose polymerase,PARP),蛋白激酶B(protein kinase B, Akt)和磷酸化蛋白激酶B (phosphorylated Protein Kinase B,p-Akt)的表达。结果:通过CCK-8试验表明沙利霉素和顺铂均能显着抑制口腔鳞状细胞癌CAL-27细胞增殖且抑制作用呈时间依赖性和药物浓度依赖性,但是相对于临床一线化疗药物顺铂而言,沙利霉素对CAL-27细胞增殖的抑制效果更加显着(P<0.001)。细胞周期检测表明与加入二甲基亚砜(dimethyl sulfoxide,DMSO)的对照组相比,8μmol/L沙利霉素与CAL-27细胞共同培养48h后,细胞休眠期/DNA合成前期的CAL-27细胞比例明显升高(40.40%±1.99% vs.64.46%±0.90%,P<0.05),DNA合成期和DNA合成后期/有丝分裂期的CAL-27细胞比例出现降低(24.32%±2.30% vs.18.73%±0.61%,P<0.05,35.01%±1.24% vs.16.54%±1.31%,P<0.05);顺铂对CAL-27细胞周期没有特异性改变。蛋白免疫印迹法结果显示沙利霉素在上调CAL-27细胞中Caspase-3和 Caspase-9蛋白表达(P<0.05)的同时下调PARP、Akt和p-Akt蛋白的表达(P<0.05)。结论:相对于顺铂而言,沙利霉素对CAL-27细胞增殖有更强的抑制作用,并且能将口腔鳞状细胞癌CAL-27细胞周期阻滞在细胞休眠期/DNA合成前期,同时能够诱导CAL-27细胞发生凋亡,这一机制可能和Akt/p-Akt信号通路相关。
关键词: 沙利霉素; 口腔鳞状细胞癌; 细胞周期; 凋亡;
Abstract: Objective: This study was aimed to investigate the effects of salinomycin on the proliferation and apoptosis of oral squamous carcinoma cells and to further understand the mechanisms of these effects. Methods: The human oral squamous carcinoma cell line CAL-27 was cultured in different concentrations of salinomycin and cisplatin. After co-culture with 0, 1, 2, 4, 8, 16 and 32 μmol/L salinomycin or 0, 1.25, 2.5, 5, 10, 20, 40 and 80 μmol/L cisplatin for 24 hours and 48 hours, the proliferation of oral squamous carcinoma cells were detected by cell counting kit-8(CCK-8) assay. After exposed to 0, 2, 4, 8μmol/L salinomycin and 0, 5, 10, 20 μmol/L cisplatin for 48 hours, the cell cycle of oral squamous carcinoma cells was detected by flow cytometry assay, and Western Blot analysis was performed to analyze the expression of cysteine-containing aspartate-specific proteases-3(Caspase-3), cysteine-containing aspartate-specific proteases-9(Caspase-9), poly ADP-ribose polymerase (PARP), protein kinase B (Akt) and phosphorylated Protein Kinase B (p-Akt) protein in oral squamous carcinoma cells. Results: Both salinomycin and cisplatin significantly inhibited the proliferation of oral squamous cell carcinoma CAL-27 cells in a time- and dose-dependent manner. However, compared with the first-line chemotherapeutic drug cisplatin, salinomycin showed stronger anti-proliferation activity in oral squamous carcinoma cells than cisplatin (P<0.001). After exposed to 8μmol/L salinomycin, CAL-27 cells exhibited markedly higher proportion in quiescent/ first gap phases (40.40%±1.99% vs. 64.46%±0.90%, P<0.05), and had a significantly lower proportion in synthesis phases and second gap / mitosis phases (24.32%±2.30% vs. 18.73%±0.61%, P<0.05; 35.01%±1.24% vs. 16.54%±1.31%, P<0.05) compared with the dimethyl sulfoxide control group; moreover cisplatin didn't show cell-cycle specific effect on CAL-27. Western blotting proved that salinomycin could up-regulate the expression of Caspase-3 and Caspase-9 protein in oral squamous cell carcinoma CAL-27 cells (P<0.05). At the same time, the level of PARP, Akt and p-Akt protein were down-regulated (P<0.05). Conclusion: Compared with cisplatin, salinomycin has a better inhibitory effect on the proliferation of oral squamous carcinoma cells and blocks the cell cycle process at the quiescent / first gap phase. At the same time, salinomycin could trigger apoptosis of oral squamous carcinoma cells and the mechanism is associated with the Akt/p-Akt signaling pathway.
Keyword: Salinomycin; Oral squamous cell carcinoma; Cell cycle arrest; Apoptosis;
口腔癌是人类常见恶性肿瘤之一,每年有超过30万口腔癌新发病例,占全球新发肿瘤病例数的2.1%,口腔癌中超过90%是口腔鳞状细胞癌,占全球恶性肿瘤的1%~2%[1]。目前,中国的口腔鳞状细胞癌发病率占恶性肿瘤总发病率的1.5%~5.6%[2]。虽然手术治疗结合术后放射治疗、化学治疗作为目前口腔鳞状细胞癌治疗的主要途径取得了较好的疗效,但是由于术后局部复发和远处转移,5年生存率仅为55%[3]。口腔鳞状细胞癌已经出现了耐药的现象,顺铂等一线化疗药物并不能全面遏制口腔鳞状细胞癌的发展[4],因此寻找更高效的药物对抗口腔鳞状细胞癌的任务显得十分迫切。沙利霉素是1974年从白色链霉菌发酵液中分离出的一种羧基聚醚类钾离子载体抗生素,被广泛应用于防治家禽的球虫病,并在2009年首次发现沙利霉素可以选择性的杀死乳腺癌肿瘤干细胞,其效果比临床常用乳腺癌化疗药物紫杉醇高出100倍以上[5]。此后的研究表明沙利霉素能够有效抑制卵巢癌[6]、鼻咽癌[7]、乳腺癌[8]和肺癌[9]等多种肿瘤细胞的增殖并促进其凋亡,但沙利霉素对于口腔鳞状细胞癌的作用尚不清楚。本研究旨在观察沙利霉素对口腔鳞状细胞癌的细胞增殖、细胞周期和凋亡的影响,并在分子水平初步探讨沙利霉素作用的机制。

1、 资料与方法
1.1、材料与试剂
沙利霉素[溶于二甲基亚砜(dimethyl sulfoxide,DMSO)后,配置成所需浓度的溶液]、顺铂和DMSO购于美国Sigma公司;胎牛血清(fetal bovine serum,FBS)和磷酸缓冲盐溶液(phosphate buffer saline,PBS)购自美国Gibco公司; RPMI-1640培养基购于美国Hyclone公司;细胞计数试剂盒-8(cell counting kit-8,CCK-8)、放射免疫沉淀分析(radio immunoprecipitation assay,RIPA)裂解液、蛋白浓度测定试剂盒(bicinchoninic acid,BCA)购自上海碧云天生物技术公司;细胞周期检测试剂盒购于上海七海生物公司;兔抗人多克隆抗体天冬氨酸特异性半胱氨酸蛋白酶-3(cysteine-containing aspartate-specific proteases-3,Caspase-3)、天冬氨酸特异性半胱氨酸蛋白酶-9(cysteine-containing aspartate-specific proteases-9,Caspase-9)、脱氧核糖核酸(deoxyribonucleic acid,DNA)修复酶(poly ADP-ribose polymerase, PARP)、蛋白激酶B(protein kinase B,Akt)和磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)购自英国Abcam公司;二抗抗体购自北京索莱宝科技公司;人口腔鳞癌细胞系CAL-27购自美国模式培养物集存库。
1.2、细胞培养
人口腔鳞状细胞癌CAL-27细胞复苏后,使用含10%(体积分数)胎牛血清的RMPI-1640培养基在37℃、5% CO2 (体积分数)的细胞培养箱中培养,每2天更换1次培养基。当细胞达到80%融合度时,用0.25%胰蛋白酶消化细胞进行传代培养。
1.3、CCK-8检测细胞增殖
取对数生长期CAL-27细胞,PBS洗涤后用0.25%胰蛋白酶消化细胞,调节细胞浓度。以每孔5.0×103个细胞接种于96孔培养板中,每孔加入100 μL培养液。24 h后PBS洗涤,沙利霉素实验组中分别加入1、2、4、8、16和32 μmol/L的沙利霉素;顺铂实验组中分别加入1.25、2.5、5、10、20、40和80 μmol/L的顺铂,另外设置无药物处理组为阴性对照,孔内不含药物和细胞的培养基为空白调零组,实验组、对照组、空白调零组均设置6个复孔。加药培养24 h和48 h后,吸弃培养基后每孔加10 μL的CCK-8液继续培养;4 h后选择450 nm波长,用酶标仪(Thermo公司,美国)测定各孔光密度值,根据光密度值评估沙利霉素和顺铂处理后的细胞存活率。
1.4、流式细胞术检测细胞周期
取对数生长期的CAL-27细胞消化、计数,1×106/孔接种于六孔板中培养24 h后,沙利霉素实验组分别加入2、4和8 μmol/L的沙利霉素,顺铂实验组分别加入5、10和20 μmol/L的顺铂,对照组加入与实验组等量的培养基,培养48 h后,胰酶消化后收集细胞,1000 r/min离心5 min,弃上清液,加PBS洗涤细胞 2 次, 并用预冷的70%乙醇固定,4℃冰箱内过夜。分析前用PBS洗涤样本2次, 终浓度为50 mg/L的RNA酶及碘化丙啶,4℃避光孵育30 min后上机检测细胞周期的分布。
1.5、蛋白免疫印迹
将浓度为2、4和8 μmol/L的沙利霉素和DMSO与CAL-27细胞共同培养48h后,弃培养液,加入RIPA裂解液后在冰上收集细胞,在4℃下离心(12 000 r/min,10 min)。利用BCA法测定蛋白浓度,将蛋白质(50 μg)进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),并用湿转法将蛋白转移到聚偏氟乙烯[poly(vinylidene fluoride),PVDF]膜上。5%脱脂奶粉室温封闭2h后,将一抗Akt、p-Akt、Caspase-3、 Caspase-9和PARP(1:1 000稀释)4℃下孵育过夜。TBTS缓冲液(tris buffered saline,with tween-20)漂洗三次后加入二抗(1:3 000稀释)室温下孵育1h,加入增强荧光发光试剂显影,使用图像成像系统分析各条带。
1.6、统计学分析
数据采用SPSS 17.0统计软件进行分析,实验数据均以均数±标准差表示。组间生长抑制率的差异性比较采用单因素方差分析,细胞周期变化以及蛋白表达差异则通过Levene方差齐性检验组间的方差齐性,方差齐采用单因素方差分析(One-way ANOVA),组间两两比较采用 LSD-t法检验,P<0.05被认为差异具有统计学意义。
2、结果
2.1、沙利霉素显着抑制口腔鳞状细胞癌CAL-27细胞增殖
通过CCK-8细胞增殖实验检测沙利霉素及顺铂对CAL-27细胞增殖的影响,发现顺铂和沙利霉素均对CAL-27细胞的增殖有明显的抑制作用(图1A、B),且抑制作用呈现药物浓度和时间依赖的方式。沙利霉素处理24 h和48 h后,CAL-27的半抑制浓度(half maximal inhibitory concentration,IC50)值分别为(7.98±0.42)μmol/L和(2.98±0.29)μmol/L,明显低于顺铂处理组24 h和48 h的IC50值[(15.75±1.14)μmol/L,(6.57±0.32)μmol/L],这些结果表明,沙利霉素对CAL-27细胞的增殖抑制作用较顺铂更强(P<0.001)。
图1 沙利霉素(A)和顺铂(B)对CAL-27细胞增殖的影响 下载原图
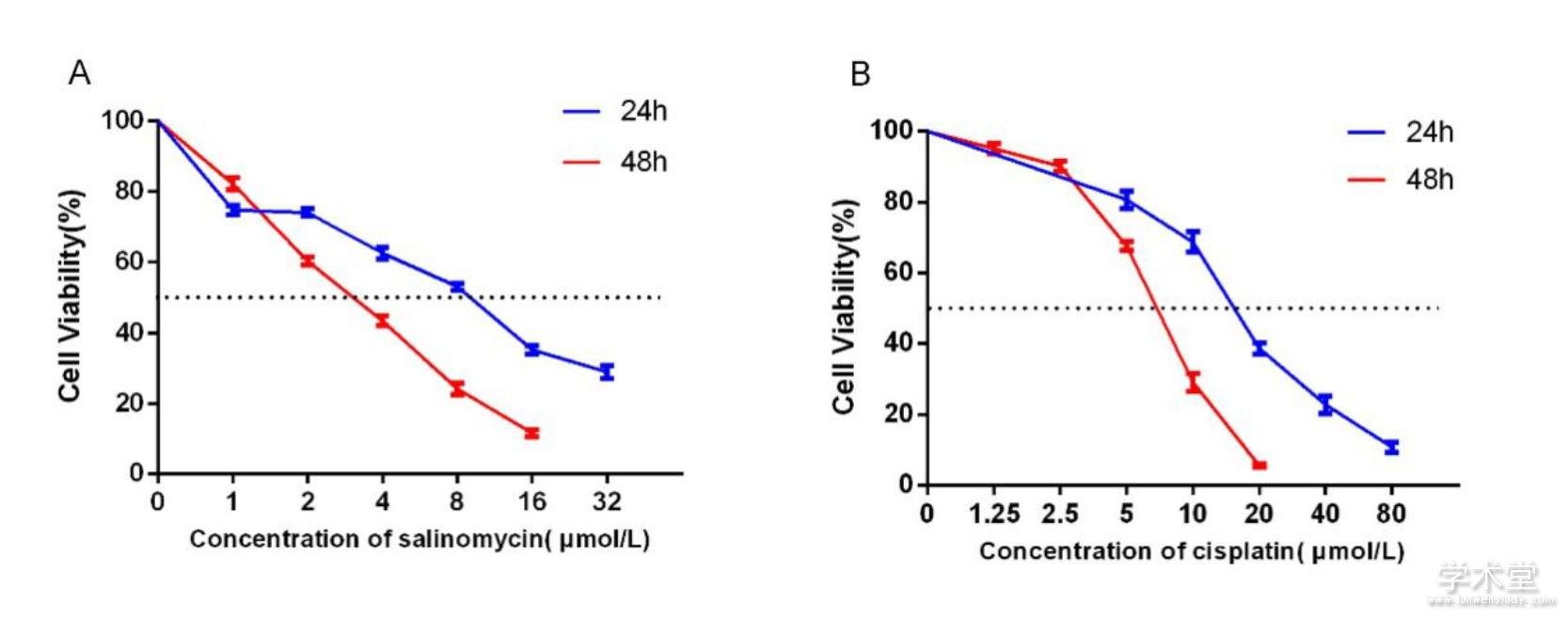
Figure 1 The anti-proliferation effects of salinomycin (A) and cisplatin (B) on CAL-27 cell lines
2.2、沙利霉素对CAL-27细胞周期的影响
对沙利霉素处理48 h的CAL-27细胞进行碘化丙啶染色,随后通过流式细胞仪检测细胞周期变化。如图2 A所示,与对照组相比,沙利霉素处理组CAL-27细胞在DNA合成期和DNA合成后期/有丝分裂期比例明显减少,但在细胞休眠期/DNA合成前期比例显着增加(40.40%±1.99%,52.72%±1.61%, 63.15%±1.63%和64.46%±0.90%,P<0.05),这说明CAL-27细胞以剂量依赖性方式诱导细胞休眠期/DNA合成前期细胞周期阻滞,但是4 μmol/L和8μmol/L沙利霉素处理后,CAL-27细胞周期没有显着改变(P> 0.2)。如图2B所示,与对照组DNA合成期(38.85%±0.99%)相比,顺铂处理组在DNA合成期比例明显增加(58.64%±2.59%,93.67%±1.03%,46.34%±3.22%),但是没有药物浓度依赖性。实验结果整体表明顺铂对CAL-27各个细胞周期均有影响,不存在细胞周期特异性,并且无药物浓度依赖性。
图2 沙利霉素和顺铂对CAL-27细胞周期的影响
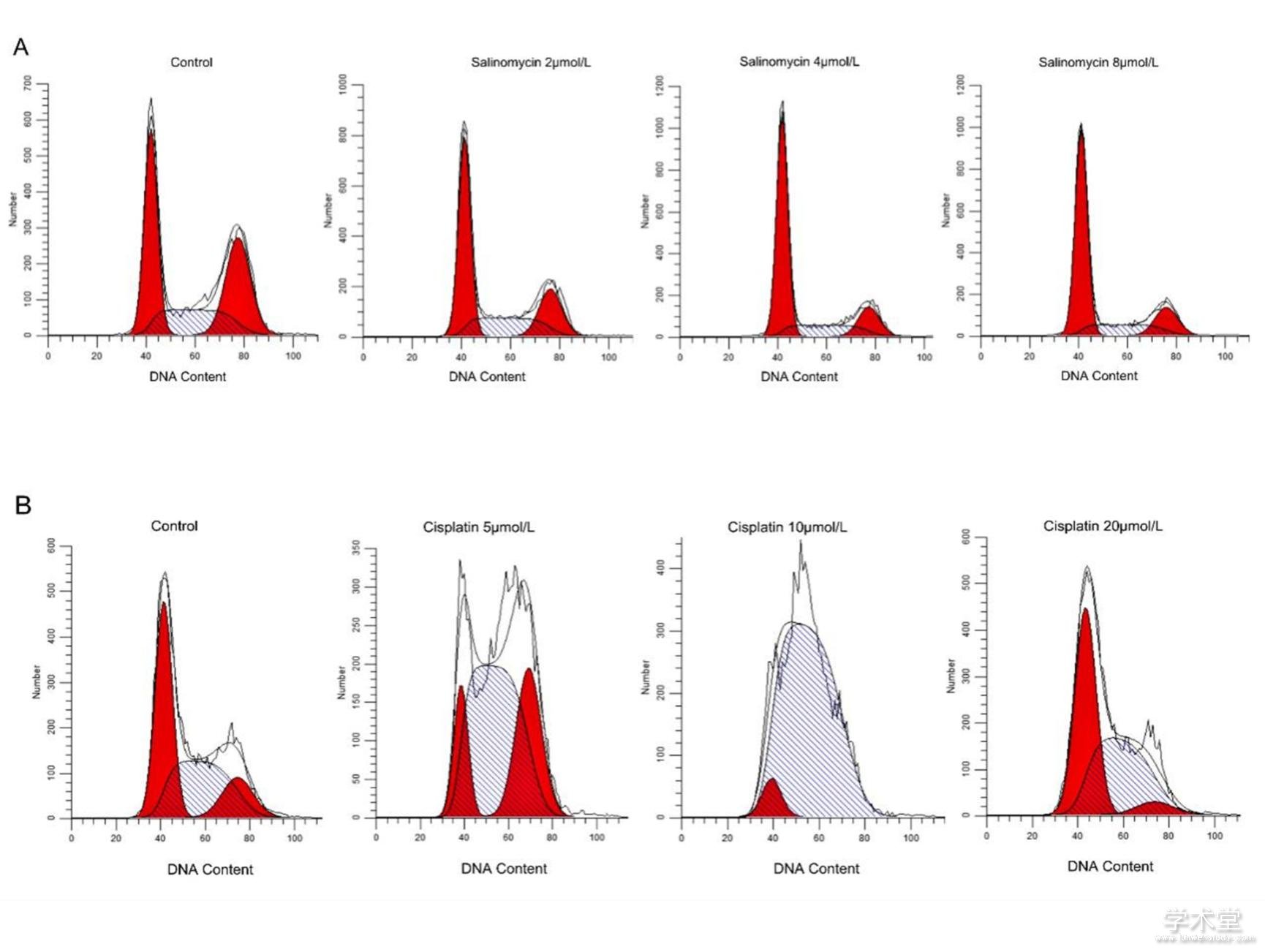
2.3、沙利霉素诱导口腔鳞状细胞癌CAL-27细胞凋亡
对沙利霉素处理48h后的CAL-27细胞进行Western blot检测,图3中结果显示沙利霉素在上调口腔鳞状细胞癌CAL-27细胞中Caspase-3和 Caspase-9蛋白表达(P<0.05)的同时能够下调PARP蛋白的表达(P<0.05),这一结果表明沙利霉素诱导CAL-27细胞凋亡,同时沙利霉素也可诱导DNA修复酶(PARP)裂解。为了解沙利霉素在CAL-27细胞凋亡中的分子基础,通过Western blot检测了Akt和p-Akt蛋白,结果显示4μmol/L和8μmol/L沙利霉素处理后Akt和p-Akt蛋白的表达均降低,p-Akt蛋白更为显着(P<0.05)。
图3 沙利霉素对CAL-27细胞凋亡以及凋亡信号通路的影响
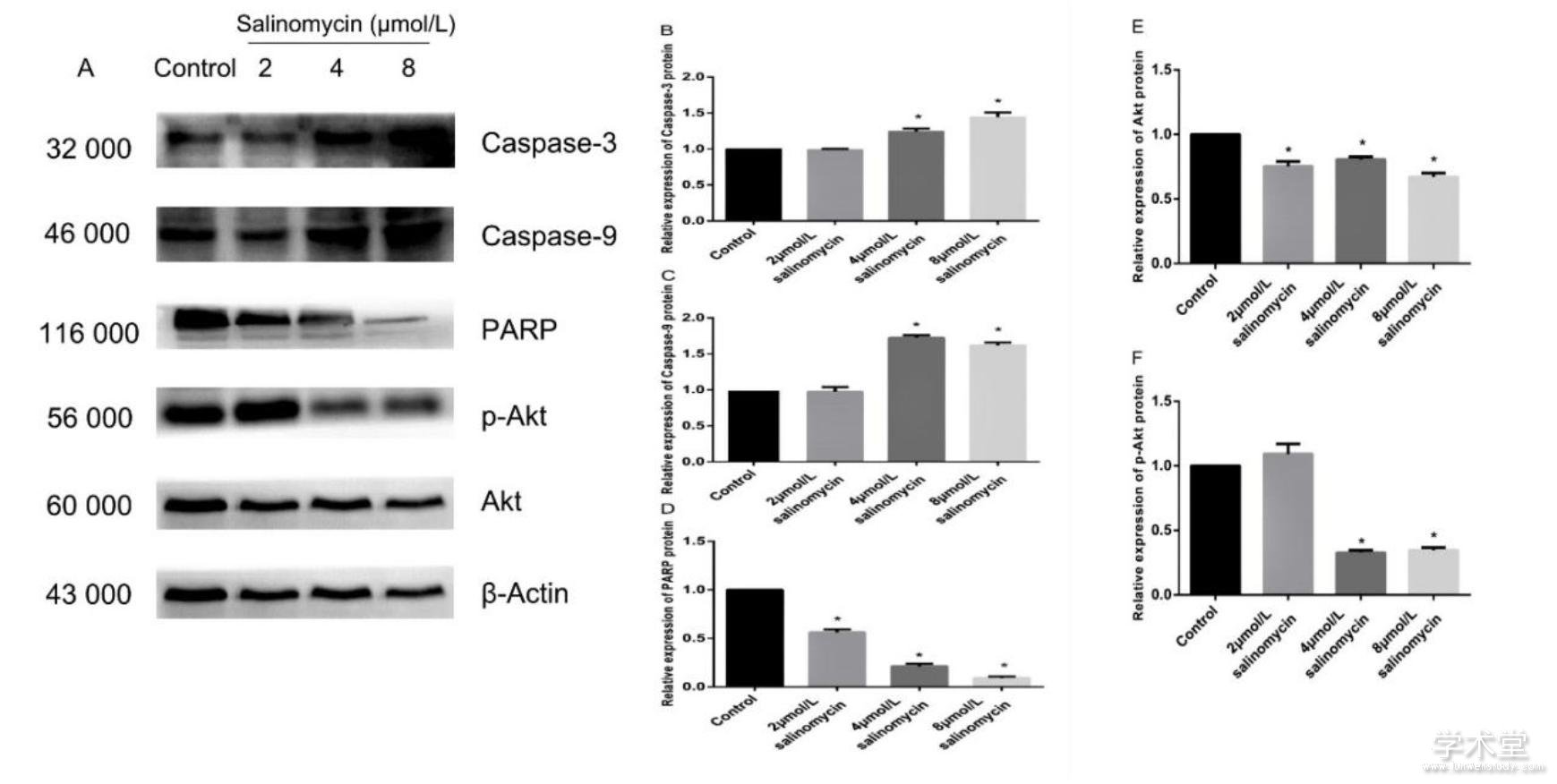
3、讨论
本研究显示沙利霉素能够有效抑制口腔鳞状细胞癌CAL-27细胞的增殖,且抑制作用呈现时间与药物浓度依赖性。与口腔癌临床一线化疗药物顺铂相比,沙利霉素对于口腔鳞状细胞癌CAL-27细胞的增殖抑制作用更加明显(P<0.001)。为了进一步研究沙利霉素对于口腔鳞状细胞癌CAL-27细胞的增殖抑制作用,本次研究对沙利霉素作用后的CAL-27细胞周期进行了检测,结果显示与对照组相比,沙利霉素处理组CAL-27细胞在DNA合成期和DNA合成后期/有丝分裂期比例明显减少,但在细胞休眠期/DNA合成前期比例显着增加,这说明沙利霉素能将CAL-27细胞阻滞在细胞休眠期/DNA合成前期,这与Parajuli等[10]关于沙利霉素对卵巢癌的细胞周期阻滞结果相符。但我们的研究显示4 μmol/L和8 μmol/L沙利霉素处理后CAL-27细胞周期变化差异没有统计学意义,这表明4 μmol/L沙利霉素能够将CAL-27细胞阻滞在细胞休眠期/DNA合成前期,并且沙利霉素还有其他途径能够抑制CAL-27细胞增殖。同时本次研究对顺铂作用后的CAL-27细胞周期进行了检测,实验结果显示顺铂对CAL-27各个细胞周期均有影响,不存在细胞周期特异性,并且无药物浓度依赖性。通过回顾文献,发现我们的结果与亓放等[11]在1999年提出顺铂为细胞周期非特异性化疗药物这一观点相符,并且与徐志巧等[12]于2013年主编的《实用肿瘤临床药物手册》内描述顺铂为细胞周期非特异性药物的结论一致。凋亡是是抑制肿瘤生长的一个重要方式,钾离子在细胞凋亡的过程中扮演着十分重要的角色,而沙利霉素作为一种离子载体能够有效降低细胞间的钾离子水平[13]。回顾既往文献发现,Nuutinen等[14]在2006年提出多种肿瘤内出现Akt通路的激活并在抑制凋亡中起到重要作用,另外Jeong等[15]于2008年在研究中提出活化的天冬氨酸特异性半胱氨酸蛋白酶-9和Caspase-9均在细胞凋亡中起作用,并且Caspase9在诱导凋亡中作用更加明显,所以本次实验通过Western blot检测凋亡蛋白Caspase-3和Caspase-9的同时,检测与其相关的重要蛋白如PARP, Akt 和p-Akt进一步佐证沙利霉素诱导CAL-27细胞凋亡。实验结果发现沙利霉素作用于CAL-27细胞后,Caspase-3和Caspase-9蛋白表达发生了上调,同时引起了DNA修复酶(PARP)的裂解,这提示沙利霉素能够诱导CAL-27细胞发生凋亡。另外本次实验发现沙利霉素能够降低Akt和p-Akt蛋白的表达,且4 μmol/L和8 μmol/L沙利霉素对降低p-Akt蛋白表达更加显着,因此推测沙利霉素诱导CAL-27细胞发生凋亡的机制可能与降低Akt和p-Akt蛋白表达水平相关。
通常,我们希望化疗药物在能有效杀伤肿瘤细胞的同时能够对正常细胞产生较小或者不产生副作用。有报道表明沙利霉素优先作用于肿瘤细胞而非正常细胞,Fuchs等[13]研究显示沙利霉素能诱导白血病CD4+T细胞凋亡,但对正常CD4+T淋巴细胞没有影响。Ketola[16]研究显示,较低剂量的沙利霉素如1 μmol/L和1.33 μmol/L对人前列腺癌细胞有着高效的抑制作用,但对正常前列腺细胞没有毒性作用。Kaplan等[17]的研究表明,1μmol/L沙利霉素对卵巢上皮细胞没有毒性作用,但是这个浓度却能抑制卵巢癌细胞的增殖,这些研究表明沙利霉素对肿瘤细胞具有高效的杀伤作用,但对正常细胞的毒性却很小。
综上所述,本实验证实沙利霉素能够有效抑制口腔鳞状细胞癌CAL-27细胞的增殖,并且能将CAL-27细胞阻滞于细胞休眠期/ DNA合成前期,同时沙利霉素能够通过下调Akt和p-Akt蛋白表达并激活Caspase-3和Caspase-9蛋白,促进DNA修复酶(PARP)的裂解来诱导CAL-27细胞的凋亡,这为今后口腔鳞状细胞癌的治疗提供了新的思路。
参考文献
[1] Ferlay J, Soerjomataram1 I, Dikshit R,et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5): E359–E386.
[2] 孟宪瑞,刘进忠.口腔癌的早期诊断[J].国际口腔医学杂志,2008,35(3):329 - 331.
[3] Abrah?o R,Anantharaman D,Gaborieau V,et al. The influence of smoking, age and stage at diagnosis on the survival after larynx,hypopharynx and oral cavity cancers in Europe: The ARCAGE study[J].Int J Cancer,2018,143(1):32–44.
[4] Cho H,Nishiike S, Yamamoto Y,et al. Docetaxel, cisplatin,and fluorouracil for patients with inoperable recurrent or metastatic head and neck squamous cell carcinoma[J]. Auris Nasus Larynx,2015,42(5):396–400.
[5] Gupta PB, Onder TT, Jiang G,et al. Identification of selective inhibitors of cancer stem cells by high-throughput screening[J]. Cell,2009,138(4):645-659.
[6] Zhang B, Wang X , Cai F,et al. Effects of salinomycin on human ovarian cancer cell line OV2008 are associated with modulating p38 MAPK[J]. Tumor Biol,2012,33(6):1855-1862
[7] Wu D, Zhang Y, Huang J, et al. Salinomycin inhibits proliferation and induces apoptosis of human nasopharyngeal carcinoma cell in vitro and suppresses tumor growth in vivo[J]. Biochem Bioph Res Co,2014,443(2):712-717.
[8] Dhaheri AI, Attoub S, Arafat K, et al. Salinomycin induces apoptosis and senescence in breast cancer: Up regulation of p21, down regulation of survivin and histone H3 and H4 hyperacetylation[J]. BBA-GEN Subjects, 2013,1830(4):3121-3135.
[9] Arafat K, Iratni R, Takahashi T, et al. Inhibitory Effects of Salinomycin on Cell Survival, Colony Growth, Migration, and Invasion of Human Non-Small Cell Lung Cancer A549 and LNM35: Involvement of NAG-1[J]. PLoS One, 2013,8(6):e66931.
[10] Parajuli B, Lee HG, Kwon SH, et al. Salinomycin inhibits Akt/NF-κB and induces apoptosis in cisplatin resistant ovarian cancer cells[J]. Cancer Epidemiology,2013,37(4):512-517.
[11]亓放,张宝泉,徐炎,等.顺铂诱导的喉癌细胞凋亡及其对细胞周期的影响[J]. 中华医学杂志. 1999,79(4):298-301.
[12] 徐志巧,庞国明,等. 实用肿瘤临床药物手册[M].北京: 中国医药科技出版社,2013:282.
[13] Fuchs D, Heinold A, Opelz G, et al. Salinomycin induces apoptosis and overcomes apoptosis resistance in human cancer cells[J]. Biochem Bioph Res Co, 2009,390(3):743-749.
[14] Nuutinen U, Postila V, Matto M , et al. Inhibition of PI3-kinase-Akt pathway enhances dexamethasolle-induced apoptosis in a human follicular lymphoma cell line[J]. Exp Cell Res,2006,312(3):322–330.
[15] Jeong SJ, Dasgupta A,Jung KJ, et al.. PI3K/AKT inhibition induces caspase-dependent apoptosis in HTLV-1 transformed cells[J].Virology, 2008, 370(2): 264–272.
[16] Ketola K, Hilvo M,Hy?tyl?inen T, et al. Salinomycin inhibits prostate cancer growth and migration via induction of oxidative stress[J]. Brit J Cancer,2012 , 106(1):99-106.
[17] Kaplan F,Teksen F. Apoptotic effects of salinomycin on human ovarian cancer cell line (OVCAR-3)[J].Tumor Biol,2016,37(3):3897-3903.





