口腔医学毕业论文第三篇:口腔医学中特立帕肽的应用综述
摘要:背景:重组人甲状旁腺激素(1-34)(recombinant human parathyroid hormone 1-34,rhPTH 1-34),即特立帕肽,为甲状旁腺激素氨基端片段,作为骨合成代谢药,因可以直接刺激新骨形成、增加骨量而成为研究热点,也因其强大的成骨效应引起口腔领域的关注与应用。目的:对特立帕肽的成骨机制、有效性和安全性及其在口腔领域的研究进展进行综述。方法:第一作者检索近20年PubMed数据库、万方数据库收录的相关文章。英文检索词为“rhPTH(1-34),teriparatide,osteoporosis,stomatology,Jaw,implant-osseointegration,periodontal”,中文检索词为“重组人甲状旁腺激素(1-34),特立帕肽,骨质疏松,口腔医学,颌骨,种植体-骨结合,牙周”。共选取56篇文献进行综述。结果与结论:特立帕肽可以直接刺激新骨的成骨细胞形成,实现有效的合成代谢,其在口腔领域的研究表现出良好的促进种植体-骨结合、牙周再生、骨缺损愈合及提高正畸稳定性的效果,在口腔领域有良好的应用前景,但仍需要更多更高质量的动物实验及临床研究证实。未来甲状旁腺激素类药物及其类似物可与骨组织工程技术有机结合,更好地促进骨修复,同时也更好地服务于口腔颌面部的修复治疗。
关键词:重组人甲状旁腺激素(1-34); 特立帕肽; 骨质疏松; 口腔医学; 颌骨; 种植体-骨结合; 牙周;
Recombinant human parathyroid hormone(1-34): pro-osteogenic action and application in oral field
Dong Xiling Zhang Xiaoming Liu Tongbin
Department of Prosthodontics, Binzhou Medical University Hospital
Abstract:BACKGROUND: Recombinant human parathyroid hormone 1-34(rhPTH 1-34), also known as teriparatide, is the amino terminal fragment of parathyroid hormone. Teriparatide, as a bone anabolic drug, has become a research hotspot because it can directly stimulate new bone formation and increase bone mass. It also attracts attention and application in the oral field due to its strong osteogenesis effect. OBJECTIVE: To review the osteogenic mechanisms, efficacy and safety of teriparatide and its research progress in the oral field.METHODS: The first author searched the Pub Med and Wan Fang databases for relevant literature published over the past two decades. The keywords were “rh PTH(1-34); teriparatide; osteoporosis; stomatology; Jaw; implant-osseointegration; periodontal” in English and Chinese, respectively. Fifty-six eligible articles were finally reviewed. RESULTS AND CONCLUSION: Teriparatide can directly stimulate the formation of osteoblasts in new bone and achieve effective anabolic metabolism. Studies of teriparatide in the oral field have shown good results in promoting implant-osseointegration, periodontal regeneration, bone defect healing and the stability of orthodontics, but increasing high-quality animal experiments and clinical studies are still needed. Future use of parathyroid hormone drugs and their analogues can be combined with bone tissue engineering technology to provide favorable effects in bone repair as well as in oral and maxillofacial repair.
文章快速阅读:
文题释义:
特立帕肽(teriparatide):即重组人甲状旁腺激素(1-34)(rhPTH 1-34),2002年经美国食品药品监督管理局(FDA)批准应用于骨质疏松症的治疗,是第一代骨合成代谢药。它可以直接刺激新骨的成骨细胞形成,实现有效的合成代谢,在口腔领域的研究也表现出良好的促进种植体-骨结合及牙周再生等效果。
甲状旁腺激素:由甲状旁腺主细胞合成与分泌,是含84个氨基酸残基的单链多肽,位于人类甲状旁腺激素分子氨基端(N-端)的1-34位氨基酸序列是其生物活性部位。甲状旁腺激素是调节人体钙磷内环境稳态及骨代谢的重要激素,间歇低剂量给予甲状旁腺激素对骨骼发挥合成代谢作用。
0引言Introduction
口腔颌面部骨骼,尤其是上颌骨和下颌骨,作为全身骨骼系统的一部分,会受全身骨质疏松症的影响,发生颌骨骨质疏松、牙槽骨吸收等问题,从而与牙周病学、口腔修复学、口腔种植学等诸多学科息息相关[1]。骨质疏松症是一种系统性、全身性骨骼疾病,其以骨量减少、骨组织微观结构退行性改变为主要特征,导致骨强度下降、骨脆性及骨折风险增加[2]。临床上用于治疗骨质疏松症的药物根据其作用机制分为3类:(1)骨吸收抑制药;(2)骨合成代谢药;(3)骨矿化促进药。以甲状旁腺激素(parathyroid hormone,PTH)类药物为代表的骨合成代谢药,可以直接刺激新骨的成骨细胞形成,在骨量增加、骨骼结构和力量的改善以及骨折风险降低方面,都优于骨吸收抑制药和骨矿化促进药,这就使甲状旁腺激素类药物成为研究热点[3]。
重组人甲状旁腺激素(1-34)(rhPTH 1-34),即特立帕肽,属于甲状旁腺激素类药物,于2002年被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于骨质疏松症治疗,是第一个被FDA批准的骨合成代谢药,目前临床应用10余年,因其强大的成骨效应引起口腔领域的关注[4]。文章将对特立帕肽的成骨机制、有效性和安全性及其在口腔领域的研究进展进行综述。
1 资料和方法Data and methods
1.1 资料来源
第一作者检索PubMed数据库、万方数据库收录的有关文献。英文检索词为“rhPTH(1-34),teriparatide,osteoporosis,stomatology,Jaw,implant-osseointegration,periodontal”,中文检索词为“重组人甲状旁腺激素(1-34),特立帕肽,骨质疏松,口腔医学,颌骨,种植体-骨结合,牙周”。
1.2 纳入标准
(1)文献发表时间较为完整,纳入近20年的文献进行分析;(2)文献内容具有可靠性,内容主要体现特立帕肽的成骨作用及在口腔领域的相关研究;(3)文献来源应可靠,文献首先考虑SCI来源期刊或中文核心期刊;(4)对文献质量的要求:研究设计无缺陷、数据完整、统计方法合理、结论明确。
1.3 排除标准
重复性的研究、内容较为陈旧的文献或相关性较差的文章。
1.4 数据提取
共检索到文献150余篇,排除与相关性差及内容陈旧、重复的文献,纳入56篇符合标准的文献进行综述。
2 结果Results
2.1 特立帕肽及其成骨机制
重组人甲状旁腺激素(1-34)——特立帕肽,商品名Forteo?/Forsteo?,由美国礼来公司(Eli Lilly and Company)使用经重组DNA技术修饰的大肠杆菌菌株生产,目前主要应用于绝经后女性和中老年男性骨质疏松症的治疗以及骨折或骨折风险高的患者,于2011年引入中国[5]。
特立帕肽属于甲状旁腺激素类的骨合成代谢药物。甲状旁腺激素是调节人体钙磷内环境稳态及骨代谢的重要激素,是含84个氨基酸残基的单链多肽,位于人类甲状旁腺激素分子氨基端(N-端)的1-34位氨基酸序列是其生物活性部位[6]。甲状旁腺激素不同的给予方式,可产生刺激骨吸收和骨形成的不同作用,连续应用甲状旁腺激素对骨骼发挥分解代谢作用;而间歇低剂量给予甲状旁腺激素对骨骼具有合成代谢作用,它可使骨重塑率增加,增加骨组织的数量,包括增加骨小梁的厚度,改善骨小梁的连接[3,7]。
甲状旁腺激素受体为B型G蛋白偶联受体,有2种亚型,Ⅰ型甲状旁腺激素受体主要位于骨骼和肾脏(肾小管)中,Ⅱ型甲状旁腺激素受体主要位于脑和胰腺中[8]。甲状旁腺激素通过与成骨细胞膜上的Ⅰ型甲状旁腺激素受体结合,激活钙离子依赖的蛋白激酶C(protein kinase C,PKC)和环磷酸腺苷依赖的蛋白激酶A(protein kinase A,PKA)等信号通路,启动骨合成和分解的生物学效应[9]。目前,甲状旁腺激素对骨骼发挥合成代谢作用的可能机制有:(1)减少成骨细胞的凋亡和增殖,促进成骨细胞分化,从而使成骨细胞数量增加、骨形成增加[10,11]。此机制在小鼠研究中已经得到证明,在人类中尚未被证实,可能与人类成骨细胞凋亡的基础患病率低有关[12]。(2)激活静止状态骨表面的骨衬里细胞进入功能性成骨细胞,降低骨细胞中编码硬化素的mRNA水平,减少成骨细胞产生硬化素,增加Wnt向成骨细胞的信号传导,从而增强骨形成[13,14]。(3)刺激胰岛素样生长因子1和碱性成纤维细胞生长因子2的表达,从而促进前骨母细胞的增殖,发挥成骨作用[15]。
特立帕肽为N端甲状旁腺激素片段,保留了34个活性部位的氨基酸,保持了完整的甲状旁腺激素所具有的几乎全部的生物学功能[9]。甲状旁腺激素的N端可以与Ⅰ型甲状旁腺激素受体结合,它克服了利用天然甲状旁腺激素直接治疗时C端所带来的不利影响(促进骨细胞凋亡),因此在成骨方面有更明显的优势[16]。
2.2 特立帕肽的有效性和安全性
特立帕肽提高骨矿物质密度和促进骨折愈合的临床研究众多。NEER等[17]进行的随机、双盲、对照研究的临床试验中,随机分配1 637名绝经后椎骨骨折的女性,每日皮下注射20μg或40μg甲状旁腺激素1-34或安慰剂。实验结果证实特立帕肽可刺激骨形成,从而增加骨量和骨强度,并发现特立帕肽对骨矿物质密度的增加呈剂量依赖性,40μg的剂量增加骨矿物质密度更大,但较20μg的剂量更可能产生不良反应。YOO等[18]将41例老年骨功能不全骨折患者分成特立帕肽组(21例)和对照组(20例),结果特立帕肽治疗组的所有骨折均得到了治愈,对照组中仅有4处骨折得到了治愈。KITAGUCHI等[19]对48例患有急性骨质疏松性椎体骨折的患者给予每周一次特立帕肽治疗,结果表明特立帕肽可促进急性骨质疏松性椎体骨折患者的早期骨结合。这2项临床研究证实了特立帕肽促进骨折愈合的作用。CHEN等[20]进行的回顾性队列研究(美国3项,中国1项,日本1项)及荟萃分析进一步表明坚持使用特立帕肽与骨折风险的降低显著相关。
在美国、欧盟和日本在内的许多国家/地区,特立帕肽推荐剂量为20μg/d自行皮下注射,其不良反应包括恶心、头疼、头晕、高血钙等,高钙血症患者慎用[17]。特立帕肽致癌性的相关研究表明其长期注射会增加实验动物的骨肉瘤风险,对于高风险患者(如佩吉特骨病患者)要避免使用此药[21];但特立帕肽与骨肉瘤之间的相关性在临床研究中尚未得到证实,尚需要长期的临床研究确定特立帕肽和骨肉瘤的关系[22]。另一方面,甲状旁腺激素在破骨细胞分化因子的分泌中起作用,即使间歇给药,长期使用特立帕肽最终也导致骨吸收的增加,并且似乎骨吸收缓慢赶上骨形成,导致18-24个月后净合成代谢效应的平稳[23];净合成代谢效应的降低还与长期使用药物后机体产生耐药性和(或)间充质成骨细胞前体细胞池消耗有关。因此在美国持续服用特立帕肽治疗仅限于2年(欧洲18个月)[24,25]。日本和韩国批准特立帕肽每周1次56.5μg门诊注射的剂量方案,但其恶心、呕吐、头痛的不良反应更大,持续治疗存在困难[26,27]。KUMAGAI等[28]进行的关于健康绝经后妇女每周2次皮下注射特立帕肽的安全性单盲随机研究显示,每周2次28.2μg注射液(无论剂量间隔如何)的新剂量方案与每周1次56.5μg注射液保持了可比的功效,同时改善了安全性,这项新的剂量方案为改善使用特立帕肽治疗的连续性提供参考。
特立帕肽给药方式为皮下注射。COSMAN等[29]应用特立帕肽贴皮剂在临床取得良好的疗效;口服、鼻腔给药方式也在研究中,为甲状旁腺激素新的给药方式提供参考[30,31]。
研究表明,特立帕肽与非双膦酸盐类骨吸收抑制药(地诺单抗、雷洛昔芬、激素疗法)的联合治疗在改善骨矿物质密度和降低骨折风险方面优于单一治疗,但需进一步研究确定这种联合治疗策略的抗骨折疗效、成本效益和安全性。停止使用特立帕肽,需要补加双膦酸盐或其他抑制骨吸收的药物,防止因快速停药可能导致的骨质流失加快[32]。
2.3 特立帕肽在口腔领域的相关研究
在口腔领域,VOHRA等[33]、BEPPU等[34]报道骨质疏松症会影响颌骨骨密度,降低牙槽骨矿物质含量和剩余牙槽骨体积,进而影响种植体骨结合,导致种植体松动、种植失败。骨质疏松症与牙周疾病呈正相关性,在牙周病的发生、发展中起重要作用,从而会加重颌骨的骨丢失(包括牙周炎牙槽骨吸收、剩余牙槽嵴骨吸收)及牙齿脱落[35]。骨质疏松症是颞下颌关节紊乱综合征的危险因素之一。骨质疏松症的药物治疗对口腔颌面部骨会产生相应积极影响,也会引起相应的不良反应,诸如双膦酸盐引起的颌骨坏死[36]。以上研究表明,骨质疏松症与牙周病学、口腔修复学,尤其是口腔种植学息息相关。骨质疏松症会影响口腔健康状况,而骨质疏松症的治疗对颌骨有一定的积极作用[1]。因此,特立帕肽作为有明显成骨效果的骨合成代谢药,引起口腔领域的关注,目前其研究的重点主要集中在种植体-骨结合及牙周再生方面。
2.3.1 特立帕肽与种植体-骨结合
种植体表面和骨组织之间实现结构和功能上的联结是口腔种植成功的基础,骨量减少、骨质下降等都会影响种植体-骨结合的效果。新近的研究显示应用特立帕肽能够促进骨形成,有效提高种植体周围的骨骼质量,增强种植体支抗,促进种植体与骨结合。SHIROTA等[37]在大鼠卵巢切除术后21 d于大鼠胫骨近端放置钛植入物,每周3次皮下注射特立帕肽持续1个月,结果发现植入物周围的骨小梁形成明显增加,证明间歇性给予特立帕肽可能会增加种植体周围的骨密度并改善种植体植入的临床效果。ALMAGRO等[38]于骨质疏松兔模型的胫骨干骺端植入钛棒,间歇给予特立帕肽12周,发现特立帕肽可以增强钛植入物周围的骨矿物质密度。JIANG等[39]给予20个月龄大鼠每天皮下注射30μg/kg特立帕肽,5周后的放射学和组织学分析证实特立帕肽治疗可改善老年骨髓间充质干细胞的成骨潜能,并改善植入物的骨整合。KUCHLER等[40]进行的关于特立帕肽对钛植入物骨整合影响的临床可行性研究中,纳入24例下颌无牙患者并在下颌骨植入2颗钛植入物,随机分配为2组,每天接受1次20μg的特立帕肽治疗或不接受治疗,持续28 d,9周后的组织形态学分析结果表明:特立帕肽组每单位组织的骨体积和新的骨-植入物接触都较对照组高。以上研究充分证明特立帕肽是一种很有潜力的实现良好种植体-骨结合的药物,但相关研究限于动物实验及少量临床研究阶段,需要更多更高质量的研究予以证实,其促进植入物骨整合的作用机制也尚待阐明。
2.3.2 特立帕肽与牙周再生
牙周炎会导致牙周支持组织(牙龈、牙周膜、牙槽骨、牙骨质)的破坏。牙周治疗可以控制牙周炎症,但牙周结构的损失仍然存在。怎样实现牙周再生(新的牙槽骨、牙骨质、功能性牙周膜形成)是临床医生面临的重大挑战,已有体外研究显示特立帕肽对牙周膜细胞的存活和骨保护素的表达有影响[41],但对组织再生背后的机制缺乏全面的了解[42]。VASCONCELOS等[43]在大鼠下颌第一磨牙远中根颊侧造成骨开窗缺损,同时去除牙周膜和牙骨质,16只大鼠随机分为2组,分别给予特立帕肽40μg/kg和安慰剂,与对照组相比,间断给予特立帕肽增强了骨形成及新的牙骨质样组织的沉积。SILVA等[44]报道特立帕肽间歇给药可以促进大鼠切牙萌发的延迟,得出特立帕肽可通过增强骨形成并增加Sharpey纤维的面积密度来降低牙齿萌发率的结论。DE OLIVEIRA等[45]对切除睾丸的大鼠进行特立帕肽治疗,也证明特立帕肽可以增加牙槽骨修复过程中的骨转换强度,从而增加骨量并降低孔隙率。BASHUTSKI等[46]进行了一项关于特立帕肽对人类口腔骨质状况影响的临床试验,共有40例患有严重慢性牙周炎的患者接受了牙周手术,并从术前3 d到术后6周每日皮下注射特立帕肽(20μg)或安慰剂,患者随访1年(除试验组1例患者失访外)。结果显示:特立帕肽治疗1年后骨质缺损的放射线性分辨率显著高于安慰剂组,骨骼的平均线性增益分别为29%和3%(P<0.001);与安慰剂相比,特立帕肽在牙周病的治疗中有更好的疗效,对促进口腔颌面部骨再生、改善牙槽骨缺损有明显临床效果。由此证明,特立帕肽具有调控牙周组织活性,提高牙周病治疗的疗效,促进牙周组织愈合的能力,但需要进行大样本的临床随机对照试验才能更好地了解其临床应用前景。
2.3.3 其他方面
特立帕肽在口腔领域的研究还有很多,LI等[47]及LOSSDORFER等[48]表明甲状旁腺激素能够同时刺激压力侧骨吸收和张力侧骨形成,促进牙槽骨改建,从而有利于正畸牙移动。ZANDI等[49]制作大鼠下颌骨缺损模型,并通过分级系统对愈合过程进行组织学评估和评分,结果表明皮下注射2μg/(kg·d)特立帕肽治疗组骨缺损的愈合效果更好。特立帕肽应用于药物相关性颌骨坏死治疗方面,已经有大量的动物实验和少量临床病例报道,ZANDI等[50]动物实验表明特立帕肽治疗成功改善了药物相关性颌骨坏死大鼠下颌骨骨折的愈合。KAKEHASHI等[51]、KIM等[52]进行的病例报告证明每周1次特立帕肽治疗可能取得较好的疗效。JUNG等[53]联合使用特立帕肽和局部应用重组人骨形态发生蛋白2(rhBMP-2)促进药物相关性颌骨坏死患者颌骨骨再生。特立帕肽联合局部给药的新方式为口腔颌面部局部骨再生提供新思路。CHA等[54]对2例患有晚期放射性颌骨坏死的舌癌患者进行特立帕肽治疗并补充了血清钙和维生素D,患者的骨缺损再生良好,此经验为某些难治性放射性颌骨坏死患者提供有效的治疗选择。但特立帕肽应用于颌骨坏死治疗仍需要进一步的前瞻性研究以确定其临床应用价值。
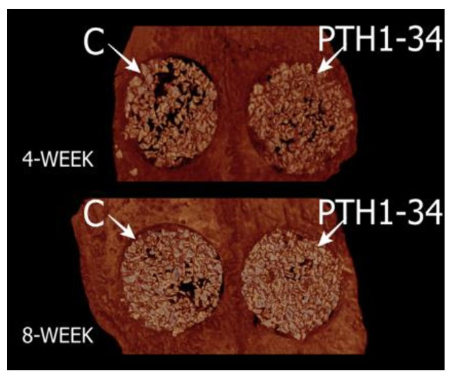
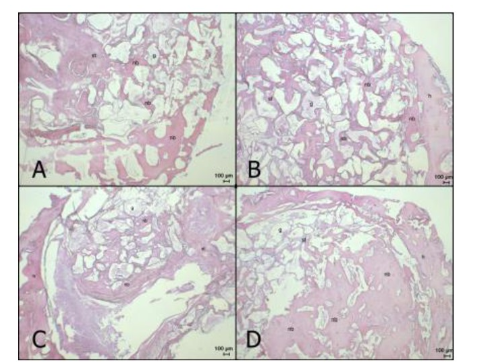
近年来,组织工程骨修复骨缺损成为专家学者们研究讨论的热点。VALDERRAMA等[55]以狗为实验动物,将特立帕肽与合成的聚乙二醇基水凝胶共价结合,并将其植入外科手术造成的缺损周围,其结果显示在仿生合成基质中递送甲状旁腺激素对牙科植入物周围的骨再生有积极作用。OZER等[56]在兔颅骨缺损模型的动物实验中应用异种移植物载体与特立帕肽局部给药相结合进行治疗,结果显示特立帕肽组的总骨量在第4周和第8周均显著高于对照组,见图1,2。间歇性全身施用特立帕肽对骨愈合具有积极作用,然而特立帕肽在动物模型中的局部少量连续用药显示了对骨愈合的积极作用,但是需要使用不同的动物模型以确定其有效性及最佳的剂量方案。尽管对特立帕肽的局部给药进行了一些研究,但将特立帕肽递送至缺损区域的载体系统尚未得到全面评估。在未来的研究中使用其他载体系统来递送特立帕肽,将有助于确定最适合特立帕肽局部给药的载体系统。
图1 兔颅骨缺损模型的微计算机断层扫描(Micro-CT)图像[56]
图注:C表示对照组,仅异种骨移植;PTH1-34为特立帕肽组,应用特立帕肽联合异种骨移植
图2 兔颅骨缺损模型术后4 周和8周的组织学图像[56]
图注:A,B为第4周,对照组和特立帕肽组;C,D为第8周,对照组和特立帕肽组。nb:新骨小梁;g:移植材料;st:软组织;h:宿主骨
3 总结与展望Conclusions and prospects
特立帕肽可以直接刺激新骨的成骨细胞形成,实现有效的合成代谢,但其合成代谢特性不仅限于应用于骨质疏松症。特立帕肽在口腔领域的研究表现出良好的促进种植体-骨结合、牙周再生、骨缺损愈合及提高正畸稳定性的效果,在口腔领域有良好的应用前景,但仍需要更多更高质量的动物实验及临床研究证实,特立帕肽局部给药方式的最佳剂量及载体系统也需要进一步研究。未来甲状旁腺激素类药物及其类似物可与骨组织工程技术有机结合,更好地促进骨修复,同时也更好地服务于口腔颌面部的修复治疗。
作者贡献:第一作者及通讯作者负责综述构思设计,第一、二作者参与文献收集、分析总结。
经费支持:该文章接受了“山东省医药卫生科技发展计划项目(2016WS0121)”“滨州医学院科技计划项目(BY2017KJ05)”的资助。所有作者声明,经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
利益冲突:文章的全部作者声明,在课题研究和文章撰写过程不存在利益冲突。
写作指南:该研究遵守《系统综述和荟萃分析报告规范》(PRISMA指南)。
文章查重:文章出版前已经过专业反剽窃文献检测系统进行3次查重。
文章外审:文章经小同行外审专家双盲外审,同行评议认为文章符合期刊发稿宗旨。
文章版权:文章出版前杂志已与全体作者授权人签署了版权相关协议。
开放获取声明:这是一篇开放获取文章,根据《知识共享许可协议》“署名-非商业性使用-相同方式共享4.0”条款,在合理引用的情况下,允许他人以非商业性目的基于原文内容编辑、调整和扩展,同时允许任何用户阅读、下载、拷贝、传递、打印、检索、超级链接该文献,并为之建立索引,用作软件的输入数据或其它任何合法用途。
参考文献
[1]冯钰,刘福祥.骨质疏松症对颌骨的影响及其治疗的研究进展[J].国际口腔医学杂志,2008,35(S1):11-13.
[2] KANIS JA, COOPER C, RIZZOLI R, et al. Executive summary of the European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Calcif Tissue Int. 2019;104(3):235-238.
[3] POLYZOS SA, MAKRAS P, EFSTATHIADOU Z, et al.Investigational parathyroid hormone receptor analogs for the treatment of osteoporosis. Expert Opin Investig Drugs. 2015;24(2):145-157.
[4] BARON R, HESSE E. Update on bone anabolics in osteoporosis treatment:rationale, current status, and perspectives. J Clin Endocrinol Metab. 2012;97(2):311-325.
[5]BOGADO CE, MASSARI FE, ZANCHETTA JR. Parathyroid hormone(1-84)and teriparatide in the treatment of postmenopausal osteoporosis. Womens Health(Lond). 2006;2(3):447-457.
[6] KEUTMANN HT, SAUER MM, HENDY GN, et al. Complete amino acid sequence of human parathyroid hormone. Biochemistry.1978;17(26):5723-5729.
[7] LANGDAHL BL, ANDERSEN JD. Treatment of Osteoporosis:Unmet Needs and Emerging Solutions. J Bone Metab. 2018;25(3):133-140.
[8]王敏娇,司家文,沈国芳.促进骨形成的甲状旁腺激素:作用及机制[J].中国组织工程研究,2015,19(15):2405-2409.
[9]陈茜,曹国颖.新型骨质疏松症治疗药abaloparatide的作用机制与临床评价[J].临床药物治疗杂志,2018,16(7):37-40.
[10] BELLIDO T, ALI AA, PLOTKIN LI, et al. Proteasomal degradation of Runx2 shortens parathyroid hormone-induced anti-apoptotic signaling in osteoblasts. A putative explanation for why intermittent administration is needed for bone anabolism. J Biol Chem. 2003;278(50):50259-50272.
[11] QIN L, LI X, KO JK, et al. Parathyroid hormone uses multiple mechanisms to arrest the cell cycle progression of osteoblastic cells from G1 to S phase. J Biol Chem. 2005;280(4):3104-3111.
[12] JILKA RL. Molecular and cellular mechanisms of the anabolic effect of intermittent PTH. Bone. 2007;40(6):1434-1446.
[13] WINKLER DG, SUTHERLAND MK, GEOGHEGAN JC, et al.Osteocyte control of bone formation via sclerostin, a novel BMP antagonist. EMBO J. 2003;22(23):6267-6276.
[14] KHOSLA S, WESTENDORF JJ, OURSLER MJ. Building bone to reverse osteoporosis and repair fractures. J Clin Invest. 2008;118(2):421-428.
[15] BIKLE DD, SAKATA T, LEARY C, et al. Insulin-like growth factor I is required for the anabolic actions of parathyroid hormone on mouse bone. J Bone Miner Res. 2002;17(9):1570-1578.
[16] FOX J. Developments in parathyroid hormone and related peptides as bone-formation agents. Curr Opin Pharmacol.2002;2(3):338-344.
[17] NEER RM, ARNAUD CD, ZANCHETTA JR, et al. Effect of parathyroid hormone(1-34)on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med.2001;344(19):1434-1441.
[18] YOO JI, HA YC, RYU HJ, et al. Teriparatide Treatment in Elderly Patients With Sacral Insufficiency Fracture. J Clin Endocrinol Metab. 2017;102(2):560-565.
[19] KITAGUCHI K, KASHII M, EBINA K, et al. Effects of Weekly Teriparatide Administration for Vertebral Stability and Bony Union in Patients with Acute Osteoporotic Vertebral Fractures. Asian Spine J. 2019;13(5):763-771.
[20] CHEN Q, GUO M, MA X, et al. Adherence to Teriparatide Treatment and Risk of Fracture:A Systematic Review and Meta-Analysis. Horm Metab Res. 2019;51(12):785-791.
[21]徐陆晨,李运峰.骨质疏松性骨折药物治疗的研究进展[J].中国骨质疏松杂志,2017,23(7):947-953.
[22] ANDREWS EB, GILSENAN A, MIDKIFF K, et al. Challenges in studying very rare cancer outcomes and infrequent exposures:example of teriparatide and osteosarcoma. Ann Epidemiol.2016;26(11):751-753.
[23] DRAKE MT, SRINIVASAN B, M?DDER UI, et al. Effects of intermittent parathyroid hormone treatment on osteoprogenitor cells in postmenopausal women. Bone. 2011;49(3):349-355.
[24] GREY A. Teriparatide for bone loss in the jaw. N Engl J Med.2010;363(25):2458-2459.
[25] PAZIANAS M. Anabolic effects of PTH and the'anabolic window'.Trends Endocrinol Metab. 2015;26(3):111-113.
[26] NAKAMURA T, SUGIMOTO T, NAKANO T, et al. Randomized Teriparatide[human parathyroid hormone(PTH)1-34]Once-Weekly Efficacy Research(TOWER)trial for examining the reduction in new vertebral fractures in subjects with primary osteoporosis and high fracture risk. J Clin Endocrinol Metab.2012;97(9):3097-3106.
[27] USUI T, FUNAGOSHI M, SETO K, et al. Persistence of and switches from teriparatide treatment among women and men with osteoporosis in the real world:a claims database analysis. Arch Osteoporos. 2018;13(1):54.
[28] KUMAGAI Y, OSE A, TANAKA K, et al. Safety Profiles,Pharmacokinetics, and Changes in Bone Turnover Markers After Twice-Weekly Subcutaneous Administration of Teriparatide in Healthy Japanese Postmenopausal Women:A Single-Blind Randomized Study. Clin Pharmacol Drug Dev. 2020;9(1):87-96.
[29] COSMAN F, LANE NE, BOLOGNESE MA, et al. Effect of transdermal teriparatide administration on bone mineral density in postmenopausal women. J Clin Endocrinol Metab. 2010;95(1):151-158.
[30] H?MMERLE SP, MINDEHOLM L, LAUNONEN A, et al. The single dose pharmacokinetic profile of a novel oral human parathyroid hormone formulation in healthy postmenopausal women. Bone. 2012;50(4):965-973.
[31] PEARSON RG, MASUD T, BLACKSHAW E, et al. Nasal Administration and Plasma Pharmacokinetics of Parathyroid Hormone Peptide PTH 1-34 for the Treatment of Osteoporosis.Pharmaceutics. 2019;11(6):E265.
[32] GUA?ABENS N, MORO-?LVAREZ MJ, CASADO E, et al. The next step after anti-osteoporotic drug discontinuation:an up-to-date review of sequential treatment. Endocrine. 2019;64(3):441-455.
[33] VOHRA F, AL-RIFAIY MQ, ALMAS K, et al. Efficacy of systemic bisphosphonate delivery on osseointegration of implants under osteoporotic conditions:lessons from animal studies. Arch Oral Biol. 2014;59(9):912-920.
[34] BEPPU K, KIDO H, WATAZU A, et al. Peri-implant bone density in senile osteoporosis-changes from implant placement to osseointegration. Clin Implant Dent Relat Res. 2013;15(2):217-226.
[35] DARCEY J, HORNER K, WALSH T, et al. Tooth loss and osteoporosis:to assess the association between osteoporosis status and tooth number. Br Dent J. 2013;214(4):E10.
[36] ANIL S, PREETHANATH RS, ALMOHARIB HS, et al. Impact of osteoporosis and its treatment on oral health. Am J Med Sci.2013;346(5):396-401.
[37] SHIROTA T, TASHIRO M, OHNO K, et al. Effect of intermittent parathyroid hormone(1-34)treatment on the bone response after placement of titanium implants into the tibia of ovariectomized rats.J Oral Maxillofac Surg. 2003;61(4):471-480.
[38] ALMAGRO MI, ROMAN-BLAS JA, BELLIDO M, et al. PTH[1-34]enhances bone response around titanium implants in a rabbit model of osteoporosis. Clin Oral Implants Res. 2013;24(9):1027-1034.
[39] JIANG L, ZHANG W, WEI L, et al. Early effects of parathyroid hormone on vascularized bone regeneration and implant osseointegration in aged rats. Biomaterials. 2018;179:15-28.
[40] KUCHLER U, LUVIZUTO ER, TANGL S, et al. Short-term teriparatide delivery and osseointegration:a clinical feasibility study. J Dent Res. 2011;90(8):1001-1006.
[41] KRAUS D, J?GER A, ABUDUWALI N, et al. Intermittent PTH(1-34)signals through protein kinase A to regulate osteoprotegerin production in human periodontal ligament cells in vitro. Clin Oral Investig. 2012;16(2):611-618.
[42] AUSENDA F, RASPERINI G, ACUNZO R, et al. New Perspectives in the Use of Biomaterials for Periodontal Regeneration. Materials(Basel). 2019;12(13):E2197.
[43] VASCONCELOS DF, MARQUES MR, BENATTI BB, et al.Intermittent parathyroid hormone administration improves periodontal healing in rats. J Periodontol. 2014;85(5):721-728.
[44] SILVA MA, VASCONCELOS DF, MARQUES MR, et al.Parathyroid hormone intermittent administration promotes delay on rat incisor eruption. Arch Oral Biol. 2016;69:102-108.
[45] DE OLIVEIRA PUTTINI I, GOMES-FERREIRA PHDS, DE OLIVEIRA D, et al. Teriparatide improves alveolar bone modelling after tooth extraction in orchiectomized rats. Arch Oral Biol. 2019;102:147-154.
[46] BASHUTSKI JD, EBER RM, KINNEY JS, et al. Teriparatide and osseous regeneration in the oral cavity. N Engl J Med. 2010;363(25):2396-2405.
[47] LI F, LI G, HU H, et al. Effect of parathyroid hormone on experimental tooth movement in rats. Am J Orthod Dentofacial Orthop. 2013;144(4):523-532.
[48] LOSSD?RFER S, YILDIZ F, G?TZ W, et al. Anabolic effect of intermittent PTH(1-34)on the local microenvironment during the late phase of periodontal repair in a rat model of tooth root resorption. Clin Oral Investig. 2010;14(1):89-98.
[49] ZANDI M, DEHGHAN A, GHEYSARI F, et al. Evaluation of teriparatide effect on healing of autografted mandibular defects in rats. J Craniomaxillofac Surg. 2019;47(1):120-126.
[50] ZANDI M, DEHGHAN A, AMINI P, et al. Evaluation of the effect of teriparatide therapy on mandibular fracture healing in rats with medication-related osteonecrosis of the jaw. Clin Oral Investig.2019;23(11):3987-3993.
[51] KAKEHASHI H, ANDO T, MINAMIZATO T, et al. Administration of teriparatide improves the symptoms of advanced bisphosphonate-related osteonecrosis of the jaw:preliminary findings. Int J Oral Maxillofac Surg. 2015;44(12):1558-1564.
[52] KIM JY, PARK JH, JUNG HD, et al. Treatment of Medication-Related Osteonecrosis of the Jaw Around the Dental Implant With a Once-Weekly Teriparatide:A Case Report and Literature Review. J Oral Implantol. 2019;45(5):403-407.
[53] JUNG J, YOO HY, KIM GT, et al. Short-Term Teriparatide and Recombinant Human Bone Morphogenetic Protein-2 for Regenerative Approach to Medication-Related Osteonecrosis of the Jaw:A Preliminary Study. J Bone Miner Res. 2017;32(12):2445-2452.
[54] CHA YH, HONG N, RHEE Y, et al. Teriparatide therapy for severe,refractory osteoradionecrosis of the jaw. Osteoporos Int. 2018;29(4):987-992.
[55] VALDERRAMA P, JUNG RE, THOMA DS, et al. Evaluation of parathyroid hormone bound to a synthetic matrix for guided bone regeneration around dental implants:a histomorphometric study in dogs. J Periodontol. 2010;81(5):737-747.
[56]?ZER T, BA?LARLI?, AKTA?A, et al. Locally administrated single-dose teriparatide affects critical-size rabbit calvarial defects:A histological, histomorphometric and micro-CT study. Acta Orthop Traumatol Turc. 2019;53(6):478-484.
点击查看>>口腔医学毕业论文(热门推荐8篇)其他文章