摘 要: 目前全球唯一获得批准且应用最广泛的结核病疫苗是卡介苗,它能有效预防婴幼儿结核性脑膜炎和播散性结核病的发生,但是对青少年和成人的保护作用有限,对已感染结核分枝杆菌人群的保护效果也欠佳。因此,开发新型高效疫苗、提高疫苗免疫强度、增长疫苗保护时间成为结核病防控的主要研究方向。作者就多样化的结核病疫苗类型、接种途径和免疫策略进行梳理,总结关于提高疫苗效力的信息,以期为临床前和临床试验方案的并行改进提供参考。
关键词 : 卡介苗;疫苗;接种;综述;
Abstract: BCG vaccine is now the only approved and the most widely used tuberculosis vaccine worldwide.It can effectively prevent the tuberculous meningitis in infant and the disseminated tuberculosis,however,for teenagers and adults,as well as those who have been infected with MTB,the protection effect is poor.Therefore,the main research direction of tuberculosis prevention and control includes to develop new effective vaccines,to increase the immune intensity of vaccine and extend protection time of vaccines.The authors reviewed various tuberculosis vaccine types,inoculation routes and immunization strategies,and summarized the information of improving vaccine efficacy,in order to provide reference for the parallel improvement of pre-clinical and clinical trial protocols.
Keyword: BCG vaccine; Vaccines; Vaccination; Review;
卡介苗(BCG)是目前唯一获准使用的结核病疫苗,自1921年首次应用于人体以来,全球已约有80%的国家将其列入免疫规划[1]。虽然BCG在预防婴幼儿结核性脑膜炎和播散性结核病中已表现出明显的有效性,但是其针对青少年和成人的保护效果在不同的地理区域差异较大,并且对结核分枝杆菌的原发感染以及潜伏感染的激活也缺乏有效保护,因此,开发新型疫苗成为结核病研究的优先领域[2]。当前需要的疫苗应能提供比BCG更好的保护效果,能预防所有类型的结核病(包括耐药结核病和结核分枝杆菌潜伏感染),对包括人免疫缺陷病毒(human immunodeficiency virus,HIV)感染者在内的所有年龄段人群都有持续保护作用[2]。经过全球结核病研究工作者的不懈努力,目前已有20多种候选疫苗通过临床研究取得一定进展,在安全性、免疫原性、辅助治疗等方面表现出了一定优势,但是由于结核病发病机制和宿主免疫反应的复杂性[3],现有的候选疫苗尚不足以替代BCG。此外,也有研究者试图通过调整疫苗接种途径和免疫策略来提高疫苗免疫强度、延长疫苗保护时间,并取得一定进展。笔者就目前国内外进入临床试验阶段的新型结核病疫苗、多样化的接种途径以及免疫策略予以综述,总结关于提高疫苗保护效果的相关信息,以期为临床前和临床试验方案的并行改进提供参考。
结核病疫苗研究概况
虽然约85%~95%的人群在感染结核分枝杆菌后是可以控制的,未出现任何结核病相关症状[4],但是当前结核病的流行现状表明,多数人并不能仅依靠自身对结核分枝杆菌感染产生充分的免疫抵抗力,这突出了接种疫苗的重要性。BCG目前是全球应用最广泛的结核病疫苗,是一种减毒牛分枝杆菌活疫苗。大多数国家通常会在婴儿出生后数日内或首次接受卫生服务时即接种BCG,目前全球已累计接种超过40亿剂[1]。世界卫生组织发布的文件表明,虽然接种BCG可预防儿童结核性脑膜炎和播散性结核病,但不能预防成年人感染结核分枝杆菌[2],这是导致青少年及成年人患肺结核的重要原因。此外,对免疫功能缺陷患者(如艾滋病患者)接种BCG时,发生播散性结核分枝杆菌感染的风险是正常儿童的数百倍,且预后较差,严重者可致死[5],这使人们不得不对BCG的安全性进行重新评估。鉴于目前结核病的持续流行和耐药菌株的传播,亟待研发一种免疫持续期更长且对成年人及免疫功能缺陷人群安全有效的新型结核病疫苗。根据不同用途,目前进入临床试验阶段的结核病疫苗可大致分为感染预防、疾病预防、复发预防或辅助治疗用疫苗;根据研发平台的不同又可分为两大类:分枝杆菌全菌衍生疫苗(活疫苗、灭活疫苗)和针对特定抗原的亚单位疫苗。
一、分枝杆菌全菌衍生疫苗
全菌疫苗来源于结核分枝杆菌、BCG或与之密切相关的非结核分枝杆菌。这类疫苗可进一步细分为经基因修饰的减毒活疫苗(VPM 1002、MTBVAC)[6,7]、全菌或其提取物制成的灭活疫苗(Vaccae、MIP、DAR-901、RUTI)[8,9,10,11]。分枝杆菌全菌衍生疫苗作为一种引人注目的疫苗,具有几项特殊优势。其中最主要的是BCG这种全菌减毒活疫苗的有效性已经在全球得到证实,为全菌衍生疫苗的研发提供了坚实的理论支撑。此外,全菌来源的疫苗包含许多不同的抗原成分,由于脂类、糖脂(广泛存在于结核分枝杆菌表面)、代谢产物、磷酸化抗原等非蛋白质抗原的存在,因此有可能比亚单位疫苗更能激发多种免疫反应,发挥更加全面的保护作用。
除了考虑疫苗的免疫原性以外,安全性也是候选分枝杆菌活疫苗的一个至关重要的考虑因素。尽管全菌疫苗具有高度的免疫原性,但由于减毒菌株可在体内存活较长时间,因此仍存在引起不良反应的风险,必须对它们的安全性进行广泛、长期的临床评估。目前,基因修饰BCG(VPM 1002)已在南非感染HIV的婴儿中完成了临床Ⅱa期评估。该试验是在对健康婴儿和成人进行广泛的临床前评估和安全性及免疫原性论证之后开始的,暂未发现任何安全问题[12]。如果在临床Ⅲ期评估试验中证明VPM 1002在HIV阳性和阴性婴儿上都比BCG更加安全,那么它可能将是继BCG之后第一个进入市场的新型结核病疫苗。减毒结核分枝杆菌(MTBVAC)也已在瑞士和南非完成了临床Ⅱa期的评估,发现对成人和儿童都是安全的[13]。热灭活母牛分枝杆菌(Vaccae)在我国已经被批准为结核病患者的辅助治疗用疫苗,可调节外周血T淋巴细胞及细胞因子水平,增强机体免疫功能,促进病灶吸收[14]。而热灭活非结核分枝杆菌(MIP)在印度被批准为麻风病疫苗,但是作为治疗性疫苗,它们的作用机制尚不明确,有待相关试验结果进行证明。而结核分枝杆菌细胞壁(RUTI)作为一种有潜力的治疗用疫苗,在经异烟肼治疗1个月后的结核分枝杆菌潜伏感染者中进行评估,发现其对结核分枝杆菌潜伏感染者是安全且具有免疫原性的,目前RUTI正在感染和未感染HIV的结核分枝杆菌潜伏感染人群中进行临床评估,并计划对耐多药结核病患者进行一项附加试验[15]。以上进入临床试验阶段的结核病疫苗,虽然分别在安全性、免疫原性、辅助治疗等方面表现出了一定优势,但是尚未足以替代BCG,能否进入市场取决于后续的临床评估试验结果。
二、亚单位疫苗
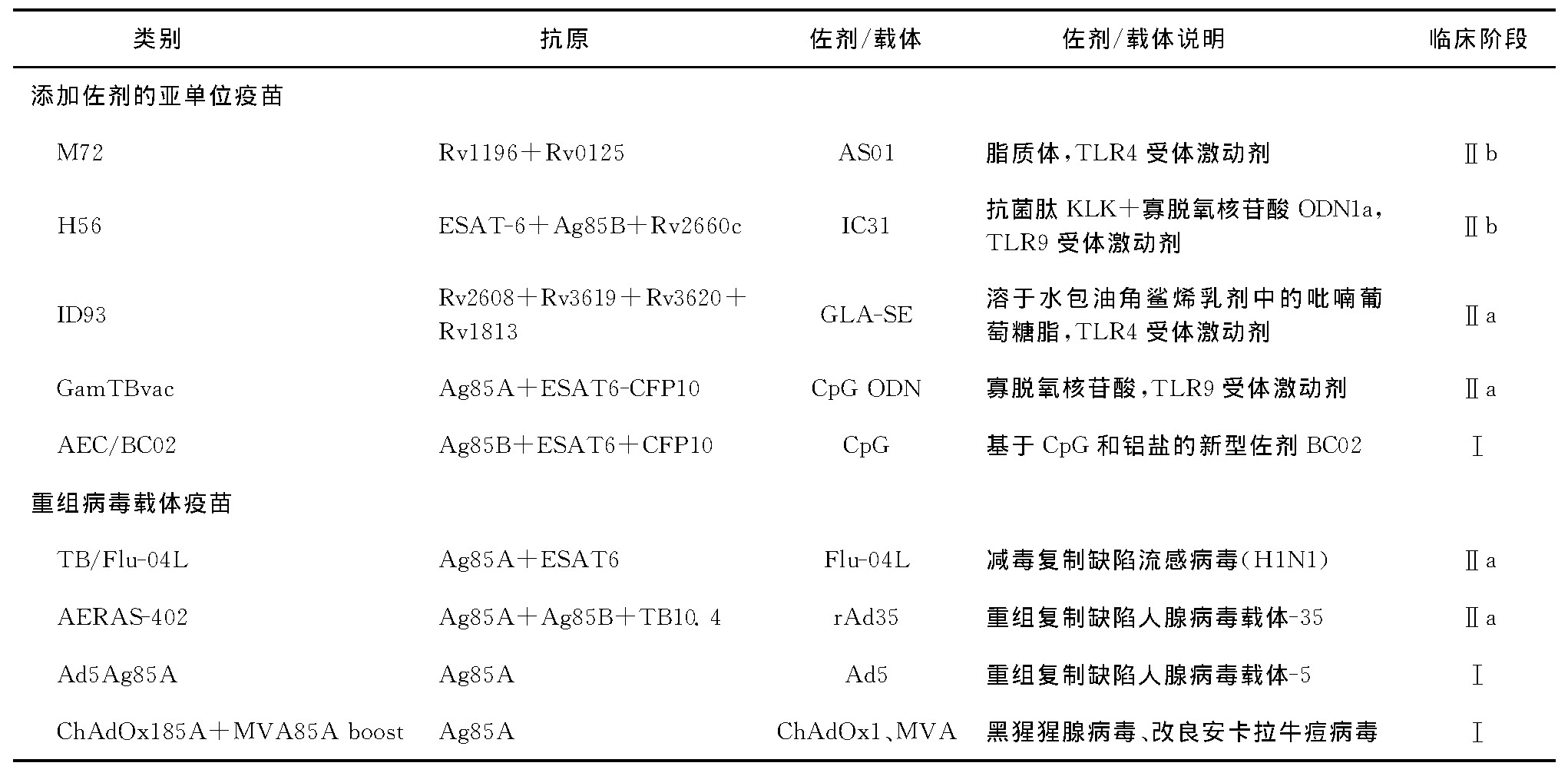
亚单位疫苗多数属于增强疫苗,作为BCG接种后的增强剂,可改善或延长BCG诱导的免疫反应,具有一定的应用前景。其中以M72/AS01为代表,该候选疫苗的Ⅱb期临床试验结果显示,疫苗可对结核分枝杆菌感染者产生约50%的保护功效(90%CI:12%~71%);在感染结核分枝杆菌的成人中,接种M72/AS01疫苗可提供至少3年的预防潜伏感染发展为活动性结核病的免疫保护[16]。如果该研究结果在Ⅲ期临床试验中得到证实,那么这种亚单位疫苗将非常有利于全球结核病预防工作。亚单位疫苗可进一步细分为添加佐剂的蛋白亚单位疫苗和重组病毒载体疫苗,如表1所示。添加佐剂的亚单位疫苗由单个抗原蛋白或一系列连接的抗原蛋白组成,与佐剂一起使用以增强对免疫系统的刺激,使疫苗中所含抗原的免疫影响最大化;重组病毒载体疫苗类似于添加佐剂的亚单位疫苗,病毒载体的目的是对所提供的抗原激发强烈且持久的免疫应答,从而避免对外源性佐剂的需要。与全菌疫苗相比,亚单位疫苗只针对少量选定的抗原,通常为6种或更少,因此开发亚单位疫苗的一个主要挑战是需要确定在这些疫苗中包含的最佳抗原,筛选安全有效的结核保护性抗原是研发新型亚单位疫苗的第一步。为此,科学家们进行了大量的筛选工作,从大约4000个结核分枝杆菌基因中确定与表达关键抗原相关的基因,这些关键抗原可以引起机体的保护性免疫应答[17]。李菲[18]将潜伏期细菌表达的优势抗原与生长期细菌的优势抗原结合,筛选免疫原性较强的结核分枝杆菌潜伏期抗原,制备含结核分枝杆菌潜伏期抗原的新型治疗性融合蛋白疫苗。目前临床试验阶段的疫苗中包含的抗原都已在结核病疫苗接种动物模型上进行了试验,以验证它们是否具有诱导某种形式的结核病保护性免疫的能力,而筛选标准则是它们应具有诱导Th1类细胞因子[γ-干扰素(IFN-γ)和肿瘤坏死因子]释放的能力,制定这种筛选标准的依据是临床上艾滋病患者具有较高的结核分枝杆菌原发性感染发生率或结核分枝杆菌潜伏感染再激活发生率[19],然而这些特征是否会导致保护性免疫的产生尚未确定。
结核病疫苗接种途径
开发持久有效的结核病疫苗的一个主要障碍是诱导和维持肺部的T细胞反应,以便结核分枝杆菌感染后可以立即得到控制,同时诱发系统性记忆细胞库以补充肺部组织。然而常规的注射途径(皮内和肌内注射)并不能诱导肺内高频率的常驻记忆T细胞产生,对于BCG接种剂量和接种途径影响全身和组织特异性T细胞免疫机制的认识尚且有限,此项研究一直没有取得突破性进展。直至最近有研究发现在对结核分枝杆菌高度敏感的恒河猴中,静脉注射BCG可预防或大大限制结核分枝杆菌的感染[20],从此疫苗接种途径对临床疾病防控效果的影响才重新走入我们的视线。虽然结核病疫苗的一些非常规接种途径具有其独特的优势,但是由此造成的安全性和耐受性问题,或将成为制约此项研究进展的重要因素。
表1 进入临床试验阶段的亚单位疫苗
一、静脉接种
近期,美国国立卫生研究院过敏与传染病研究所(NIAID)的研究人员发现,只需将适当剂量的BCG由皮下注射改为静脉注射就可以大大提高疫苗对恒河猴免受结核分枝杆菌感染的保护效果,与皮内或气溶胶接种相比,静脉接种免疫在血液、脾脏、支气管肺泡灌洗液和肺淋巴结中诱导了更多的效应性CD4+和CD8+T细胞应答。此外,静脉接种还诱导了遍布在肺实质组织中的高频率效应性T细胞[20]。静脉接种BCG在重症结核病动物模型中提供了前所未有的保护程度,代表着结核病疫苗研究领域的重大进步,这对疫苗接种和临床开发具有重要意义,并为定义免疫相关因素和疫苗引起的抗结核保护机制提供了一个模型。此外,NIAID还计划在临床试验中对静脉注射BCG进一步解析,确定这种免疫途径是否可以改善疫苗保护青少年和成年人免受结核分枝杆菌感染的效果[20]。然而目前没有哪一种结核病疫苗是允许静脉注射的,这种注射途径带来的安全风险是阻碍其用于临床的主要原因。
二、气溶胶接种
目前所有处于临床Ⅰ期以后的结核病疫苗都是通过肌内注射或皮内注射的方式接种的,可能无法在肺中产生足够多的关键免疫细胞,而通过气溶胶方式接种结核病疫苗或可直接刺激呼吸道黏膜和支气管周围对结核分枝杆菌的免疫反应,从而将结核分枝杆菌控制在感染初期。BCG喷雾剂曾在20世纪60年代被首次用于儿童和青少年,并没有关于出现不良反应的报道[21]。一些临床Ⅰ期的研究也正在探索通过气溶胶方式接种包括BCG和MVA85A在内的各种疫苗,检测其安全性和免疫原性,发现气溶胶接种途径的耐受性良好,与注射接种途径相比,气溶胶接种途径还可以诱导更强的黏膜免疫和全身性免疫[22]。另外,一些临床前的研究则通过探讨单独气溶胶接种或气溶胶接种与注射接种相结合的免疫效果,试图找到最佳的免疫组合策略[23]。由于气溶胶接种途径是一种使疫苗接种途径与感染途径相匹配的免疫方法,这种免疫方式不仅具有将疫苗直接送到呼吸道黏膜的优势,且操作方便、节约成本,因此在新型结核病疫苗的临床评价上具有广阔的应用前景。
三、干粉吸入接种
喷雾干燥法是最近才被应用于制造干粉疫苗的新工艺,该项工艺为可吸入颗粒疫苗的面世提供了可能。这些疫苗干粉具有空气动力学特性,吸入后可沉积在肺黏膜上,从而发挥更好的免疫保护作用。由于最初的结核分枝杆菌感染发生在肺部深处,其后是相邻支气管和肺泡表面形成肉芽肿,干粉喷雾接种途径接种的结核病疫苗也可直接进入肺部深处,因此具有更好诱导黏膜和系统性免疫反应的优势。干粉疫苗的适用性此前已被证明可用于流感和狂犬病疫苗的接种[24,25],但是仍需要在疫苗配方和递送方面进行大量研究,以确保可吸入结核病疫苗的安全性和有效性优于常规注射疫苗配方。Aneesh等[26]研究表明,喷雾干燥法处理后的结核亚单位疫苗仍保留完整可识别的抗原表位和佐剂活性,可诱导与未干燥处理疫苗类似的抗原特异性Th1、Th17和体液免疫反应,以及多功能CD4+T细胞反应;这些结果为开发一种耐高温、以干粉为基础的结核病疫苗提供了理论基础,使结核病疫苗具有更好的储存稳定性并减少对冷链设施的依赖,从而降低疫苗成本、简化接种途径,这有利于针对威胁全球公共卫生安全的传染性疾病(如结核病)开展大规模免疫运动。
四、口服接种
基于在巴西地区的长期使用以及近期英国的临床研究,口服BCG(Moreau Rio de Janeiro亚株)被证明是行之有效的,在皮内接种BCG之前口服单剂量的BCG可以在至少3个月之内提高结核菌素皮肤试验检测到的IFN-γ水平。值得注意的是,这种特殊的BCG亚株携带一个独特的RD16区域,该区域与其口服时的安全性密切相关[27]。此外,研究人员对BCG丹麦株(BCG-Danish)也进行了口服接种和皮内注射接种对比的小规模试验,未检测到不良反应。虽然皮内接种BCG可在血液中诱导更强的免疫反应,但口服BCG诱导了更强的支气管相关淋巴组织和分泌型IgA相关黏膜免疫反应[28]。口服疫苗作为一种有吸引力的接种途径,不仅是因为易于给药,也因为其可以诱导远端黏膜免疫应答。即使开发口服疫苗具有一定的挑战性,因为它需要疫苗足够稳定以承受胃中严酷的酸性环境,并且需要一种可以降低耐受性风险的佐剂,但口服结核病疫苗作为一种增强呼吸道和全身黏膜免疫反应的接种途径,具有其独特的优势。
结核病疫苗免疫策略
一、初免-加强免疫策略
除了多样化的疫苗接种途径之外,研究人员还在开发同源加强免疫或异源加强免疫的潜在能力。在同源加强免疫策略中,结核病疫苗的初免和加强阶段均接种相同种类的疫苗,提供相同的结核病抗原;在异源加强免疫策略中,则通过接种不同种类的疫苗,提供相同的结核病抗原。鉴于以不同方式提供抗原可能会刺激更加广泛的免疫应答,以及作为克服反向遗传载体疫苗免疫问题的手段,异源加强免疫策略变得越来越有吸引力。研究表明,在腺病毒-35载体结核病疫苗(表达Ag85A、Ag85B和TB10.4蛋白)的加强免疫下,重组BCG疫苗可诱导恒河猴产生更加强烈的抗原特异性T细胞反应[29]。同时,BCG也可用于DNA疫苗的加强免疫:以载有Ag85B、MPT64和MPT83抗原基因的DNA疫苗作为初免疫苗,再以BCG作为加强免疫疫苗。这种异源加强免疫策略可以刺激机体产生更强的免疫反应,与单独使用BCG相比可以更好地抵抗结核分枝杆菌的感染[30]。此外,精心设计的异源加强免疫策略还可扩大免疫反应的范围。中国第二军医大学的研究人员首先用早期分泌抗原靶6(ESAT-6)的DNA疫苗免疫小鼠,诱导Th1型免疫应答;再用含有相同抗原的重组蛋白疫苗加强免疫,诱导Th2型免疫应答。研究结果表明,当动物受到DNA和亚单位疫苗的联合刺激后,抗体和Th细胞增殖反应均明显增强,IFN-γ的产生明显增加,IgG2与IgG1之比以及T细胞的细胞毒性也明显增大[31],这对通过调整免疫策略预防结核感染具有重要意义。
虽然“卡介苗初免-异源加强免疫策略”的临床前研究已经进行了很长的时间,但是这种免疫策略仍未充分显示出优于BCG单独免疫的保护效果。研究发现,感染结核分枝杆菌前加强BCG免疫可以诱导很强的Th1型免疫反应并产生大量分泌细胞因子的T细胞,然而分泌白细胞介素(IL)-2的中枢记忆性T细胞(TCM)的量却没有增加。相反,感染结核分枝杆菌后加强BCG免疫则可以明显增加TCM和分泌IFN-γ的效应记忆性T细胞(TEM),TCM在遇到相同抗原刺激时会分泌大量的IL-2,并快速增殖分化为效应T细胞[32],小鼠过继转移实验显示TCM能够有效控制结核分枝杆菌的原发感染[33]。另外两项过继转移实验也表明,TCM比TEM能够更加有效地抵抗结核分枝杆菌感染,当前一些进入临床试验的结核病疫苗也同样强调诱导具有长期保护作用的TCM产生的重要性[34]。因此,诱导更加丰富的TCM的产生,可能是决定“卡介苗初免-异源加强免疫策略”能否抵抗结核分枝杆菌原发感染的重要因素。
二、调整接种时间间隔
BCG能够有效地控制儿童结核性脑膜炎和播散性结核病的发生,但是它刺激产生的保护性免疫随着年龄的增加逐渐减弱,对成人肺结核保护效果不确定。研究表明,BCG的持续刺激只能诱导较多寿命短暂的效应记忆性T细胞和效应T细胞的产生,而提供长效免疫保护效果的中枢记忆性T细胞产生较少[35],这可能是导致BCG刺激产生的保护性免疫随着年龄的增加逐渐减弱的重要因素。因此,研发新的结核病疫苗和有效的免疫策略来提高中枢记忆性T细胞的数量,增强长期的保护效果,是目前抵抗结核分枝杆菌感染的重要研究方向。根据记忆T细胞发育的原则,每次加强免疫至少应间隔2~3个月的时间,才能诱导产生更多的中枢记忆性T细胞,因此优化结核病疫苗免疫接种间隔对于诱导长效的免疫记忆具有重要意义。有研究发现,采用以融合蛋白ESAT6-Ag85B-MPT64 (190-198)-Mtb8.4-Rv2626c(LT70)为基础的亚单位疫苗,分别按照“0周-3周-6周”“0周-4周-12周”或“0周-4周-24周”的时间顺序免疫小鼠,后两种免疫策略比第一种免疫策略可诱导产生更高水平的IL-2、IFN-γ和肿瘤坏死因子-α(TNF-α),其中“0周-4周-12周”的免疫策略诱导产生的中枢记忆性T细胞数量最多,免疫反应最强烈,可以更加有效地抵抗结核分枝杆菌的感染[34]。此项研究结果提示,调整结核病疫苗的接种时间间隔,在一定程度上有助于诱导产生更丰富的中枢记忆性T细胞,增强对结核分枝杆菌感染的免疫保护。
总结与展望
鉴于目前结核病的发病人数、死亡人数以及耐药菌株的传播,如何让未感染人群预防结核病,清除潜伏感染人群的细菌预防发病,治疗已经发病的个体,成为当下结核病防治工作的重点。其中保护未感染人群是结核病防控的重要策略之一,因此开发新型结核病疫苗仍然是一项关键的全球卫生优先事项,为青少年和成年人接种疫苗也是控制结核分枝杆菌传播的最有效方式。目前,国内外新型结核病疫苗研究取得了巨大进展,有多个疫苗已进入临床试验阶段,为疫苗预防结核病的策略和候选疫苗的构建,提供了进一步发展的前景。但是结核病疫苗的发展仍然受平台、经费、政策等多种因素制约,其首要因素是如何提高临床开发效率。长期临床跟踪研究可以有效地探索结核病疫苗的保护效果和保护作用的持续时间,特别是在不同的环境、人群和年龄段中,以及疫苗接种对结核病发病率和死亡率的影响。多样化的结核病疫苗类型、接种途径和免疫策略代表了增加未来疫苗成功概率的新策略,临床前和临床试验方案的并行改进将使我们能够在更短的时间内以更低的成本收集更多关于提高疫苗效力的信息,从而打破结核病疫苗的发展壁垒。当然,改进结核病疫苗防控效果的研究过程漫长且花费巨大,必须经过全球的共同努力来实现。
参考文献
[1]Peck M,Gacic-Dobo M,Diallo MS,et al. Global Routine Vaccination Coverage 2018.MMWR Morb Mortal Wkly Rep,2019,68(42):937-942.doi:10. 15585/mmwr.mm6842a1.
[2]World Health Organization. Summary of the WHO Position Paper on BCG vaccines:WHO position paper. Geneva:World Health Organization,2018 .
[3]郭倩,申晨,申阿东.干细胞与结核分枝杆菌交互作用的研究进展.中国防痨杂志, 2021,43(2):1 86-189.doi:10.3969/j.issn.1000-66212021.02.015.
[4]World Health Organization.The global plan to end TB 2016-2020.the paradigm shift. Geneva:Stop TB Partnership,United Nations Office for Project Services,2015.
[5]陈柠,孙琳,申阿东,等.卡介苗接种后发生感染的可能原因研究现况.中国防痨杂志, 2020,42(8)-869-873 doi:10.3969/j. issn.1000-6621.2020.08.017。
[6]Nieuwenhuizen NE, Kulkarni PS, Shaligram U,et al. The recombinant Bacille Calmette-Guerin vaccine VPM1002:ready for clinical efficacy testing.Front Immunol,2017 ,8:1147.doi: 10.3389/fimmu.2017.01147.
[7]Gonzalo AJ,Marinova D,Martin C,et al.MTBVAC.attenuating the human pathogen of tuberculosis(TB)toward a promising vaccine against the TB epidemic.Front Immunol,2017,8:1803. doi:10.3389/fimmu.2017.01803.
[8]Yang XY,Chen QF,Li YP,et al.Mycobacterium vaccae as adjuvant therapy to anti-tuberculosis chemotherapy in never treated tuberculosis patients:a meta-analysis.PLoS One. 2011,6(9):e23826.doi:10.1371/journal.pone 0023826.
[9]Saqib M,Khatri R, singh B.et al. Mycobacterium indicus pranii as a booster vaccine enhances BCG induced immunity and confers higher protection in animal models of tuberculosis. Tuberculosis(Edinb),2016, 101:164-173 doi:10.1016/j.tube.2016.10.002.
[10]Munseri P,Said J,Amour M,et al.DAR-901vaccine for the prevention of infection with Mycobacterium tuberculosis among BCG-immunized adolescents inTanzania:A randomized controlled,double -blind phase 2btrial.Vaccine ,2020,38(46):7239-7245. doi:10.1016/j.vaccine.2020.09.055.
[11]Vilaplana C ,MontaneE Pinto S.et al.Double-blind,randomized,placebo-controlled phase 1 clinical trial of the therapeutical antituberculous vaccine RUTI.Vaccine,2010,28(4):1106-1116. doi:10. 1016/j.vaccine.2009.09.134 .
[12]Loxton AG,Knaul JK. Grode L,et al. Safety and immunogenicity of the recombinant Mycobacterium bovis BCG vaccine VPM1002in HIV-unexposed newborn infants in South Africa .Clin Vaccine Immunol,2017,24(2):e00439-16 .doi:10. 1128/CV1.00439-16.
[12]L oxton AG,Knaul JK, Grode L.et al.Safety and immunogenicity of the recombinant Mycobacterium bovis BCG vaccine VPM1002in HIV-unexposed newborn infants in South Africa. Clin Vaccine Immunol,2017 ,24(2):e00439-16 doi:10. 1128/CV1.00439-16.
[13]Tameris M,Mearns H,Penn-Nicholson A,et al.Live-attenuated Mycobacterium tuberculosis vaccine MTBVAC versus BCGin adults and neonates:a randomised controlled,double- blind dose-escalation trial.Lancet Respir Med,2019,7(9):757-770.doi:10. 1016/S2213-2600(19)30251-6.
[14]方刚,顾小燕,尹小芳.母牛分枝杆菌菌苗辅助抗结核方案治疗肺结核对患者免疫功能及疾病转归的影响.中国临床研究, 2020,33(4):501-504 doi:10. 13429/j.cnki.cjcr.2020.04.017 .
[15]Nell AS,D'Lom E,Bouic P,et al. Safety, tolerability ,and immunogenicity of the novel antituberculous vaccine RUTl:randomized,placebocontrolled phase Iclinical trial in patients with latent tuberculosis infection.PLoS One ,2014, 9:e89612.doi:10. 1371/journal. pone.0089612.
[16]Tait DR,Hatherill M,Van Der Meeren O,et al.Final Analysis of a Trial of M72/AS01EVaccine to Prevent Tuberculosis .NEngl J Med,2019,381(25):2429-2439.doi:10. 1056/NEJ-Moa1909953.
[17]Coppola M,van Meijgaarden KE,Franken KL ,et al.New genomewide algorithm identifies novel in-vivo expressed Mycobacterium tuberculosis antigens inducing human T-cell responses with classical and unconventional cytokine profiles Sci Rep,2016,6:37793. doi:10.1038/srep37793.
[18]李菲.结核潜伏抗原筛选与治疗性融合蛋白疫苗的制备. 兰州:兰州大学, 2016.
[19]寇- -鸣 .结核分枝杆菌新型疫苗的构建及免疫学评价.长春:吉林大学, 2018 .
[20]Darrah PA,Zeppa JJ,Maiello P,et al.Prevention of tuberculosis in macaques after intravenous BCG immunization.Nature,2020,577(7788):.95-102.doi:10.1038/s41586-019-1817-8.
[21]Fourie PB,Germishuizen WA,Wong YL,et al.Spray drying TB vaccines for pulmonary administration. Expert Opin Biol Ther,2008,8(7)-:857-863 doi:10.1517/14712598.8.7.857 .
[22]Manjaly Thomas ZR. Satti I,Marshall JL,et al.Alternate aerosol and systemic immunisation with a recombinant viral vector for tuberculosis ,MVA85A:a phase 1 randomised controlled trial.PLoS Med,2019, 16(4):e1002790.doi:10.1371/journal. pmed.1002790.
[23]Manjaly Thomas ZR,McShane H.Aerosol immunisation for TB:matching route of vaccination to route of infection.Trans R Soc Trop Med Hyg,2015,109(3):175-181.doi:10. 1093/trstm/tru206.
[24]徐菀佚,乔建斌,马波,等.冻融-冻干法制备的流感疫苗脂质体的细胞免疫研究.中国药科大学学报, 2015,46(6):730-733. doi: 10.1166/.issn.1000-5048201.50616 .
[25]赵祥月, 范宇超,谢青昕, 等.狂犬病疫苗脂质体冻干粉的免疫原性评价.中国生物制品学杂志, 2020,33(3):250-253.doi: 10.13200/j.cnki.cjb.003001.
[26]Aneesh T,Pall Tl,Signe TS,et al.Immunological and physical evaluation of the multistage tuberculosis subunit vaccine candidate H56/CAFO1formulated as a spray-dried powder.Vaccine, 2018,36(23)-:331-3339.doi:10.1016/j.vaccine .2018.04.055.
[27]Cosgrove CA, Castello-Branco LR,Hussell T,et al. Boosting of cellular immunity against Mycobacterium tuberculosis and modulation of skin cytokine responses in healthy human volunteers by Mycobacterium bovis BCG substrain Moreau Rio de Janeiro oral vaccine Infect Immun,2006,74(4):2449-2452 doi:10.1128/IA1.74. 4 2449-2452.2006.
[28]Hoft DF,Xia M,Zhang GL et al.PO and ID BCG vaccination in humans induce distinct mucosal and systemic immune responses and CD4(+)T cell transcriptomal molecular signatures. Mucosal Immunol,2018, 11(2):486-495. doi:10.1038/mi.2017.67 .
[29]Magalhaes I,Sizemore DR .Ahmed RK.et al.rBCG induces strong antigen-specific T cell responses in rhesus macaques in a prime-boost setting with anadenovirus 35tuberculosis vaccine vector.PLoS One ,2008,3(11):e3790 doi:10.1371/journal pone.0003790.
[30]Cai H,Yu DH,Hu XD,et al.A combined DNA vaccine prime, BCG-boost strategy results in better protection against Mycobacterium bovis challenge.DNA Cell Biol,2006,25(8)-.438-447 .doi:10.1089/dna 2006.25.438.
[31]Wang QM,Sun SH,Hu ZL,et al.Improved immunogenicity of a tuberculosis DNA vaccine encoding ESAT6 by DNApriming and protein boosting.Vaccine,2
004,22(27/28):3622-3627.doi:10. 1016/j.vaccine .2004.03.029.
[32]武亚琦。成人结核病预防策略的探索性研究。武汉:华中科技大学, 2019.doi:10.27157/d.cnki. ghzku.2019.005095.
[33]Andersen P, Smedegaard B. CD4(+)T-cell subsets that mediate immunological memory to Mycobacterium tuberculosis infection in mice .Infect Immun,2000,68(2):621-629.doi:10.1128/iai.68.2. 621-629.2000.
[34]Bai C,He J,Niu H,et al. Prolonged intervals during Mycobacterium tuberculosis subunit vaccine boosting contributes to eliciting immunity mediated by central memory-like T cells . Tuberculosis(Edinb),2018, 110:104-111. doi:10.1016/j. tube.2018.04.006 .
[35]Kaveh DA,Garcia-Pelayo MC ,Hogarth PJ.Persistent BCGbailli perpetuate CD4Teffector memory and optimal protection against tuberculosis .Vaccine,2014,32(51);:6911-6918.doi:10.1016/j.vaccine .2014. 10.041.





