既往研究发现缺氧与肿瘤进展之间存在相关性。在缺氧条件下,肿瘤细胞产生了适应性的代谢改变;并且肿瘤细胞缺氧和放疗抵抗之间存在直接关联。细胞应对缺氧会产生一系列基因表达的变化,缺氧诱导因子(hypoxia-induc?iblefactors,HIFs)在这一过程中起关键的作用。HIFs由 2个亚基构成,具有氧不稳定性的 α亚基(存在 3种亚型:HIF-1α、HIF-2α和 HIF-3α)和稳定的 β亚基(也称为 ARNT,芳烃受体核转位分子),破坏 α亚基和 β亚基会引发小鼠胚胎心血管发育异常,导致胚胎的死亡。肿瘤细胞的高速增殖和肿瘤血管生成的异常,造成了实体肿瘤中的缺氧状态,实体肿瘤中常发现高水平的 HIFα亚基的蓄积。在肾癌、大肠癌的基因突变中,观察到了 HIFα亚基的异常激活。近年的研究揭示了受 HIFs调节的基因作用于肿瘤发生发展的一些关键环节,例如肿瘤的增殖、血管生成、凋亡和自噬,细胞的侵袭和迁移等。更重要的是:临床研究发现 HIFα表达的增加与多种癌症的不良预后直接相关。翟晓辉等学者也注意到了缺氧可能在乳腺癌中具有重要意义。本研究以人乳腺癌细胞系为研究对象,研究缺氧及缺氧诱导因子 HIF-1α对乳腺癌细胞生物学行为的影响,并进一步探讨其作用机制。
1 材料与方法
1.1 材料与试剂
细胞系:人乳腺癌细胞系 MCF-7购自中国科学院细胞库。
主要试剂:重组慢病毒载体 Lentivirus-shRNAHIF-1α及 Lentivirus-NC合成购自上海吉玛制药技术有限公司,滴度均为1×108TU/ml;鼠单克隆抗人缺氧诱导因子1α(HIF-1α)(ab1,Abcam,美国);鼠单克隆抗人广谱细胞角蛋白(pan-cytokeratin)(ab6401,Abcam,美国);兔多克隆抗人 α平滑肌动蛋白(α-SMA)(ab82846,Abcam,美国);AlexaFlu?or? 594和 488驴抗兔 IgG和驴抗鼠 IgG荧光二抗(A-21207,A-21202,Invitrogen,美国);去铁胺试剂(desferriox?amine,DFO)(D-9533,sigma,美国);MTT试剂(Promega,美国);Matrigel基质胶(BectonDickinsonCompany,美国)。
1.2 仪器与设备
Transwell小室(Costar,美国);共聚焦显微镜专用细胞皿(Nest,美国);多通道共焦激光扫描显微镜(LeicaTCS-SP2,德国);倒置荧光生物显微镜 +数码照相系统(Olympus,日本);激光扫描图像分析系统(BIO-RAD,美国);酶标仪(SUNRISERC,瑞士);蛋白与核酸电泳转印装置(Bio-tech,美国)。
1.3 方法
1.3.1 诱导细胞缺氧 低氧诱导缺氧:待细胞生长至 70%融合时,将细胞培养液换成新鲜培养液,置于小型培养箱中,灌入定制的 1%O2、94%N2和 5%CO2混合气体,放入 37℃培养箱中培养实验所需的时间;化学药品诱导缺氧:待细胞生长至 70%融合时给予超纯水配制的 20mmol/L的铁离子螯合剂去铁胺贮存液(desferrioxamine,DFO)处理,调整 DFO浓度为 20μmol/L,鉴于去铁胺半衰期短,对处理组实施每天半量换液并加入相应的药量,放入 37℃培养箱中(21%O2、5%CO2)培养实验所需的时间;正常条件培养的细胞放置于37℃培养箱中(21%O2、5%CO2)培养实验所需的时间。
1.3.2 慢病毒转染 根据慢病毒试剂盒的操作手册,对人乳腺癌细胞系 MCF-7感染 Lentivirus-shRNAHIF-1α及Lentivirus-阴性对照,获得 HIF-1α正常表达的细胞系 MCF-7-NC及 HIF-1α表达受干扰的细胞系 MCF-7-HIF△。
具体步骤如下:将细胞接种于 24孔板中,感染前细胞换液,每孔细胞加入 450μl含 5μg/ml聚凝胺(polybrene)的新鲜培养基。病毒操作台中用 50μl新鲜培养基液分别稀释 Lenti?virus-shRNAHIF-1α及 Lentivirus-NC。加入病毒原液体积(μl)为细胞 MOI值(经预实验确定为8)×病毒滴度/每孔细胞数。稀释后的病毒液加入各孔。37℃病毒转染专用培养箱中培养 48小时后,换液继续培养 48小时。4天后,进行GFP荧光计数法检测转染效率。
1.3.3 Westernblot实验 转染 shRNAHIF-1α和阴性对照(NC)48小时后的细胞系分别正常、缺氧培养 48小时后,收集细胞,提取蛋白,考马斯亮蓝法测定蛋白浓度。取 50-100μg总蛋白上样,经 10%SDS-PAGE凝胶电泳分离蛋白后将蛋白电转移到硝酸纤维素膜(NC膜)上,封闭 1小时,加入一抗 4℃过夜。辣根过氧化酶标记的二抗室温作用 1小时。TBS液洗涤,待 NC膜稍干后,滴加适量的 ECL显色剂显影并上机扫描测灰度值。每组实验至少重复 3次。
1.3.4 共聚焦荧光染色 细胞接种于共聚焦专用培养皿中,密度 20%左右,给予诱导因素。各组细胞 10%多聚甲醛固定,封闭 2小时,1.5%Triton透膜处理。洗涤,加入一抗4℃过夜。洗涤,加入荧光二抗,室温,避光,1小时,AlexaFluor? 594浓度 1∶200;AlexaFluor? 488浓度 1∶200。洗涤,加入 DAPI1∶1000,室温,避光,10分钟,洗涤后上机检测。
1.3.5 MTT法测定细胞增殖能力 调整实验组、阴性对照组、空白对照组细胞密度为 1×105个/ml,按照每孔 100μl接种于 96孔板,每组设 4个复孔,置于细胞培养箱中缺氧或者常规培养,分别在第24、48小时后进行 MTT检测。每孔加入MTT溶液(5g/L)20μl,继续于 37℃孵育 4小时。吸出孔内培养液后,加入 DMSO液(180微升/孔),将培养板置于微孔板振荡器上振荡 10分钟,使结晶物溶解。在酶标仪上测定各孔的 A570nm值,以不加任何细胞的空白对照孔调零。实验重复 3次。以时间为横坐标,4个复孔的平均光吸收值为纵坐标,绘制生长曲线。
1.3.6 Transwell实验测定细胞侵袭能力 种入细胞前 20小时以 1∶3的比例配置 Matrigel胶,每孔 50μl铺 Transwell小室,37℃过夜凝固。取转染后 48小时的细胞,无血清培养基调整各组细胞密度为 25×104/ml,按照每孔 200μl接种于Transwell小室上室。下室加入 500μl含 10%血清的培养基,每组设 3个复孔,置于细胞培养箱中缺氧或者常规培养,在第 36小时终止侵袭。用 10%多聚甲醛固定 30分钟,棉签小心擦拭上室细胞及基质胶,用结晶紫染液染色 30分钟。在倒置显微镜下观察,随机选取 10个镜下视野(×40)采集图片,计数各视野内细胞数量,取平均值绘制柱形图。
1.4 统计分析应用 SPSS16.0统计软件对数据进行统计分析,对 3组间(正常培养、低氧培养和化学诱导缺氧)数据的差异进行ANOVA检验,P<0.05有统计学差异。
2 结果
2.1 慢病毒转染
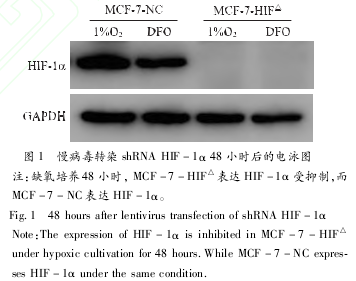
慢病毒感染细胞4天后应用 GFP荧光计数法检测 Lenti?virus-shRNAHIF-1α转染效率大于 80%。Westernblot方法检测感染 Lentivirus-shRNAHIF-1α48小时后的细胞系MCF-7-HIF△在诱导缺氧48小时后 HIF-1α的表达,见图1。慢病毒转染 shRNAHIF-1α后得到的细胞系 MCF-7-HIF△无论在低氧培养中还是化学药物诱导缺氧后,HIF-1α的表达都受到抑制。而对照组 MCF-7-NC细胞系在低氧培养和化学诱导缺氧后表达 HIF-1α。
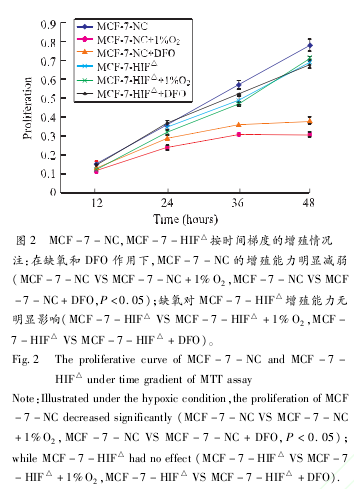
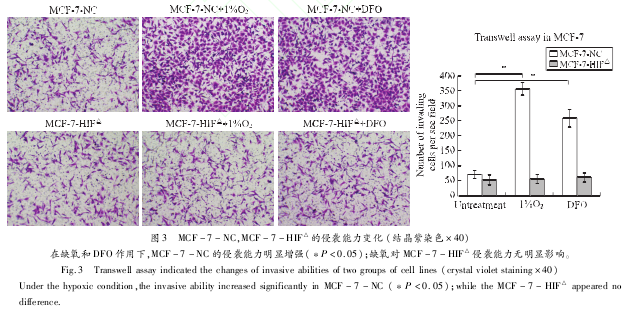
2.2 缺氧对乳腺癌细胞生长、侵袭能力的影响分析缺氧对乳腺癌细胞系生物学行为的影响:利用 MTT实验检测细胞的增殖能力。无论是低氧培养还是化学刺激模拟缺氧,相较正常培养的细胞系,MCF-7-NC增殖能力在缺氧诱导 12小时后开始明显减弱,其吸光值的差别具有统计学意义(P<0.05),而缺氧对 HIF-1α表达受抑制的MCF-7-HIF△增殖能力无明显影响。根据吸光值绘制生长曲线,见图 2。利用 Transwell实验检测细胞的侵袭能力。计数细胞,绘制表格后进行统计学分析,见图 3。两组细胞系的实验结果显示:诱导缺氧 48小时后正常表达 HIF-1α的MCF-7-NC的侵袭能力明显增强,表现为通过上室的细胞数显着增多,其差别具有统计学意义(P<0.05),缺氧对 HIF-1α表达受抑制的 MCF-7-HIF△侵袭能力无明显影响。
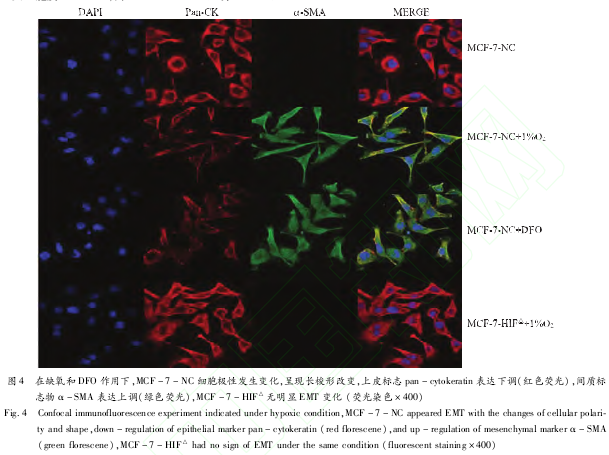
2.3 缺氧可诱导乳腺癌细胞发生上皮 -间质转化(epitheli?al-mesenchymaltransition,EMT)低氧培养及化学药物去铁胺(DFO)诱导缺氧 48小时以后,正常表达 HIF-1α的 MCF-7-NC可发生 EMT,下调上皮标志物、上调间质标志物;而 HIF-1α表达受抑制的 MCF-7-HIF△无明显 EMT改变。共聚焦荧光染色显示:在低氧培养和化学药物去铁胺的作用下,MCF-7-NC细胞极性发生变化,呈长梭形改变,上皮标志物人广谱细胞角蛋白(pan-cytokeratin,Pan-CK)表达下调(红色荧光),间质标志物人 α平滑肌动蛋白(α-SMA)表达上调(绿色荧光);MCF-7-HIF△无明显 EMT变化,见图 4。
3 讨论
本研究对低氧培养和化学药物诱导缺氧状态下,体外培养的乳腺癌细胞系 MCF-7的增殖能力、侵袭能力作了系统的研究。研究发现:无论是低氧培养还是化学药物诱导的缺氧状态对乳腺癌细胞的生长有明显的影响。在缺氧培养组中,乳腺癌细胞的增殖速度较正常培养的细胞明显降低,而通过慢病毒转染 shRNAHIF-1α干扰 HIF-1α的表达后,缺氧情况下的细胞与未缺氧的对照组细胞相比,其细胞增殖速度则无明显改变,这说明 HIF-1α的表达对缺氧状态下乳腺癌细胞的增殖能力有重要的调控作用。在缺氧对乳腺癌细胞侵袭能力影响的研究中,我们得到了相似的结果:在缺氧培养组中,乳腺癌细胞的侵袭能力明显增强,而干扰 HIF-1α的表达后,缺氧的细胞与未缺氧的对照组细胞相比,其侵袭能力无明显改变,这说明了 HIF-1α的表达对缺氧状态下乳腺癌细胞的侵袭能力有重要的调控作用。综合上述结果,缺氧可对乳腺癌细胞的生物学行为产生重要影响。尤其是增加了乳腺癌细胞迁移、侵袭的能力,这一影响是通过HIF-1α这一亚基的正常作用来实现的。干扰 HIF-1α的表达,则缺氧对乳腺癌细胞生长、迁移、侵袭能力的影响消失。
目前研究发现上皮 -间质转化(epithelial-mesenchymaltransition,EMT)在肿瘤的侵袭和转移中起到非常关键的作用,在这一过程中,细胞失去了上皮细胞间的连接,获得了间皮细胞的特征和移动性,其耐药性、抗凋亡能力亦增加。缺氧和 HIFs可以影响 EMT调节因子的表达并促进转移的发生,研究显示:在肾癌中,HIF-1α的表达导致 E-钙粘素的缺失并增加转移;在头颈部鳞状上皮细胞癌中,HIF-1α直接调节 EMT重要的转录因子 TWIST1,增加肿瘤的侵袭和转移。在前列腺癌中。HIF-1α通过 VEGF介导的方式,促进 SNAIL1的核蓄积。总之,肿瘤通过缺氧及缺氧诱导因子(HIFs)可以激活多个 HIFs相关基因,共同作用于侵袭、进入和移出血管、定植生长等肿瘤播散的各个阶段。我们研究发现,乳腺癌细胞缺氧培养 48小时后,正常表达 HIF-1α的MCF-7-NC可发生 EMT,下调上皮标志物、上调间质标志物;干扰了 HIF-1α表达的 MCF-7-HIF△则无明显 EMT改变。通过共聚焦荧光实验得到验证:在缺氧和 DFO作用下,MCF-7-NC细胞极性发生变化,呈长梭形改变,上皮标志物 pan-cytocaretin表达下调,间质标志物 α-SMA表达上调,证实细胞发生了 EMT;而 MCF-7-HIF△无明显 EMT变化。以上实验说明,缺氧引起 HIF-1α表达上调,进而导致乳腺癌细胞侵袭移动能力增强是通过诱导细胞发生 EMT来实现的。而 HIF-1α是如何引起 EMT的具体分子作用机制,还需要进一步基础研究来探明。
在体外条件下,诱导乳腺癌细胞系 MCF-7缺氧可以降低细胞的增殖能力,增加其侵袭、移动能力。干扰 HIF-1α的表达后,细胞系对缺氧的刺激无上述应答。缺氧可以诱导乳腺癌细胞 MCF-7发生 EMT;而干扰HIF-1α的表达后,缺氧无法诱导细胞发生 EMT。说明缺氧对乳腺癌细胞系 MCF-7生物学行为的影响是通过 HIF-1α介导来实现的。
【参考文献】.
[1] BertoutJA,PatelSA,SimonMC.TheimpactofO2availabilityonhumancancer[J].NatRevCancer,2008,8:967-975.
[2] WangGL,SemenzaGL.Purificationandcharacterizationofhypoxia-induciblefactor1[J].JBiolChem,1995,270:1230-1237.
[3] RyanHE,LoJ,JohnsonRS.HIF-1alphaisrequiredforsolidtumorformaionandembronicvasculariztion[J].EmnoJ,1998,17:3005-3015.
[4] IyerNV,KorchLE,AganiF,etal.Cellularanddevelopmentalcon?trolofO2homeostasisbyhypoxia-induciblefactor1alpha[J].GenesDev,1998,12:149-162.
[5] MaltepeE,SchmidtJV,BaunochD,etal.AbnormalangiogenesisandresponsestoglucoseandoxygendeprivationinmicelackingtheproteinARNT[J].Nature,1997,386:403-407.
[6] PengJ,ZhangL,DrysdaleL,etal.ThetranscriptionfactorEPAS-1/hypoxia-induciblefactor2alphaplaysanimportantroleinvas?cularremodeling[J].ProcNatlAcadSciUSA,2000,97:8386-8391.
[7] CompernolleV,BrusselmansK,AckerT,etal.LossofHIF-2al?phaandinhibitionofVEGFimpairfetallungmaturation,whereastreatmentwithVEGFpreventsfatalrespiratorydistressinprematuremice[J].NatMed,2002,8:702-710.
[8] KaelinWG.ThevonHippel-Lindautumorsuppressorprotein:O2sensingandcancer[J].NatRevCancer,2008,8:865-873.
[9] HuangX,DingL,BennewithKL,etal.Hypoxia-induciblemiR-210regulatesnormoxicgeneexpressioninvolvedintumorinitiation[J].MolCell,2009,35:856-867.
[10] SemenzaG.EvaluationofHIF-1inhibitorsasanticanceragents[J].DrugDiscovToday,2007,12:853-859.
[11] 翟晓辉,郭佑民.乳腺癌的乏氧研究进展[J].现代肿瘤医学,2012,20(7):1464-1467