缺氧是实体瘤生长微环境的显着特征。肿瘤细胞在缺氧环境下发生一系列适应性变化,而缺氧诱导因子是缺氧条件下哺乳动物对缺氧反应的主要调节因子。Semenza 等于 1992 年在缺氧诱导的细胞核抽提物中发现了氧敏 α 亚基(HIF-1α)和表核β 亚基(HIF-1β),其中 HIF-1α 是主要的活性单位。缺氧时,HIF-1α 表达增加并移入核内与 HIF-1β 结合,形成有活性的异二聚体 HIF-1,与靶基因的启动子或增强子内的一个或多个缺氧反应元件(hypoxia response element,HRE)结合,促进肿瘤 血 管 系 生 成 和 肿 瘤 细 胞 的 增 殖 。生存素是目前公认的癌基因,文献报道缺氧时 HRE 与生存素启动子结合,导致生存素的表达增加。研究发现缺氧诱导的生存素表达依赖和非依赖 HIF-1α 途径。本研究前期实验证实,非小细胞肺癌(NSCLC)组织中生存素蛋白和 HIF-1α 蛋白高表达且两者表达呈正相关,靶向 HIF-1α 的短发夹 RNA(short hairpin RNA,shRNA)可明显下调生存素表达。本研究通过凝胶电泳迁移率实验(EMSA)验证人腺癌细胞株A549中HIF-1α是否与生存素启动子上潜在位点相结合,证实 HIF-1α 结合位点的存在;miRNA 干扰技术沉默 HIF-1α 的表达,进一步论证其对生存素的影响及对 A549 细胞株生物学特性的影响,为肺癌的发病机制提供实验依据。
材料与方法
1. 主要试剂与材料:A549 细胞购自上海中科院细胞库;EMSA 试剂盒(美国 Promega 公司,批号:237021);放射性 P 标记的 ATP(γ-32P[ATP])购自北京市福瑞生物工程公司;G25 葡聚糖凝胶购自上海医药工业研究院;核蛋白提取试剂盒(美国Thermo 公司,批号:78833);鼠抗人生存素抗体(美国 Santa Cruz 公司,批号:SC374616),兔抗人 HIF-1α 抗体(北京博奥森生物公司,批号:bs-0737R),辣根过氧化物酶标记的羊抗兔 IgG(北京中杉金桥生物公司,批号:83228)﹑兔抗鼠 IgG(美国 Santa Cruz 公司,批号:sc66931);总 RNA提取试剂盒(德国 Qiagen 公司,批号:74104);逆转录试剂盒(美国 Promega 公司,批号:253082),PCR 扩增试剂盒(加拿大 MBI Fermentas 公司,批号:K1621);生存素探针、所有的引物由上海生工合成;F-12 培养基和胎牛血清(美国 Hyclone 公司,批号 F03039);六水氯化钴(CoCl2,上海国药公司);Transwell 小室(美国 Corning 公司);Annexin-V APC 和 PI(美国 eBioscience 公司);CCK-8(细胞计数试剂盒)(碧云天生物技术研究所);杀稻瘟菌素(blasticidin),含有 pcDNA6.2-GW/EmGFP 针对 HIF-1α(基因号 NM001530)的miRNA 4 组干扰质粒及阴性对照组、含有内参的miRNA 质粒,Lipofectamine(脂质体)TM2000 转染试剂盒(美国 Invitrogen 公司,批号 11668-019)。
2. 细胞培养及乏氧的处理:A549 细胞以含10%胎牛血清的 F-12 培养液,于 37 ℃、5% CO2培 养 箱 中 常 规 培 养 。 将 化 学 缺 氧 剂 CoCl2150 μmol/ml 加入培养液中,模拟肿瘤内部的缺氧微环境。
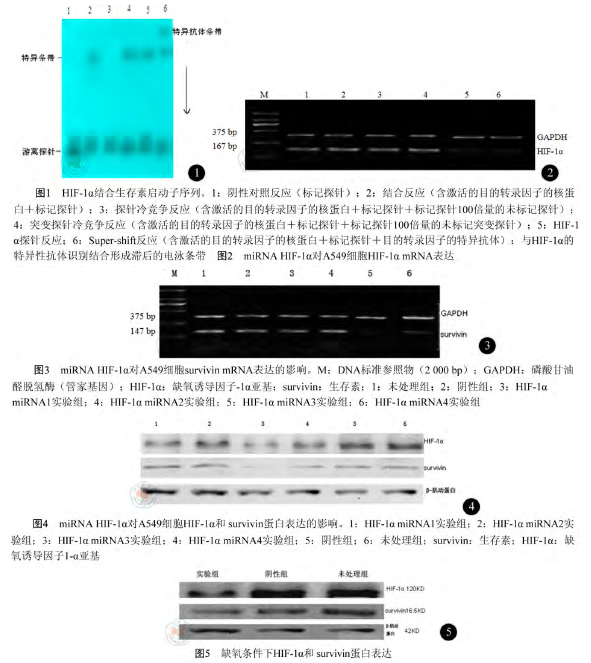
3. EMSA 检测生存素核心启动子区上的HIF-1α 位点:按照核蛋白提取试剂盒说明书提取A549 细胞中核蛋白并定量。用 γ-32P 标记探针合成双链后纯化,EMSA 电泳,室温下显影、定影。实验分组如下:阴性对照反应(只有标记好的探针)、结合反应(含有核蛋白和标记好的探针)、探针冷竞争反应(含有核蛋白、未标记的探针和标记好的探针)、突变探针的冷竞争反应(含有核蛋白、未标记的突变探针和标记好的探针)和超迁移(Super-shift)反应(含有核蛋白、目的蛋白特异抗体和标记好的探针)。各探针如下:探针1:生存素启动子(-26~-9 bp)上链序列 5'-GAGGGCGTGCGCTCCCGA-3',下链序列 3'-CTCCCGCACGCGAGGGCT-5',探针 2:生存素启动子(-144~-127 bp)上链序列 5'-GTCGCTGGGTGCACCGCG-3',下链序列 3'-CAGCGACCCACGTGGCGC-5',探针 1 突变的序列:上链序列 5'-GAGGGCAGCGCTCCCGA-3' , 下 链 序 列 3'-CTCCCGTCGCGAGGGCT-5',探针 2 突变的序列:上链序列5'-GTCGCTGGAGCACCGCG-3' , 下 链 序 列3'-CAGCGACCTCGTGGCGC-5',HIF-1α 通用双链寡聚核苷酸序列(EMSA 试剂盒提供):上链序列 5'-TCTGTACGTGACCACACTCACCTC-3',下链序列 3'-AGACATGCACTGGTGTGAGTGGAG-5'。
4. HIF-1α 稳定沉默 A549 细胞的建立:转染前1 d 取对数生长期的 A549 细胞接种于 6 孔板中,每孔加入 2 ml 含 2×105个细胞但不含抗生素的培养液,转染时细胞的融合度达到 90%~95%。实验分组:未处理组、miRNA1~4 转染组及 miRNA 阴性、β-肌动蛋白 miRNA 对照组。转染实验步骤按照Lipofectinamine(脂质体)TM2000 说明书进行,质粒(μg)∶脂质体(μl)=1∶1,经blasticidin10μg/ml,3~4 周筛选后挑出单克隆细胞扩大培养。
5. RT-PCR 检测 HIF-1α、生存素的 mRNA 表达:转染后各组细胞按照德国 Qiagen 公司 RNA 提取试剂盒说明书提取总 RNA,然后按 RT-PCR 试剂盒说明将 RNA 逆转录为 cDNA,以此为模板进行 PCR。RT-PCR 引物序列、扩增长度及反应条件分别如下:HIF-1α 上游引物: 5'-AGCCAGACGATCATGCAGCTACTA3',下游:5'-TGTGGTAATCCACTTTCATCCATTG-3',产物长度 167 bp。PCR 三步反应:94 ℃、30 s,59.2 ℃、30 s,72 ℃、30 s,35 个循环;生存素上游引物 5'-AGGTCATCTCGGCTGTTCCTG-3',下游引物 5'-TCATCCTCACTGCGGCTGTC-3',产物长度 147 bp;94 ℃、30 s,63.9 ℃、30 s,72 ℃、30 s;30 个循环,内参 GAPDH 上游引物:5'-GGGAAGGTGAAGGTCGGAGTC-3',下游引物:5'-AGCAGAGGGGGCAGAGATGAT-3',长度 375 bp;95 ℃、30 s,63 ℃、45 s,72 ℃、60 s,30 个循环。美国伯乐 Bio-Rad 凝胶成像仪下观察结果并拍照分析。
6. Western blot 检测 HIF-1α 和生存素蛋白的表达 : 提 取 各 组 细 胞 的 核 蛋 白 , 二 喹 啉 甲 酸(Bicinchonininc acid,BCA)法测定蛋白浓度,每组样本各取蛋白 60 μg,聚丙烯酰胺凝胶电泳分离蛋白,湿转法将蛋白转到聚偏二氟乙烯膜上,经 5%脱脂奶粉封闭 1 h(室温)后,分别加入一抗兔抗人HIF-1α(1∶300)、鼠抗人生存素抗体(1∶200),4 ℃过夜,加入辣根过氧化物酶标记的二抗(1∶10 000)室温孵育 1 h,化学发光法显色,以 β-肌动蛋白(工作浓度 1∶500)为内参照。用 Quantity One 软件分析条带的吸光度。
7. 细胞增殖检测:经 RT-PCR 及 Western blot筛选出干扰效果最佳的 HIF-1α-miRNA 细胞,将HIF-1α miRNA、HIF-1α 阴性及未处理的 A549 各组细胞接种 2×103/孔于 96 孔板,每组设 6 个复孔,分别在 5% CO2培养箱中常规培养及加入 CoCl2150 μmol/ml 模拟缺氧培养 24 h、48 h 及 72 h,每孔加入 10 μl CCK8 37 ℃孵育 1 h,在酶标仪上 450 nm处测定各孔吸光度值。
8. 细胞凋亡检测:各组细胞 2×105/ml 接种于6 孔板,在 5% CO2培养箱中和加入CoCl2150 μmol/ml分别培养24 h﹑48 h及72 h后收集细胞,1 500 r/min离心 3 min,离心半径 100 mm,PBS 洗涤 2 次,用1×Binding Buffer(结合缓冲液)195 μl 重悬细胞,加入 Annexin-V APC(Ca2+依赖性磷脂结合蛋白)及碘化丙啶(PI)各 5 μl,4 ℃避光室温孵育 15 min,流式细胞仪检测,Cell Quest 软件分析。
9. 细胞的迁移力:取处于对数生长的各组A549 细胞消化、离心和计数,用无血清的 F-12 培养液调整细胞密度为 5×105/ml。在 Transwell 小室下层均加入 500 μl F-12 培养液(含 10% FBS),小室上层常氧组加入 100 μl 细胞悬液,缺氧组上层加入含 CoCl2150 μmol/L 的 100 μl 细胞悬液,每组细胞 3 个复孔,重复 3 次。放置在 37 ℃,5% CO2培养箱中培养 24 h 后取出,用棉签轻轻擦去膜上层的细胞,膜下层用甲醇固定 30 min,Giemsa(吉姆萨)染色 10 min,PBS 冲洗 2 遍,倒置显微镜下选取 10个视野(×400)进行细胞计数。
10. 统计学分析:采用 SPSS 16.0 统计学软件,计量资料以均数±标准差( x s)表示,组间比较采用单因素方差分析和 t 检验,两两比较采用 q检验,P<0.05 为差异有统计学意义。
结 果
1. EMSA 验证 HIF-1α 与生存素结合位点:生存素启动子序列-26~-9 bp 为探针与核蛋白作用,自显影后出现 DNA-核蛋白复合物滞后条带,此条带可被未标记的探针竞争消除;用含有 HIF-1α的通用识别 DNA 片段为探针时,产生了与生存素启动子序列-26~-9 bp 为探针时相近的 DNA-核蛋白复合物。表明 HIF-1α 与生存素启动子序列-26~-9 bp 结合,生存素启动子上-19~-16 bp位点是 HIF-1α 的结合位点(图 1)。
2. 稳转细胞的鉴定: A549 细胞分别转染HIF-1α miRNA1~4,miRNA-阴性、miRNA-β-肌动蛋白对照质粒,挑取细胞单克隆进行扩增培养后在荧光显微镜下可见绿色荧光(GFP),表明真核重组质粒稳转成功。
3. 筛选 HIF-1α miRNA 载体:转染 HIF-1αmiRNA3、4 实验组(0.313±0.051,0.415±0.051)的 A549 细胞 HIF-1α mRNA 的表达低于未处理组(1.042±0.036)和阴性对照组(1.030±0.004),差异有统计学意义(F=436.433,P<0.0.5),因此选择转染 HIF-1α miRNA-3 的细胞株作为后续增殖、凋亡和迁移的实验组,同时检测干扰 HIF-1α后生存素 mRNA 的表达,发现生存素 mRNA 也相应降低,以 miRNA3(mRNA 吸光度值为 0.060±0.008)效果最佳,差异具有统计学意义(F=0.002,P<0.01)(图 2,3)。用 Western blot 法检测 A549细胞中的 HIF-1α 和生存素蛋白水平变化,显示HIF-1α miRNA3 组的 HIF-1α(0.559±0.051)和生存素蛋白(0.051±0.003)表达明显低于未处理组(1.452±0.146 和 0.194±0.007)和 miRNA 阴性组(1.249±0.012 和 0.173±0.005),差异有统计学意义(F=53.525,331.646,P<0.05)(图 4)。
4. HIF-1α miRNA 在缺氧条件下的表达:HIF-1α 沉默组 HIF-1α(0.604±0.040)和生存素mRNA(0.394±0.018)表达明显减低,各组和常氧条件下相比,HIF-1α 和生存素 mRNA 表达明显增高,差异有统计学意义(t 值分别为 7.809,-28.936,P<0.01)。Quantity One 定量分析 HIF-1α 沉默组HIF-1α 和生存素蛋白表达明显低于常氧条件下,且各组的蛋白水平明显高于常氧(t 值分别为 13.523和-14.202),差异有统计学意义(P<0.01)(图 5)。
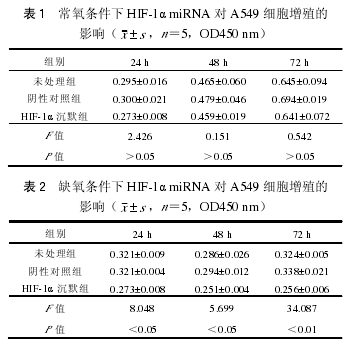
5. HIF-1α miRNA 对细胞增殖、凋亡和迁移的影响:(1)常氧和缺氧条件下 HIF-1α miRNA 对A549 细胞增殖的影响:HIF-1α 沉默组与未处理组、阴性对照组比较,A549 细胞生长受到抑制,但差异没有统计学意义(F=2.426,0.151,0.542,P>0.05)。缺氧 24 h 后 HIF-1α 沉默组与各组比较,细胞生长明显受到抑制,差异具有统计学意义(F=8.048,5.699,34.087,P 均<0.05),而对照组间无统计学意义(表 1,2)。
(2)常氧和缺氧条件下 HIF-1α miRNA 对 A549细胞凋亡的影响:常氧条件下 HIF-1α 沉默组平均凋亡率 46.2%(这是通过流式细胞仪软件测每个门内的比率,指的是细胞计数百分比)与各对照组比较(未处理组 44.6%,阴性组 44.3%),无统计学差异(F=2.009,P>0.05);模拟缺氧培养 48 h后实验组平均凋亡率为 62.2%,与各对照组比较凋亡明显增加,差异具有统计学意义(F=26.359,P<0.01),而未处理组平均凋亡率为 51.4%,阴性组平均凋亡率为 54.5%,两两比较差异没有统计学意义(t=-0.077,P>0.05)。
(3)常氧和缺氧条件下 HIF-1α miRNA 对 A549细胞迁移力的变化:常氧和缺氧条件下干扰 HIF-1α后细胞迁移数明显减少,分别为 30±6(F=21.924,P<0.05)和 75±4(F=170.827,P<0.01),和对照组(121±17)比较差异有统计学意义,且缺氧状态下细胞的迁移数明显多于常氧状态下的细胞数(t=-2.988,P<0.01)。
讨 论
肺癌是当今全球发病率最高的恶性肿瘤,病死率居癌症首位,70%~80%的肺癌患者确诊时已属于晚期,5 年生存率仅有 16%。因而阐明肺癌中高表达且特异性强的异常基因的功能及相应的调控机制,揭示肺癌发病机制,寻求新的治疗措施成为肿瘤学家的共识。
缺氧 是 实体瘤中普遍存在的现象,也是肺 癌等实体瘤生长微环境的显着特征。在这种实体瘤适应缺氧的转录调节中,HIF-1α 起着重要作用,它通过调节一系列基因来维持氧和营养的供给,促进肿瘤的生存和生长。文献报道,在乳腺癌和直肠癌细胞中 HIF-1α 和生存素有很强的相关性,我们前期也证实在NSCLC中HIF-1α对生存素表达存在上调作用且具有肿瘤特异性。
生存素是凋亡抑制蛋白(inhibitor of apoptosisproteins)家族的成员之一,除了抑制凋亡和保护细胞的存活外,亦参与血管形成,甚至对肿瘤的浸润、转移和耐药也有作用。许多癌症患者体内生存素水平升高决定了其对放化疗反应的不敏感及预后不良,都与缺氧有关。缺氧下肿瘤特异性的生存素表达增加,和生存素启动子的缺氧反应原件(HREs)结合导致生存素进一步增加。Peng 等报道乳腺癌中 survivin 通过 HIF-1α 上调 EGF 处理的癌细胞而过表达 ;转染 HIF-1α 小干扰 RNA(siRNA)至直肠癌 LS174T 细胞后,抑制 HIF-1α 后导致生存素的表达下降,显示 HIF-1α 对生存素表达可能有调节作用。本研究通过 EMSA 证实生存素启动子-19~-16 bp 区存在 HIF-1α 结合位点,并证实HIF-1α 对生存素启动子具有正向调控作用。
miRNA 不仅具有调节细胞增生、分化和活性的功能,还参与生命过程中一系列重要进程。相对于 siRNA 而言,miRNA 在转录后沉默基因的表达更强。为进一步探明 HIF-1α 对生存素的转录调控机制,用 miRNA 抑制 HIF-1α 的表达,观察对生存素转录和翻译的影响。结果显示,在常氧和缺氧条件下,生存素的转录和蛋白水平的表达均明显减低,进一步证实 HIF-1α 在转录水平调控生存素,生存素可能是 HIF-1α 下游的靶基因。抑制 HIF-1α表达,细胞在 CoCl2(氯化钴)模拟缺氧处理后,生长受到抑制,且出现凋亡;而在常氧下未出现这种现象。尽管在抑制 HIF-1α 的乳腺癌细胞小鼠移植瘤模型中,移植瘤生长明显减慢;本研究结果显示,仅在缺氧条件下沉默 HIF-1α 才能抑制细胞增殖,促使细胞凋亡,可能是体外和体内肿瘤细胞生长微环境不同。在迁移实验中,用 miRNA 沉默 HIF-1α 后,无论在常氧还是缺氧条件下,肿瘤细胞的迁移明显受到抑制,这与增殖和凋亡结果不同,且在缺氧状态下迁移细胞数更多。在乳腺癌中上调 HIF-1α 信号通路伴随着微转移灶的分子信号上调,Krishanlnachary 等利用 HIF-1α 特异的siRNA 抑制人结肠癌细胞相关基因表达,降低由于缺氧和 HIF-1α 过表达导致的肿瘤细胞侵袭转移能力。最近报道 HIF-1α 可促进肿瘤细胞的迁移,牡荆黄素(一种 HIF-1α 抑制剂)可以显着抑制大鼠嗜铬细胞瘤 PC12 细胞的迁移。我们的结果与这些相关报道相吻合,表明 HIF-1α 在肿瘤细胞的迁移中起着核心作用,它过表达促进癌细胞的转移,与其增强肿瘤细胞游走能力有关,但与缺氧关联不大。推测活化细胞迁移的相关基因是通过依赖HIF-1α 的机制。这一切是否与生存素关联,并与肺癌易于早期出现局部浸润和远处转移有关,尚待进一步研究。
参 考 文 献
[1] Semenza GL, Wang GL. A nuclear factor induced by hypoxia via denovo protein synthesis binds to the human erythropoietin geneenhancer at a site required for transcriptional activation[J]. Mol CellBiol, 1992, 12(12): 5447-5454.
[2] Comerford KM, Wallace TJ, Karhausen J, et al. Hypoxia-induciblefactor-1-dependent regulation of the multi-drug resistance (MDR1)gene[J]. Cancer Res, 2002, 62(12): 3387-3394.
[3] Yang L, Cao Z, Li F, et al. Tumor specific gene expression using thesurvivin promoter is further increased by hypoxia[J]. Gene Ther,2004, 11(15): 1215-1223.
[4] Mesri M, Morales-Ruiz M, Ackermann EJ, et al. Suppression ofvascular endothelial growth factor-mediated endothelial cellprotection by survivin targeting[J]. Am J Pathol, 2001, 158(5):1757-1765.
[5] Conway EM, Zwerts F, Van Eygen V, et al. Survivin-dependentangiogenesis in ischemic brain: molecular mechanisms of hypoxia-induced up-regulation[J]. Am J Pathol, 2003, 163(3): 935-946.
[6] Chen YQ, Zhao CL, Li W. Effect of hypoxia-inducible factor-1α ontranscription of survivin in non-small cell lung cancer[J]. J Exp ClinCancer Res, 2009, 28:29.
[7] Jemal A, Siegel R, Ward E, et al. Cancer Statistics, 2009[J]. CACancer J Clin, 2009, 59(4): 225-249.
[8] Peng XH, Karna P, Cao Z, et al. Cross-talk between epidermalgrowth factor receptor and hypoxia- inducible factor-1a signalpathways increases resistance to apoptosis by up-regulating survivingene expression[J]. J Biol Chem, 2006, 281(36): 25903-25914.
[9] Fan LF, Dong WG, Jiang CQ, et al. Role of hypoxia-induciblefactor-1α and survivin in colorectal carcinoma progression[J]. Int JColorectal Dis, 2008, 23(11): 1057-1064.
[10] Woelfle U, Cloos J, Sauter G, et al. Molecular signature associatedwith bone marrow micrometastasis in human breast cancer[J]. CancerRes, 2003, 63(180): 5679-5684.
[11] Yang L, Cao Z, Li F, et al. Tumor specific gene expression using thesurvivin promoter is further increased by hypoxia[J]. Gene Ther,2004, 11(15): 1215-1223.
[12] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, andfunction[J]. Cell, 2004, 116(2):281-297.
[13] Grimson A, Farth KK, Johnston WK, et al. MicroRNA targetingspecificity in mammals: determinants beyond seed pairing[J]. MolCell, 2007, 27(1): 91-105.
[14] Liao D, Corle C, Seagroves TN, et al. Hypoxia-inducible factor-1α isa key regulator of metastasis in a transgenic model of cancer initiationand progression[J]. Cancer Res, 2007, 67(2): 563-572.
[15] Krishnamaehary B, Berg-Dixon S, Kelly B, et al. Regulation of coloncarcinoma cell invasion by hypoxia- inducible factor l[J]. Cancer Res,2003, 63(5): 1138-1143.
[16] Choi HJ, Eun JS, Kim BG, et al. Vitexin, an HIF-1alpha inhibitor, hasanti-metastatic potential in PC12 cells[J]. Mol Cells, 2006, 22(3):291-299.
[17] Kim SH, Xia D, Kim SW, et al. Human enhancer of filamentation 1is a mediator of hypoxia-inducible factor-1alpha-mediated migrationin colorectal carcinoma cells[J]. Cancer Res, 2010, 70(10):4054-4063.