小细胞肺癌(small cell lung cancer, SCLC)占肺癌的 15%~18%,2/3 以上的患者在诊断时已有远处转移(T0-4N0-3M1),诊断后如果不积极治疗控制病情,患者疾病进展迅速,中位生存期仅 2~4 个月.远处转移是 SCLC 重要的恶性标志和特征,也是治疗失败和复发的主要因素之一,因此确定与SCLC 转移相关的基因,早期对 SCLC 患者预后进行合理判定,对进行个体化治疗和更为密切的随访具有重要意义。近年来随着分子生物学的研究,发现了一类与肿瘤转移相关的基因,目前已经证实Nm23 基因家族对肿瘤的发生、发展及转移具有明确的相关性,其中该家族成员 Nm23-H1 被认为具有抑制肿瘤细胞侵蚀和转移的作用.不同病理类型的恶性肿瘤中的 Nm23-H1 表达水平有差异,在大多数实体瘤中 nm23-H1 低表达表现出更易于远处转移,为预后不良的标志;而在神经母细胞瘤中和淋巴瘤中却相反,Nm23-H1 高表达者促进肿瘤增殖、浸润和远处转移,表现出较差的预后.而对 SCLC中 Nm23-H1 的表达情况及其与预后的关系目前尚不清楚,缺乏相关定论。本实验通过免疫组化方法检测 Nm23-H1 在 SCLC 中的表达情况,探讨Nm23-H1 的表达与 SCLC 患者预后的关系,为今后进一步研究 SCLC,制定合理的个体化治疗方案,提供进一步理论依据。
1 材料与方法
1.1 研究对象
收集 2003 年 2 月至 2008 年 10 月我院经活检或手术切除病理确诊、临床随访资料完整的初诊 SCLC 患者共 71 例(男性 63 例,女性 8 例),年龄 23~85 岁,中位年龄 58 岁。随访时间 2~7 年。根据 1973 年美国退伍军人医院制定的分期标准,局限期 48 例,广泛期 23 例,其中 30 例患者进行单纯化疗(化疗周期 2~8 个周期,平均 4 周期),41 例患者行放化疗综合治疗.收集 71 例患者放化疗前癌组织石蜡标本,22 例正常肺组织石蜡标本(与癌组织至少 5 cm 以上)作为对照。
1.2 免疫组化染色
所有病理组织石蜡标本连续切片,采用 SP 法进行免疫组化检测评估其蛋白表达。兔抗人 Nm23-H1 多克隆抗体购自 Santa Cruz 公司,为原液,使用时按 1:750 比例稀释。二抗购自北京西雅金桥生物技术有限公司,P0-7000 通用型一步超敏检测试剂盒(适用于检测兔/鼠来源的一抗)。所有标本切片后 60℃烘烤 4 小时,经脱蜡、水合后以 10%双氧水封闭,按照所需修复要求以枸橼酸钠(pH6.0)修复抗原,一抗 4℃孵育过夜,二抗 37℃孵育 25 min,DAB 显色,苏木素复染,盐酸酒精脱色,饱和碳酸锂镧化后脱水、中性树胶封片。用 PBS 液代替一抗作阴性对照,用已知人胰腺组织的切片作阳性对照。
1.3 结果判定
蛋白表达水平的评估以细胞染色程度与内部对照细胞(及淋巴细胞及间质细胞)进行比较,分为少量表达、弱到中等强度表达及强表达,再根据阳性肿瘤细胞数目所占百分比,将其表达水平由 0 到 3+共分为 4 个等级,在肿瘤细胞中没有表达为 0,在少于 10%的肿瘤细胞中有少量表达为+;在超过 10%肿瘤细胞中细胞核有弱到中等强度表达为++;在超过 10%肿瘤细胞中整个核强表达则定为+++.++~+++定义为阳性即高表达组,0~+定义为阴性即低表达组。
1.4 统计学处理
采用 SPSS 19.0 统计软件进行分析。Nm23-1 在 SCLC 于正常肺组织中的表达和亚细胞定位采用χ2检验,Nm23 表达及亚细胞定位与临床分期的关系采用χ2检验及多因素向前逐步 Logistic 回归计算;采用单变量 Kaplan-Meier 生存分析及多因素 COX 风险比例回归分析 Nm23-1 蛋白表达与亚细胞定位与 SCLC 患者预后的关系。所有检验为双侧检验。
2 结果
2.1 Nm23-H1 蛋白表达
本次研究总共收入患者 71 例,年龄范围为 23~85 岁。其中约 88.7%为男性,67.6%的研究对象处于局限期。
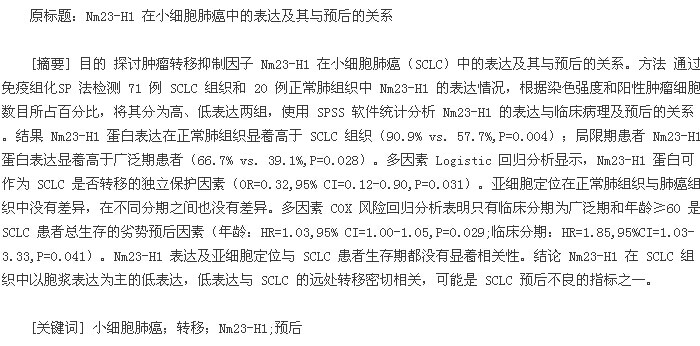
Nm23-H1 蛋白表达见图 1,57.7%的患者 Nm23-H1 表达阳性,且多为胞浆表达,仅 5.6%的患者为核浆共表达,没有观察到单独核表达(表 1)。Nm23-H1 蛋白的表达在正常肺组织中显着高于 SCLC 组织(90.9% vs 57.7%,P=0.004)。在正常肺组织及 SCLC 组织中的亚细胞定位基本一致,均多为浆表达,二者之间没有统计学差异(P=0.349,表 1)。【表1】【图1】
2.2 Nm23-H1 表达与临床病理的关系
Nm23-H1 蛋白的表达及亚细胞定位情况与临床分期的关系见表 2.【表2】
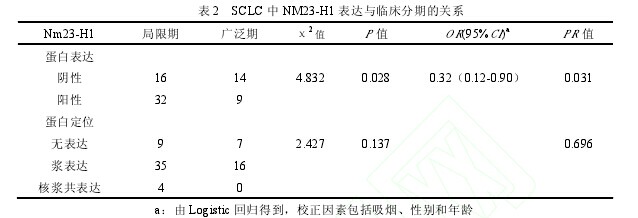
Nm23-H1 表达在局限期明显高于广泛期(66.7%vs 39.1%,P=0.028)。亚细胞定位在不同分期之间没有统计学差异。多因素 Logistic 回归分析发现,Nm23-H1 蛋白表达可作为 SCLC 是否转移的独立保护因素,低表达 Nm23-H1蛋白的患者更容易发生转移(OR=0.32,95% CI=0.12-0.90,P=0.031)。2.3 Nm23-H1 表达与 SCLC 患者预后的关系本组 71 例 SCLC 患者,总体中位生存期为 13.0 个月。
Nm23-H1 阴性的患者中位生存期 12.00 月,阳性的患者中位生存期 15.00 月,表达阴性的患者中位生存期显着短于表达阳性的患者(P=0.046)(图 2)。【图2】
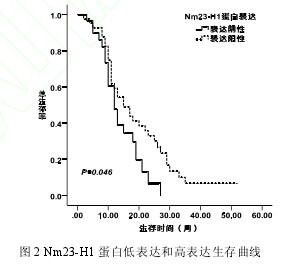
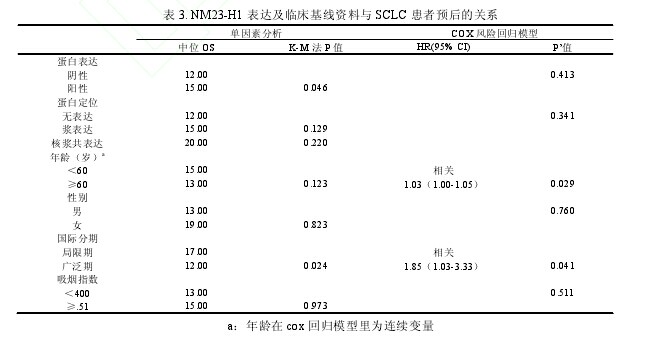
临床分期为局限期的患者中位生存期比分期为广泛期的患者长(17.00 月 vs. 12.00 月,P=0.024)。但在多因素 COX 风险回归分析中,只有临床分期和年龄与 SCLC 患者生存期有相关性(年龄:HR=1.03,95% CI=1.00-1.05,P=0.029;临床分期: HR=1.85,95%CI=1.03-3.33,P=0.041);Nm23-H1 表达及亚细胞定位与SCLC 患者生存期都没有关联性(表 3)。【表3】
3 讨论
SCLC 是一种高度恶性的肿瘤,其生长速度快,侵袭性强,早期就可以出现广泛的远处转移,预后极差。由于 SCLC 具有快速播散的生物学特性,多数患者诊断时已有其他脏器转移,而失去手术治疗的机会。虽然 SCLC 对放化疗均非常敏感,但是对治疗的反应率和治愈率不相符,大多数患者在初始治疗后仍会出现复发或远处转移,生存时间短.
肿瘤转移是其恶性标志和重要特征,也是导致肿瘤患者不良预后的重要原因之一。肿瘤转移并非随机过程,而是由多因素决定的阶梯式步骤,主要表现为:细胞间粘附下降;突破由细胞外基质和血管壁的基底膜组成的屏障;免疫逃逸;形成新生血管等.它受到多种因素的调控,可能涉及肿瘤细胞粘附、迁移和侵袭能力的增强,基质金属蛋白酶分泌的增多,血管和淋巴管的形成,上皮间质转化等一系列的改变.肿瘤转移抑制基因是可以抑制肿瘤转移而不影响原发肿瘤生长的基因,其在恶性肿瘤发生、发展和转移中的作用受到广泛重视。
Nm23-H1 作为首个被发现的肿瘤转移抑制基因,在抑制肿瘤细胞粘附、趋化和侵袭性、限制肿瘤细胞在转移处集落形成等方面发挥重要作用.定点突变 Nm23-H1 基因 P96S、S120G 表明,Nm23-H1 抑制肿瘤转移功能,可能与其组氨酸激酶活性有关,而目前关于该酶的底物确切底物及通过的信号通路仍不明确.目前已有大量临床资料表明,Nm23-H1基因在乳腺癌、肝癌、胃癌、恶性黑色素瘤等恶性肿瘤中的表达,与抑制肿瘤转移和良好预后相关.
本研究应用免疫组织化学检测了 Nm23-H1 蛋白在 71 例 SCLC 标本和 22 例正常肺组织标本中的表达情况,结果显示 Nm23-H1 在 SCLC 组织中呈现2 种表现形式:胞浆表达和核浆共表达,且表达程度强弱不等,但以胞浆表达为主;在正常肺组织中也以胞浆表达为主,但表达水平显着高于 SCLC 组织。同时 Nm23-H1 在局限期的表达显着高于广泛期,这与 Nm23-H1 作为细胞质肿瘤转移抑制基因的特性相一致,同时也提示 Nm23-H1 低表达在 SCLC的远处转移中发挥着重要的作用。
在 Kaplan-Meier 生 存 分 析 中 , 我 们 发 现Nm23-H1 在 SCLC 中的表达与预后明显相关,Nm23-H1 高表达组的预后显着高于低表达组。这与Nm23-H1 在非 SCLC 等其它多种恶性肿瘤中的结果相一致,反映出转移抑制基因 Nm23-H1 对 SCLC 预后是有价值的指标.但在纳入临床基线数据进行COX 比例风险回归发现,Nm23-H1 表达及亚细胞定位不能作为 SCLC 预后的独立风险因素,仅年龄与临床分期与 SCLC 生存期独立相关。Nm23-H1 表达不能作为独立预后因素,考虑其一可能与我们样本量不足有关;其二,肿瘤的发生发展是一个复杂的过程,受到多因素网络式调控, Nm23-H1 仅是影响 SCLC 预后的诸多因素之一。
参考文献:
[1] Planchard D, P?echouxb C L. Small cell lung cancer: New clinicalrecommendations and current status of biomarker assessment[J].European Journal of Cancer, 2011, 47(3): 272-283.
[2] Joshi M, Ayoola A, Belani C P. Small-cell lung cancer: An update ontargeted therapies[J]. Adv Exp Med Biol, 2013, 779: 385-404.
[3] Steeg P S, Bevilacqua G, Kopper L, et al. Evidence for a novel geneassociated with low tumor metastatic potential[J]. Journal of theNational Cancer Institute, 1988, 80 (3): 200-204.
[4] Lacombe M-L, Milon L, Munier A, et al. The human nm23_nucleosidediphosphate kinases[J]. Journal of Bioenergetics and Biomembranes,2000, 32(3): 247-258.
[5] Marshall J-C, Lee J H, Steeg P S. Clinical-translational strategies forthe elevation of nm23-h1 metastasis suppressor gene expression[J]. MolCell Biochem, 2009, 329(1-2): 115-120.
[6] Lionello M, Blandamura S, Lovato A, et al. A high nuclear nm23-h1expression is associated with a better prognosis in elderly patients withlaryngeal carcinoma[J]. Acta Oto-Laryngologica, 2013, 133(8):874-880.
[7] 冯燕, 李少林, 杨宇馨, 等。 HOGG1 在小细胞肺癌中的表达特点及其与预后的关系[J]. 第三军医大学学报, 2011, 33(17): 1808-1811.





