摘 要: 微量元素与人体健康密切相关。比如,金属元素的稳态可能会影响细胞的代谢功能,进而诱发某些疾病的产生。激光诱导击穿光谱(LIBS),是一种可用于分子复杂的生物材料或临床标本的无因子分析技术,具有从单个激光脉冲和少量材料(纳克级数)中获得元素信号的能力。综述了2015年以来LIBS技术在疾病诊断方面的相关研究,包括几种常见疾病(结石、脱发、眼病,等)和恶性肿瘤(皮肤癌、肝癌、胃癌、乳腺癌、卵巢癌、宫颈癌,等)。研究的样品涵盖块状组织、结石、组织切片、血清、血浆、全血等生物材料。这些生物样品包含或积累了可以检测、定量和成像的金属物质和金属化合物。LIBS能够以百万分之几的灵敏度和微观分辨率对样品中内源性和外源性化学元素进行微分析、定位分析以及定量分析。最后,对LIBS技术的医学发展趋势进行了展望。希望简单的评述能够吸引更多的科学家关注LIBS技术在疾病诊断领域的应用,进而促进LIBS技术的日趋完善,为疾病诊断和治疗发挥更大的作用。
关键词 : LIBS; 常见疾病;肿瘤;元素;
Abstract: Trace elements are closely related to human health. For example, the homeostasis of metal elements may influence cells' metabolic function, which may result in the production of certain diseases. Laser-induced breakdown spectroscopy(LIBS), a factor-free analysis technique that can be employed for molecularly complex biological materials or clinical specimens, has the capability to obtain elemental signals from a single laser pulse and a small amount of material(Nanogram order).This article mainly reviews the related research of LIBS process in disease diagnosis since 2015, including several common diseases(calculi, hair loss, eye disease, etc.) and malignant tumor diagnosis(skin cancer, liver cancer, stomach cancer, breast cancer, ovarian cancer, cervical cancer, etc.). The samples studied include in-vitrotissue, calculus, tissue sections, serum, plasma, whole blood and other biological materials. These biological samples contain or accumulate metal substances and metal-doping compounds that can be detected, quantified, and imaged. LIBS can perform microanalysis, location analysis, and quantitative analysis of the endogenous and exogenous chemical elements in the sample with sensitivity and microscopic resolution of several parts per million. Finally, the medical development trend of the LIBS technique prospects. It is hoped that a simple review can attract more scientists to pay attention to the application of LIBS technology in the field of disease diagnosis to promote the improvement of the LIBS method and play a greater role in disease diagnosis and treatment.
Keyword: LIBS; Common disease; Tumors; Element;
引 言
人体由钙(Ca)、 钠(Na)、 镁(Mg)、 铁(Fe)、 铜(Cu)、 锌(Zn)等50多种元素组成。 化学元素在生物体细胞的生理稳态中起着核心作用, 其失调可能导致一定数量的病理变化。 例如, 金属元素及其化合物可诱导生物分子(如: 酶和DNA)构象的变化, 改变细胞的平衡, 造成细胞损伤。 细胞的损害会引发细胞代谢环境的理化性质和化学组成发生变化, 进而导致疾病的产生。 此外, 内部环境的严重失衡会使细胞程序性死亡或异常增殖, 致使肿瘤的形成。 因此, 生物体中化学元素的分布可作为疾病诊断的重要信息来源, 及时监测生物体中金属元素含量对维持机体平衡起着重要作用。 表1显示了部分金属元素在生物体生命活动中所起的重要作用。
激光诱导击穿光谱(laser induced breakdown spectroscopy, LIBS)技术是一种基于原子发射光谱且激光作为激发源的新兴物质元素分析技术, 脉冲激光经聚焦在靶材形成的等离子体衰减过程中发出的特定元素线通过光谱仪进行检测分析, 通过监视其位置和强度可定性和定量的分析靶材, 在元素检测和分析中具有独特优势[1]。 首先, 测量范围非常广泛, 可以直接检测固体、 液体和气体。 其次, 样品的制备和应用过程简便。 第三, 可以实现快速、 实时和长距离分析以及非接触式测量。 第四, 实验样品消耗少, 对被测材料的破坏小。 第五, 空间分辨率高, 可达1~100 μm。 第六, 可以同时分析多种元素, 分析过程简单、 迅速。 最后, 可以区分不同的材料、 组织, 具有良好的敏感性, 可以进行痕量分析。 20世纪60、 70年代, 受到激光器价格和探测器性能的限制, LIBS技术研究只停留在基础理论方面, 在实际应用方面没有取得实质性的进展。 直到20世纪80年代新型光谱探测器的发明, 光谱质量明显提高, LIBS技术才得到实质性的进展。
为了LIBS技术进一步的实用化, 出现了多种激光诱导击穿光谱探测的新技术, 例如: 纳秒LIBS、 飞秒LIBS、 偏振分辨LIBS、 双脉冲LIBS以及时间分辨LIBS等。 为了获取样品尽可能全面的信息, 一般可以通过两种或更多种互补的分析技术来实现。 LIBS与一种或多种光谱技术(荧光光谱、 高光谱成像、 拉曼光谱、 X射线荧光等)的组合具有明显协同作用, 比应用单一技术获得的信息更多。 此外, 将化学计量学、 机器学习、 多元数据分析等方法与LIBS光谱相结合为复杂的光谱数据的定量和定性分析提供了强大的工具。 常见的方法包括偏最小二乘(PLS)、 主成分分析(PCA)、 线性判别分析(LDA)、 支持向量机(SVM)、 人工神经网络(ANN)等。 当前, LIBS技术获得了新的发展, 如多元素编码测定LIBS; 将金属纳米粒子用于增强激光烧蚀技术, 即纳米粒子增强LIBS; 基于光学显微镜, 扫描样品的目标区域表面时同时连续产生激光诱导的等离子体, 获得具有高空间分辨率的三维(3D)成分图, 即元素成像LIBS。
近年来, 随着激光技术和光学检测技术的发展, 研究人员对LIBS技术在生物医学领域的应用前景产生了极大的兴趣, 并在疾病检测方面获得了长足的发展。 因此, 在查阅近几年来国内外最新文献的基础上, 总结了LIBS在几种常见疾病和肿瘤诊断领域的研究进展。 希望本文能够使LIBS技术在疾病检测中具有更广阔的研究空间和应用价值, 并使这一新的光谱检测技术日臻完善。
表1 部分金属元素在生物体生命活动中所起的作用

1 、LIBS在疾病诊断领域中的应用
LIBS技术作为一种直接光谱检测和分析技术, 可以通过生物样品的检测获得大量目标元素的光谱信息。 在本节中, 我们回顾LIBS在疾病诊断领域的应用。 这一研究的首要目标是利用人类和动物标本产生的等离子体发射光谱来确定疾病的演变特征。 部分文献中选择的样品以及测量到的化学元素如表2所示。
1.1、 LIBS在常见疾病诊断中的应用
1.1.1 、LIBS分析硬组织和软组织
进行LIBS分析的临床样本主要涉及硬组织(牙齿、 骨头等)和软组织(皮肤、 皮下组织等)。 Gazmeh等证明了LIBS在牙穿孔和牙菌斑中区分健康组织和腐烂组织的可能性[2]。 采用PLS判别分析法, 根据Ca, Mg, Zn, K, Sr和Na等元素的32条原子和离子发射谱线, 对受试者不同的牙组织进行分类。 结果表明, 该方法对未知牙组织有较好的鉴别和预测能力, 证实了LIBS识别健康牙齿和蛀牙的能力。 LIBS还可用于表征处于不同纤维化阶段的小鼠肝组织[17]。 已知Ca会增加纤维间隔中细胞外基质蛋白的交联。 随着纤维化的加剧, LIBS信号显示Ca强度增加了三倍, 这意味着Ca是肝纤维化的关键参与者。 此外, 利用LIBS技术还可对皮肤慢性炎症引起的表皮增生或角化过度进行研究[18]。
1.1.2、 LIBS分析结石疾病
2015年, Jaswal等对胆结石和尿路结石患者进行了LIBS分析, 证明LIBS在结石诊断的准确性、 灵敏度、 样品消耗量和分析时间上具有优势[5]。 此外, 相关研究人员还使用LIBS进行了胆囊结石和肾结石中微量元素的定性和定量分析, 不同部位结石的确定以及泌尿系统结石内部不同元素的空间分布[19,20,21]。 这些相关研究证明了LIBS在结石诊断中的巨大潜力。
表2 部分文献中选择的样品和测量元素
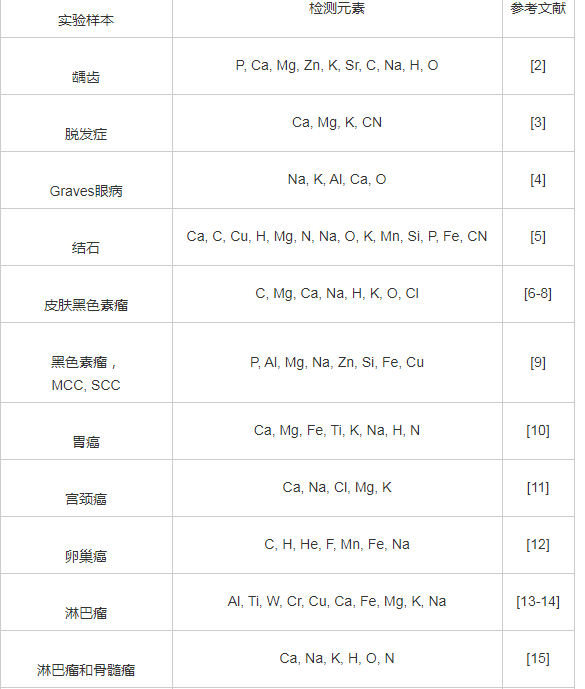
1.1.3、 LIBS分析脱发症
Hamzaoui等利用LIBS技术验证雄激素性脱发对12例男性患者的头发基质的影响[3]。 研究表明, 枕骨和顶叶区域的头发样品富含微量元素和矿物质(Mg 285.21 nm, Ca 445.47 nm, Na 588.99 nm和CN发射带)。 对于Ca和Na元素, 来自枕骨区的发射带要比顶叶区的强。 对于K元素, 顶部区域中的发射带比后枕区域中的更密。
1.1.4、 LIBS分析阿尔茨海默氏病
Gaudiuso等使用LIBS和机器学习分析了来自阿尔茨海默氏病患者和健康对照人群的血浆微滴, 并着重使用基于LIBS差异光谱的数据分析方法来区分这两种不同类型的样本[22]。 结果表明, 使用LIBS和机器学习可以对阿尔茨海默氏病患者和健康对照样本进行可靠的分类, 准确度为80%, 特异性为75%, 敏感性为85%。 该研究验证了LIBS诊断阿尔茨海默氏病的潜力。
1.1.5、 LIBS分析Graves眼病
Graves眼病的诊断是一项重大挑战。 通过LIBS与机器学习相结合的方法, Li等对Graves眼病组织和健康对照组织进行了识别[4]。 选择了金属元素(Na, K, Al, Ca), 非金属元素(O)和分子带(C—N, C—O)来诊断Graves眼病。 结合LDA, SVM, k最近邻模型和广义回归神经网络模型的分析结果表明, LIBS结合非线性模型在识别Graves眼病方面具有更高的准确率。 因此, LIBS与机器学习方法相结合可以成为区分Graves眼病的有效方法。
1.2 、LIBS在肿瘤诊断中的应用
金属元素参与细胞的异常表达(异常分裂、 异常分化、 异常增殖), 在肿瘤的生长、 侵袭和转移中起着重要的作用。 LIBS可以通过测量正常和癌性样本中微量元素的强度对样品进行诊断和分类[16,23]。
1.2.1 、LIBS分析皮肤癌
黑色素瘤是一种常见的皮肤癌。 Han等使用LIBS实时检测系统分析了黑素瘤和周围皮肤中检测生物标志物Ca和Mg[6]。 此外, PCA和LDA的结果表明, LIBS对黑色素瘤的检测具有高度灵敏性。
Moon等研究人员使用小鼠黑色素瘤组织切片证明了飞秒LIBS区分皮肤黑色素瘤区域与真皮区域的可能性(图1)[8]。 研究显示, 黑色素瘤和周围组织的C Ⅰ 247.85 nm的强度基本相同, 黑色素瘤中Mg Ⅱ 279.55 nm, 280.27 nm和Mg Ⅰ 285.21 nm的强度明显高于周围组织。 由于细胞密度和代谢强度的差异, 黑色素瘤肿瘤区域的Mg浓度较高, 并逐渐降低至周围组织。 以C强度作为Mg元素信号归一化的标准, 建立强度比图像, 可以清楚地区分皮肤癌区域和真皮区域, 且与形态学和组织学特征相吻合。 这项研究表明, LIBS是一种快速确定皮肤癌部位的有效工具, 可以缩短组织病理学诊断所需的时间。
Moncayo等证明LIBS成像在人类健康皮肤组织、 转移性黑色素瘤、 默克尔细胞癌(MCC)和鳞状细胞癌(SCC)活检中的适用性[9]。 这项研究检测了P, Cu, Zn, Fe, Al, Mg和Na等元素, 发现肿瘤中化学元素的含量和空间分布存在差异。 在MCC中, 最靠近肿瘤区域的Ca和Zn浓度较高。 在SCC中, Na, P, Mg和Zn信号在肿瘤的左侧区域更强。 皮肤的外部区域由Na, Mg, Ca, P和Zn组成。 SCC或MCC的底部区域显示出高Fe含量, 证明该区域存在血液或大血管。 另外, SCC和MCC组织的侧边缘可以看到很高浓度的Fe, Cu, Ca和Zn。
![图1 从色黑色素瘤, 周围组织和硅片基底测量的LIBS光谱强度[8]](http://www.xueshut.com/uploads/allimg/220712/20421I523-2.jpg)
图1 从色黑色素瘤, 周围组织和硅片基底测量的LIBS光谱强度[8]
Fig.1 Intensities of LIBS spectra measured from the pigmented melanoma, surrounding tissue, and Si wafer substrate[8]
1.2.2 、LIBS分析肝肿瘤
El-Sherbini等利用LIBS技术简单鉴定了人肝组织表面血浆中的元素(Mg, K, Ca, Na, Fe, Mn和Cu)[24]。 结果显示, 在肝组织中, 元素Mg, K, Ca, Na, Fe, Mn和Cu的增加与X6.5, 2.5, 7, 4.5, 7, 6.5, 2.5的因子有关。 换句话说, 元素浓度的增加与肝脏中聚集的钙化可能是相关的。 此外, 即使已识别的不同微量元素的浓度无穷小地增加, 癌症也开始发生恶化。 将LIBS结果反馈到ANN中来验证癌症的分类。 大约80%的结果与标准的国际记录值相一致, 表明, 利用ANN对正常和恶性肝组织进行分类是有效的。
1.2.3 LIBS分析胃肿瘤
Aida等使用LIBS方法鉴定了胃肿瘤组织和非肿瘤组织[10]。 两种组织中元素的比较显示, 所有肿瘤组织样品中Ca和Mg谱线的强度显着高于非肿瘤组织。 对于Ca元素, 选择315.92, 317.96, 393.32和396.8 nm的发射线进行研究; 对于Mg元素, 选择279.56和280.3 nm的发射线进行分析。 直方图(图2)显示了胃肿瘤和非肿瘤组织中Ca和Mg元素的平均发射强度。 与正常样品相比, 肿瘤样品中Mg元素谱线的强度显着增加。 Mg在蛋白质生物合成中的主要作用可以解释这种增加, 而且Mg在细胞增殖强度中起关键作用。 癌症疾病会破坏Mg的分布, 导致非肿瘤组织中的Mg减少。
1.2.4 、LIBS分析乳腺癌
Ghasemi等在LIBS和声波响应的基础上进行了长期实验来区分正常和癌变的乳腺组织[25]。 恶性组织中微量元素(Ca, Na和Mg)显着增加, 这是由激光诱导的微等离子体中的Mg Ⅰ, Mg Ⅱ, Ca Ⅰ, Ca Ⅱ, Na Ⅰ和Na Ⅱ决定。 此外, 由于物质强烈的原子/离子特性发射, 伴随着更高的声学水平, 癌变组织上产生了更多的高能微等离子体。 不健康组织上的等离子体特征发射向检测器移动的速度稍微快一些, 导致音频蓝移差异。 肿瘤组织中微量元素含量较高, 激光诱导微等离子体中的等离子体温度和电子密度较高, 声信号进一步强化。
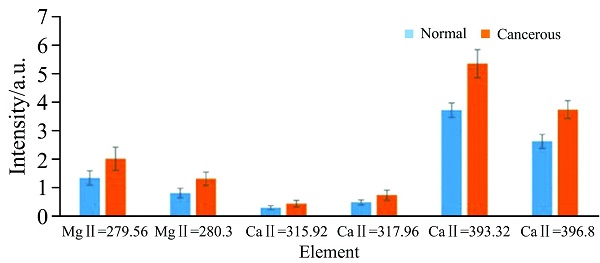
图2 直方图比较了从5名患者的肿瘤(橙色)和非肿瘤(蓝色)胃组织获得的6条基本谱线的平均归一化强度
Fig.2 Histogram comparing the average normalized intensities of 6 elemental lines obtained from both neoplastic (orange) and no-neoplastic (blue) gastric tissues of 5 patients[10]
1.2.5 、LIBS分析宫颈癌
宫颈癌是最常见的妇科恶性肿瘤。 Wang等使用LIBS技术对石蜡包埋的健康组织(n=54)和宫颈癌组织(n=90)样本进行了初步讨论, 并结合PCA-SVM法对健康组织和宫颈癌组织进行了分类[11]。 收集健康组织和宫颈癌组织从240~860 nm的144条LIBS光谱。 所有光谱数据在C 247.86 nm峰的基础上进行归一化, 结果表明健康组织和宫颈癌组织中的Ca, Na, Cl, Mg和K等微量元素具有明显的差异。 其中宫颈癌组织中的Na, Mg和K的归一化强度明显高于健康组织, 而Ca的归一化强度明显低于健康组织。 此外, 研究显示PCA-SVM的识别精度优于SVM, 其识别精度从93.06%提高到94.44%, 建模时间从21.55 s降低到1.97 s。 因此, 可以合理地得出结论, LIBS技术和PCA-SVM的组合可以作为一种实时诊断宫颈癌组织的有效方法。
1.2.6、 LIBS分析淋巴瘤和骨髓瘤
Chen等采用LIBS联合PCA、 LDA等方法快速、 可靠地诊断和鉴别了影响淋巴和造血系统的淋巴瘤和多发性骨髓瘤(MM)[15]。 从淋巴瘤、 MM患者和健康对照样本的LIBS差异谱中选择Ca, Na, K和N等元素的24条原子线进行诊断。 结果表明, 主要的特征光谱位于Ca, Na, K, H, O和N的原子谱线上, 与健康对照组相比, 癌症患者血清样本的Ca谱线较强, 而Na, K, H, O和N谱线较弱。
Busser等通过常规光学显微镜结合LIBS多元素成像对福尔马林固定和石蜡包埋的淋巴结标本进行了组织病理学评估[13]。 实验检测到肿瘤中多种金属的存在, 例如皮肤肉芽肿和皮肤假性淋巴瘤中存在Al, 淋巴结和皮肤标本中存在Ti, W, Cr和Cu。 此外, LIBS多元素调查显示, P元素分布可正确显示淋巴结结构, 而在淋巴结的不同区域中存在高含量的Ti, 这与组织病理学检查后报道的黑色素形态相对应。
Chen等对早期淋巴瘤和健康对照组的全血样本进行LIBS测试, 观察到CN B-X谱带、 弱发射线以及Ca, Na, K, H, O和N为主的强发射线[14]。 研究显示, 淋巴瘤全血中的Fe Ⅰ, Na Ⅰ和K Ⅰ浓度较低, 而Ca Ⅰ和Mg Ⅰ的强度与健康对照组相似。 此外, 金属元素Ca Ⅰ和Na Ⅰ峰的光谱强度在不同癌症阶段之间相对稳定, 而Mg Ⅰ, Fe Ⅰ和K Ⅰ的光谱强度随着肿瘤阶段的增加而逐渐降低。
1.2.7、 LIBS分析其他肿瘤
Melikechi等对卵巢癌进行了LIBS和多变量统计分析[12]。 通过这项工作, 发现Fe具有许多特征谱线, 还证明LIBS可用于转基因(癌)和野生(非癌)小鼠的自动识别。 Gaudiuso等人从患病小鼠的肺、 淋巴结、 脾脏血清和组织匀浆中获得了LIBS光谱[7]。 研究显示正常血清样品的Ca Ⅰ和Mg Ⅰ强度略高于肿瘤样品, 而Na I却没有观察到相似的趋势。 Ghasemi等分析了人类乳房、 结肠、 喉和舌器官的正常和癌症体外组织的LIBS光谱[16]。 结果表明, 癌组织中Ca, Mg和Na等微量元素的含量明显高于健康组织。 癌性乳房组织中的Mg浓度明显高于喉咙、 舌头和结肠癌性组织。 健康组织中Ca Ⅱ/K, Ca Ⅰ/K和Na Ⅰ/K的归一化强度要比四种癌症组织样本更高。 此外, 他们还通过电感耦合等离子体发射光谱和四极质谱法对微量元素的识别进行了验证。 研究人员采用激光烧蚀电感耦合等离子体质谱法和LIBS相结合的方式对恶性胸膜间皮瘤样品的微量和痕量元素进行分析, 其结果与组织学染色有良好的相关性[26]。 这些信息有助于元素分析结果在药物开发和治疗中更具价值。
2、 结 论
LIBS作为一种元素分析技术正处于蓬勃发展的阶段, 尤其是在疾病诊断研究中的应用。 本文重点讨论了LIBS在几种常见疾病和肿瘤诊断中的实用性。 LIBS具有既简单又快速的多元素分析优势, 随着不断发展, LIBS分析技术从简单的单次显微分析、 二维表征(空间映射)分析发展到材料元素的3D成像功能(如深度剖析)。 此外, LIBS成像与其他成像方式(例如拉曼光谱、 激光诱导的荧光光谱、 光学显微镜等)结合使用, 有助于通过光谱学、 解剖学和病理学相结合的多模式方法收集临床样本的诊断信息。 尤其是LIBS与机器学习、 纳米技术的融合可作为精密医学诊断的新工具。 将来, 疾病检测领域可能是LIBS潜在的研究兴趣领域。 从这个意义上说, LIBS在疾病诊断领域中的研究将进入新阶段, 将为医学事业做出更加杰出的贡献和创造更高的应用价值。
参考文献
[1] Dell'aglio M.Alrifai R,De Giacomo A. Spectrochimica Acta Part B:Atomic Spectroscopy,2018,148:105.
[2] Gazmeh M,Bahreini M,Tavassoli S H.Applied Optics,2015,54(1):123.
[3] Hamzaoui S ,Cherni I,Jaidene N.Lasers in Engineering.2018,41(1-3):159.
[4] Li J,Chen F.Huang G.et al.Frontiers of Optoelectronics,2020.ttps://doi org/10.1007/S12200-620-0978-2.
[5] JaswalB B S,Singh V K.Applied Spectroscopy Reviews ,2015, 50(6):473.
[6] Han J H,Moon Y,Lee J J,et al. Biomedical Optics Express,2016,7(1):57.
[7] Gaudiuso R,Ewusi-Annan E,Melikechi N,et al. Spectrochimica Acta Part B:Atomic Spectroscopy,2018,146:106.
[8] Moon Y,Han J H,Choi J-H,et al.Journal of Biomedical Optics,2018,24(3):031011.
[9] Moncayo S,Trichard F,Busser B,et al.Spectrochimica Acta Part B:Atomic Spectroscopy,2017.133:40.
[10] Seifalinezhad A. Bahreini M.Matin M M H.et al.Journal of Lasers in Medical Sciences 2019,10(1):64.
[11] Wang J,Li L,Yang P,et al.Lasers in Medical Science ,2018,33(6):1381.
[12] Melikechi N,Markushin Y,Connolly D C,et al.Spectrochimica Acta Part B:Atomic Spectroscopy,2016,123:33.
[13] Busser B,Moncayo S,Trichard F,et al.Modern Pathology,2018,31(3):378.
[14] Chen X,Li X,Yang S,et al. Biomedical Optics Express,2018,9(3):1057.
[15] Chen X,Li X,Yu X.et al. Spectrochimica Acta Part B:Atomic Spectroscopy.2018,139:63.
[16] Ghasemi F,Parvin P,Reif J.et al. Joumal of Laser Applications,2017.,29(4):042005.
[17] Teran-Hinojosa E, Sobral H, Sanchez-Perez C,et al. Biomedical Optics Express, 2017,8(8):3816.
[18] Moon Y,Han J H,Shin S,et al. Biomedical Optics Express ,2016,7(5):1626.
[19] Muhammed Shameem K, Chawla A,Mallya M,et al.Journal of Biophotonics ,2018, 11(6);:e201700271.
[20] Khalil A a 1,Gondal M A. Shemis M,et al. Applied Optics ,2015,54(8):2123.
[21] Jaswal B B S,Kumar V,Sharma J,et al.Lasers in Medical Science,2016,31(3):573.
[22] Gaudiuso R, Ewusi-Annan E Xia W,et al. Spectrochimica Acta Part B:Atomic Spectroscopy,2020,171:105931.
[23] Nouir R,Hamzaoui S ,Ghalila H,et al. Spectroscopy and Spectral Analysis(光谱学与光谱分析),2020, 40(3):980.
[24] El-Sherbini A.Hagras M M,Farag H H,et al.International Journal of Science and Research,2015,4(5):1153.
[25] Ghasemi F,Parvin P,Motlagh N S H,et al Applied Optics ,2016.55(29):8227.
[26] Bonta M,Gonzalez J J,Quarles C D,et al.Journal of Analytical Atomic Spectrometry,2016 ,31(1);:252.





