摘 要: 背景:脂肪来源干细胞获取便捷且具有显着的成骨分化能力,被认为是骨缺损修复的理想种子细胞。然而骨组织工程学的研究进展揭示,生物支架材料改性能够直接调控干细胞的成骨分化。目的:综述能够调控脂肪来源干细胞成骨分化效果的各种生物支架材料。方法:由第一作者通过检索中国知网、万方、维普、Pub Med、Embase和Web of Science数据库2016年1月至2019年5月发表的相关文献,检索词为“脂肪干细胞,支架材料,成骨,金属,钛;Adipose derived stem cells,scaffold,osteogenic,metal,Ti”,最终选取符合标准的文献62篇。结果与结论:用于骨组织工程的支架材料分为无机材料、天然高分子材料、合成高分子材料3类,无机材料包括羟基磷灰石、磷酸三钙、生物活性玻璃、钛金属、镁金属,天然高分子材料包括胶原、丝素蛋白、壳聚糖,合成高分子材料包括聚己内酯、聚乳酸、聚乙醇酸及其共聚物-聚乳酸-羟基乙酸共聚物。设计能与细胞相互作用以指导其生物反应和骨分化的材料研究一直层出不穷,但如何营造更安全、更合理、更贴近生物体内的细胞的生长微环境仍然面临着很多困难。对生物支架材料的改性能够直接调控干细胞的成骨分化,同时成骨诱导之外的血管化及植入后的感染也是需要关注的问题。
关键词: 脂肪来源干细胞; 支架材料; 成骨分化; 骨组织工程; 羟基磷灰石; 磷酸三钙; 胶原; 3D打印;
Abstract: BACKGROUND: Adipose-derived stem cells are easy to access and have strong proliferative capacity, which are considered as ideal seed cells for bone defect repair. The bone tissue engineering research progress reveals that bioscaffold material modification can directly regulate the osteogenic differentiation of stem cells. OBJECTIVE: To review various biological scaffold materials that can regulate the osteogenic differentiation of adipose-derived stem cells. METHODS: The first author searched the articles in CNKI, WanFang, VIP, PubMed, Embase and Web of Science databases published from January 2016 to May 2019. The search terms were “adipose derived stem cells, scaffold, osteogenic, metal, Ti” in Chinese and English, respectively. Finally 62 eligible articles were selected. RESULTS AND CONCLUSION: Scaffold materials for bone tissue engineering are classified into inorganic materials(hydroxyapatite, tricalcium phosphate, bioglass, titanium, and magnesium), natural polymer materials(collagen, silk fibroin, and chitosan) and synthetic polymer materials(polycaprolactone, polylactic acid, polyglycolic acid and poly(lactic-co-glycolic acid)). The studies on materials that interact with cells to guide their biological response and bone differentiation are increasing. But how to create a safe, rational, and close to the micro-environment of cell growth in vivo is a challenge. Modification of bioscaffold materials can directly regulate osteogenic differentiation of stem cells. Moreover, vascularization and post-implantation infections are issues of concern.
Keyword: adipose-derived stem cells; scaffold materials; osteogenic differentiation; bone tissue engineering; hydroxyapatite; tricalcium phosphate; collagen; three-dimensional printing;
文章快速阅读:
文章特点—
(1)种子细胞和支架材料的选择是骨组织工程的核心问题;
(2)脂肪来源干细胞因其获取便捷和显着的成骨分化能力等优势,被认为是骨缺损修复的理想种子细胞;
(3)文章详细综述了能够调控脂肪来源干细胞成骨分化效果的各种生物支架材料,旨在为新型生物支架材料的研发和临床转化提供理论支持。
文题释义:
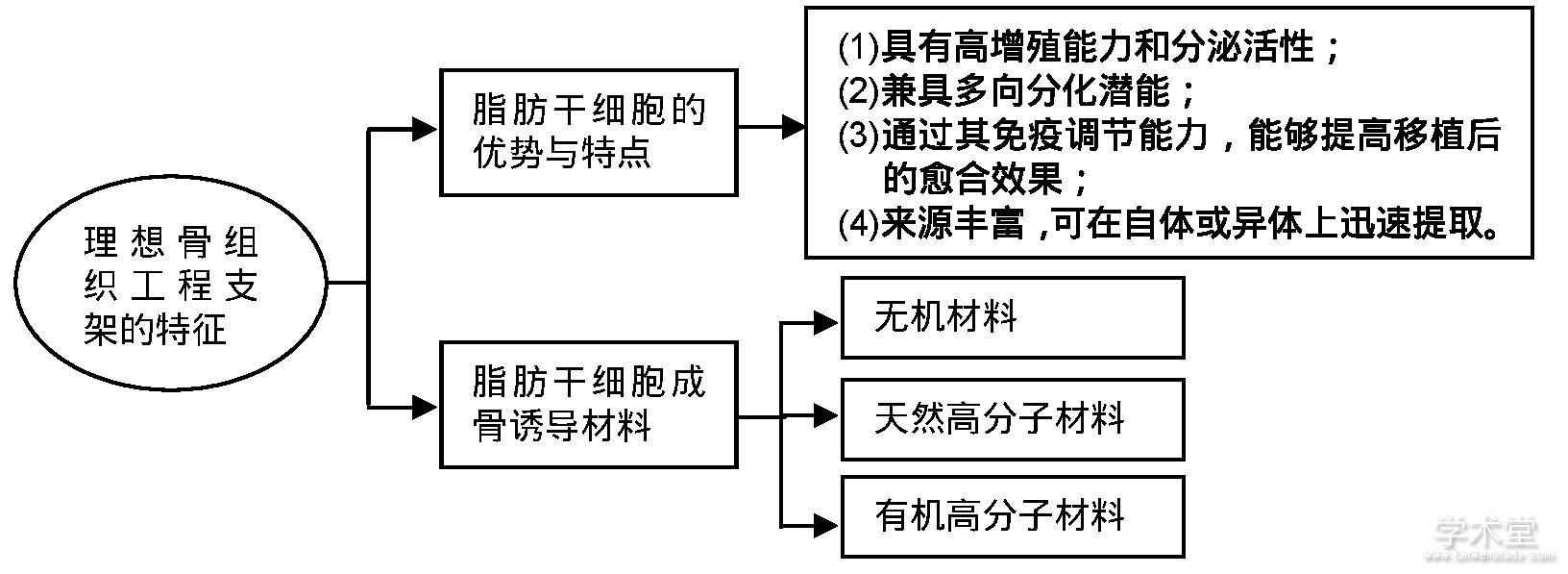
脂肪干细胞的优势:脂肪来源干细胞具有以下特点:高增殖能力和分泌活性;兼具多向分化潜能;通过其免疫调节能力,能够提高移植后的愈合效果;来源丰富,可在自体或异体上迅速提取,以上优势使其成为骨组织工程的理想种子细胞。
骨组织工程支架材料的分类:主要分为3类,无机材料、天然高分子材料、合成高分子材料,无机材料包括羟基磷灰石、磷酸三钙、生物活性玻璃、钛金属、镁金属,天然高分子材料包括胶原、丝素蛋白、壳聚糖,合成高分子材料包括聚己内酯、聚乳酸、聚乙醇酸及其共聚物-聚乳酸-羟基乙酸共聚物。
0. 引言Introduction
由于肿瘤、损伤、炎症、先天性畸形等导致的骨组织缺损,严重影响了患者生活质量,临床常用的修复技术主要是自体和同种异体骨移植,但均存在移植骨形态匹配度差、感染及免疫排斥等问题。骨组织工程技术的飞速发展为解决这一问题提供了新的方向。种子细胞和支架材料的选择是骨组织工程的核心问题。脂肪来源干细胞具有高增殖能力和分泌活性;兼具多向分化潜能;通过其免疫调节能力,能够提高移植后的愈合效果;来源丰富,可在自体或异体上迅速提取[1],因此是骨组织工程的理想种子细胞。
理想的骨修复支架材料应该具备以下特性:良好的生物相容性及生物安全性;与骨形成速度相匹配的生物降解率;具有足够的孔隙,以保证细胞长入和营养物质运输,并在支架内部进行血管化过程;能实现形态重塑,以保证临床不同病例所需的外部形态;良好的成骨诱导性;良好的机械性能和理化特性。为了创设性能优越的支架材料,研究者进行了众多的相关研究。用于骨组织工程的支架材料分为3类:无机材料、天然高分子材料、合成高分子材料,见表1。文章重点就不同支架材料对脂肪来源干细胞诱导成骨的研究进行综述。
表1 支架材料的分类和特点

1、 资料和方法Data and methods
1.1、 资料来源
以“脂肪干细胞,支架材料,成骨,金属,钛;Adipose derived stem cells,scaffold,osteogenic,metal,Ti”为关键词,在中国知网、万方、维普、Pub Med、Embase和Web of Science数据库搜索2016年1月至2019年5月发表的相关文献。
1.2、纳入与排除标准
纳入标准:关于支架材料改性促进脂肪干细胞成骨分化的研究;关于脂肪干细胞联合支架材料修复骨缺损的研究。
排除标准:研究中支架材料只承担支架作用而无成骨诱导作用的研究;重复性研究。
1.3、 数据提取
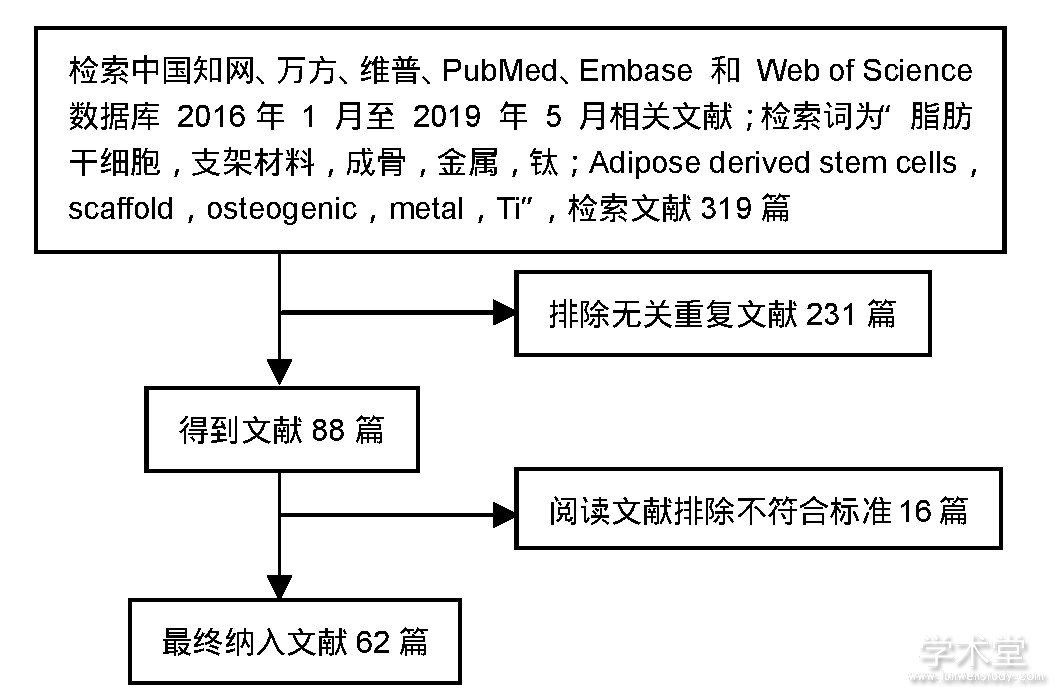
共检索到文献319篇,其中中文文献127篇、英文文献192篇,排除与研究目的相关性差及内容陈旧、重复的文献257篇,纳入62篇符合标准的文献进行综述,见图1。
图1 文献检索流程
1.4 、质量评价
符合纳入标准的62篇文献中,文献[1]探讨了脂肪干细胞在骨组织工程的优势;文献[2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31]探讨了改性无机材料对脂肪干细胞成骨分化的研究进展;文献[32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50]探讨了改性天然高分子材料对脂肪干细胞成骨分化的研究进展;文献[51,52,53,54,55,56,57,58,59,60]探讨了改性合成高分子材料对脂肪干细胞成骨分化的研究进展;文献[61,62]探讨了材料空间结构的研究进展。
2、 结果Results
2.1、 无机材料
无机材料具有良好的生物相容性,机械强度较高,但柔韧性和亲水性较差、材料较脆,并且在机体里降解速度缓慢。因此,无机材料只能充当填充材料,而不能独立作为骨组织工程支架材料用于负重成骨的研究。
2.1.1、 羟基磷灰石
羟基磷灰石是最常见的生物活性材料,其化学式为Ca10(PO4)6(OH)2,是骨缺损修复及相关替代材料的主要研究方向。羟基磷灰石的主要优点是具有较好的生物相容性、骨传导性、可降解性,缺点为脆性大、拉伸性较差。
羟基磷灰石可以通过其骨传导性能和良好生物相容性特性诱导骨再生。纳米结构羟基磷灰石具有更大潜力,因为其能够释放Ca2+和PO43-以诱导干细胞成骨分化[2]。然而由于脆性特征,该材料的应用受到限制。聚合物材料可以通过增加韧性和弹性对羟基磷灰石进行改性。WANG等[3]研发了多孔纳米羟基磷灰石和马来酸酐接枝的聚(甘油癸二酸酯)复合支架,支架平均孔径150-300μm,接种人脂肪来源干细胞后的RUNX2、骨钙素、骨胶原1A1等成骨相关因子表达显着增高,证明该材料能诱导脂肪来源干细胞成骨分化。SATTARY等[4]构建聚已内酯/胶原/纳米羟基磷灰石/维生素D3支架,碱性磷酸酶活性及茜素红染色及成骨基因骨胶原1、碱性磷酸酶、RUNX2高表达,证实该支架可增强脂肪来源干细胞成骨分化的能力。AMJADIAN等[5]将脂肪来源干细胞接种到左旋聚乳酸/纳米羟基磷灰石/地塞米松/明胶复合支架上,可以刺激碱性磷酸酶活性及成骨基因碱性磷酸酶、骨形态发生蛋白2、RUNX2成骨基因的表达,从而促进脂肪来源干细胞成骨分化。由于纳米结构羟基磷灰石具有良好的细胞相容性,会使大多数细胞黏附在其表面,最终导致软硬组织粘连。为避免此情况,MA等[6]构建了羟基磷灰石纳米带/聚乳酸Janus膜,在没有生长因子的条件下可以促进碱性磷酸酶活性,增加RUNX2、骨桥素、骨钙素成骨基因表达,从而促使脂肪来源干细胞的成骨分化,体内实验显示聚乳酸可发挥屏障作用,避免骨与邻近软组织的术后粘连。
对羟基磷灰石支架用化学元素进行表面修饰,可促进脂肪来源干细胞成骨分化。GAO等[7]制备了锶-羟基磷灰石-接枝-聚(γ-苄基-L-谷氨酸)纳米复合材料,通过双重喷射法制备具有高度相互连接的大孔的微载体,体外实验显示碱性磷酸酶、RUNX2、骨胶原1、骨钙素呈现高表达,体内实验8周micro-CT显示小鼠骨缺损模型中新形成骨体积和骨密度均显着提高。BOSTANCIOGLU等[8]将人脂肪来源干细胞接种在金属离子(Zn、Ag和Cu)掺杂的羟基磷灰石纳米涂层表面,脂肪来源干细胞能够保持较高的细胞数量和细胞活力,羟基磷灰石-Zn Ag支架最为显着,在无外源性成骨刺激下,脂肪来源干细胞能够在羟基磷灰石-Com(对照)、羟基磷灰石-Ag、羟基磷灰石-ZnAg和羟基磷灰石-ZnAgCu表面分化为成骨细胞,其中羟基磷灰石-Ag支架成骨能力最强。
2.1.2、 磷酸三钙
磷酸三钙的化学式为Ca3(PO4)2,按结构分为高温相(α-磷酸三钙)和低温相(β-磷酸三钙)。β-磷酸三钙具有良好的生物相容性、骨引导作用和可降解性能,在骨缺损修复中应用广泛。β-磷酸三钙可通过释放钙磷促进组织矿化,显着增强新骨形成和钙化,是骨组织工程的潜力材料。
羟基磷灰石/β-磷酸三钙构成的复合材料应用广泛,其具有良好的生物相容性、可降解性、骨传导性、合适的孔隙率及骨诱导能力。CANCIANI等[9]以30%羟基磷灰石和70%β-磷酸三钙制备双向磷酸钙支架,结果显示碱性磷酸酶活性升高和钙沉积物增加,证明提高了脂肪来源干细胞的成骨分化程度。β-磷酸三钙/胶原支架材料是一种较为常见的复合材料,其从仿生学角度模拟了骨组织成分。LI等[10]制备了羟基磷灰石/β-磷酸三钙复合支架,荧光显微镜显示复合支架上的细胞于24 h开始显示具有典型成骨细胞样形态,成骨相关基因碱性磷酸酶、骨形态发生蛋白2、骨钙素、骨桥素、骨胶原1A1等表达上调,证实含有β-磷酸三钙的支架能更好地促进脂肪来源干细胞的成骨分化。
传统支架在制作过程中很难完全符合骨缺损形状,获得均匀一致的孔径及孔隙率,因此很多学者开始尝试用3D打印技术制作支架。PARK等[11]制作3D打印的聚已内酯/β-磷酸三钙支架,碱性磷酸酶活性、von Kossa染色及骨胶原1、骨钙素、RUNX2等成骨基因表达结果显示,3D打印的聚已内酯/β-磷酸三钙支架显着提升了人脂肪来源干细胞的成骨能力。LEE等[12]使用3D打印技术制作聚已内酯/磷酸三钙支架,体外实验显示成骨相关基因骨胶原1、骨钙素、RUNX2表达增高,体内实验通过CT及组织学检查显示小猎犬上颌骨缺损有较好成骨效果,证实3D打印聚已内酯/磷酸三钙可促进脂肪来源干细胞的成骨分化。KURZYK等[13]将人脂肪来源干细胞接种到覆盖有磷酸三钙的聚已内酯(聚已内酯+5%磷酸三钙)3D打印支架上,茜素红染色、碱性磷酸酶活性测定结果显示聚已内酯/磷酸三钙支架对脂肪来源干细胞成骨分化有促进作用。
支架内初始血管的形成及其与宿主脉管系统的关系,可更好地确保骨组织修复。缺氧诱导因子1α信号传导被认为是血管形成的关键因子,促进干细胞成骨活性。二甲基乙二酰基甘氨酸可在正常氧条件上调缺氧诱导因子1α蛋白的表达水平,选择二甲基乙二酰基甘氨酸输送的新型载体可以提升脂肪来源干细胞成骨水平。JAHANGIR等[14]制备递送二甲基乙二酰基甘氨酸的β-磷酸三钙-藻酸盐-明胶支架并培养脂肪来源干细胞,体外实验证实碱性磷酸酶活性增高,钙沉积增多,成骨相关基因碱性磷酸酶、骨钙素上调,证实促进了脂肪来源干细胞的成骨分化,体内实验苏木精-伊红染色、马松染色及CT结果显示鼠颅骨临界骨缺损获得了更好的成骨效果。
2.1.3 、生物活性玻璃
生物活性玻璃是一种拥有良好生物相容性、可降解性能的骨组织修复材料,通过释放不同离子如硅(Si)、钙(Ca)上调成骨相关基因,促进干细胞的成骨分化。
虽然生物活性玻璃具有良好的生物相容性和生物活性,但是脆性大,而高分子材料具有良好的抗弯及抗拉强度,将两者复合后可综合2种不同体系的优点。MAHDAVI等[15]采用静电纺丝技术成功制备了聚-L-乳酸支架,在此支架涂覆纳米生物活性玻璃,将马脂肪来源干细胞在纳米生物活性玻璃包被的聚-L-乳酸纳米纤维支架上培养,结果显示纳米生物活性玻璃-聚-L-乳酸支架可促进成骨相关基因RUNX2、骨胶原1、碱性磷酸酶的表达,增强碱性磷酸酶活性,从而促进脂肪来源干细胞的成骨分化。DU等[16]通过改性溶胶-凝胶和颗粒增强技术构建介孔生物活性玻璃支架,其有高度互联的大孔隙(200-500μm),可为血管及骨骼生长提供营养物质并为废物运输提供条件;通过接种内皮诱导的脂肪来源干细胞对支架进行预血管化,以修复大鼠股骨临界尺寸的骨缺损,证实携带内皮诱导的脂肪来源干细胞预血管化介孔生物活性玻璃支架可以产生快速血管生成和骨再生。JING等[17]将脂肪来源干细胞接种到淫羊藿苷掺杂的45S5生物活性玻璃,体外实验显示血管内皮生长因子蛋白分泌水平升高,体内植入12周通过Micro-CT、组织学和免疫组织化学染色显示可显着促进大鼠颅骨骨缺损修复,证明淫羊藿苷/45S5生物玻璃接种脂肪来源干细胞可明显促进成骨和血管生成。
2.1.4、 钛金属
目前临床最为常用的金属植入材料为钛及其合金。钛材料机械强度高,耐腐蚀,抗疲劳性好,价格经济,主要用于承力骨、关节和牙等硬组织的修复和替换,夹板、缝合针、骨螺钉等植入器件,心血管和软组织修复中的支架材料。
钛支架材料不同的孔径和孔隙率能够影响脂肪来源干细胞的成骨分化。LONGWEI等[18]采用阳极氧化工艺制备二氧化钛纳米管,研究发现直径为70 nm的纳米管可以通过抑制RBP2表达上调成骨相关基因区域H3K4的甲基化水平,从而促进成骨效果。MALEC等[19]采用阳极氧化工艺制备纳米多孔阳极二氧化钛膜,形成高度有序的纳米表面结构,其中108 nm孔径材料不仅提高了脂肪来源干细胞的增殖能力,碱性磷酸酶、骨形态发生蛋白2、RUNX2等成骨相关因子表达也相应增加。
随着细胞外基质环境在纳米尺度的揭示,针对植入材料表面的研究开始走向基于仿生的微纳米多级结构建立及生物性能分析。微米结构可增加骨-植入体之间的机械嵌合力,促进细胞的增殖与黏附;纳米结构可以通过调控细胞内信号分子通路进而影响细胞行为。微纳米多级结构对细胞黏附、增殖和分化的显着促进作用,已被很多研究者所证实。MOON等[20]利用靶离子诱导等离子体溅射在微米Ti-6Al-4V表面制备分层微纳米结构,并验证了其对前成骨细胞MC3T3-E1的黏附和增殖有显着促进作用,犬下颌骨体内实验显示骨与种植体的接触面积和新骨体积显着改善。JIANG等[21]采用喷砂/酸蚀和阳极氧化在钛表面制作分层微纳米结构,其表面培养MC3T3-E1细胞的碱性磷酸酶活性升高,细胞矿化显着增高,RUNX2、骨胶原1、骨钙素成骨基因表达显着上调,证实微纳结构钛对MC3T3-E1细胞的成骨有促进作用。微纳米多级结构对干细胞的成骨诱导性也得到了相关验证。LI等[22]利用微弧氧化在钛表面制备了一种新型的“皮质样”微/纳米双尺度结构二氧化钛涂层,体外实验证实“皮质样”结构对骨髓间充质干细胞的黏附、扩散和分化有显着促进作用,体内实验“皮质样”结构表现出更突出的细胞相容性和骨整合。ZHOU等[23]制作了掺杂有锶、钴和氟的微孔二氧化钛/磷酸钙涂层钛,其具有分级的微/纳米结构。二氧化钛/磷酸钙涂层钛可抑制革兰阳性及阴性细菌的定植和生长,刺激大鼠骨髓干细胞中关键血管生成因子血管内皮生长因子、缺氧诱导因子1a的表达,以及成骨相关基因碱性磷酸酶、骨桥素、骨胶原1、骨钙素的表达。体内动物实验显示,二氧化钛/磷酸钙涂层钛可诱导更多新骨和更紧密的骨结合。这些都提示微纳米多级结构钛有望成为诱导脂肪干细胞成骨分化的新型材料。
对钛材料进行表面化学修饰,可通过改变脂肪来源干细胞成骨微环境进而促进其成骨分化。KIM等[24]将Sr修饰于钛材料表面,证明Sr的释放可以主动诱导脂肪来源干细胞在纳米钛材料表面的黏附相关因子vincu-lin、talin、RHOA呈高表达,同时碱性磷酸酶、骨唾液酸蛋白、骨钙素、骨保护素、RANKL等成骨相关因子的表达也相应增加。MARYCZ等[25]使用溶胶-凝胶法将2种不同剂量的生物活性鞘脂S1P融入二氧化钛涂层,降低其表面粗糙度,二氧化钛/S1P(80?g/L)上脂肪来源干细胞生成骨结节数量最多,骨桥素、骨形态发生蛋白2表达也显着增加,S1P可以通过激活S1PR1/JAK/STAT信号通路参与该过程。HEO等[26]将金纳米颗粒(GNP)均匀地固定在二氧化钛表面制成二氧化钛-金纳米颗粒,以此材料为培养基底诱导人脂肪来源干细胞成骨分化,其成骨标志物骨胶原1、RUN2、骨钙素、骨唾液酸蛋白均表达上调,碱性磷酸酶活性和钙沉积测定呈现高水平。
金属表面进行适当处理后能够形成具有缓释促成骨药物的结构。YUNSONG等[27]在钛材料表面构建具有缓释作用的磷酸钙涂层,分别负载甲硝唑和辛伐他汀后培养脂肪来源干细胞,证明辛伐他汀缓释支架上脂肪来源干细胞的RUNX2、骨钙素等成骨相关因子表达增高并向成骨分化。
2.1.5 、镁金属
镁(Mg)及其合金具有良好的生物学、力学相容性和可降解性,其密度和弹性模量与人体骨极为相似,可有效减少应力屏蔽效应,是一种极有前景的骨组织工程支架材料,缺点为机械性能差和在生理环境中易被氧化腐蚀。
镁支架材料对脂肪来源干细胞作用的研究目前尚处于镁对脂肪来源干细胞毒性、活力、增殖及耐腐蚀方面的探索。FAZEL ANVARI-YAZDI等[28]评估Mg-2Zn和Mg-2Zn-xCa(x=1%,2%,3%)合金对脂肪来源干细胞的影响,MTT测定检查显示所有合金在24 h对细胞活力并无显着不利影响,动电位极化分析证实合金元素Zn和Ca的加入提高了镁的耐腐蚀性。HOU等[29]应用超声波纳米晶体表面改性对AZ31B-镁材料进行表面处理后,合金硬度、屈服应力和耐磨性均得到显着改善,但其耐腐蚀性没有变化,处理前后脂肪来源干细胞与AZ31B-Mg的生物相容性良好,该材料有着潜在诱导脂肪来源干细胞成骨分化的潜能。
羟基磷灰石、β-磷酸三钙、生物活性玻璃均有良好的生物相容性、骨诱导作用,对成骨分化起到积极作用,普遍存在的弱点为材料较脆,需对其进行增韧处理。目前的主要研究趋势为通过将羟基磷灰石、β-磷酸三钙、生物活性玻璃与聚合物等软质材料混合,在孔隙率、机械强度、生物活性等方面进行综合调控,以弥补研究不足[30]。此类改性措施对提高材料机械性能起到了积极作用,但对满足临床承重部位的植入要求依然存在距离。同时羟基磷灰石、β-磷酸三钙、生物活性玻璃的成骨性能已得到广泛肯定,但对成骨之外的血管化问题研究相对较少,仍然存在一定的空白。
钛材料具有良好的生物相容性,是骨科和牙科领域的首选植入物,临床存在的主要问题为钛的生物惰性所致与周围骨组织结合差且弹性模量较高,容易出现周围骨质吸收及材料松动,通过改性提高钛材料-骨结合有重要意义。目前较为有前景的研究趋势为阳极氧化制备二氧化钛纳米管,其具有优越的生物相容性和力学性能,不同纳米尺度对成骨调控方面的研究依然有必要进一步开展,且仍需在不同条件下使用不同动物模型加强二氧化钛纳米管的体内研究[31]。镁金属由于与骨组织更接近的弹性模量及潜在成骨性能,是一种有前途的骨组织工程材料,在如何提高骨再生和提升耐腐蚀性方面,镁合金依然有很大的研发空间。
2.2、 天然高分子材料
天然高分子材料的生物相容性好,包括胶原、明胶、丝素蛋白、壳聚糖、琼脂糖、透明质酸、纤维素、纤维蛋白原、硫酸软骨素、藻酸盐、氨基葡萄糖、脂质体和细胞外基质等,有利于促进细胞的各项生理功能。
2.2.1、 胶原
胶原是构成骨组织的重要成分,具有良好的生物相容性,抗原性小,有利于干细胞的黏附、分化、增殖,由其制备的人工皮肤已应用于临床。
单一胶原支架具有降解速率高、机械性能差的缺点,可以结合羟基磷灰石等陶瓷材料制成矿化胶原支架(骨胶原/羟基磷灰石),以改善其机械性能、生物相容性、骨传导性、骨诱导性和生物降解性。骨胶原/羟基磷灰石可进一步与其他材料复合并进行表面改性,从而促进干细胞的成骨分化。DEWEY等[32]将聚乳酸与微米级孔隙度的骨胶原/羟基磷灰石整合制作了多尺度骨胶原/羟基磷灰石/聚乳酸复合材料,此材料具有优良的机械性能并便于塑型,在缺乏成骨诱导的情况下依然可以促使脂肪来源干细胞向成骨细胞分化。TIFFANY等[33]将硫酸锌包裹在胶原-黏多糖上形成锌功能化支架,脂肪来源干细胞在该材料上培养后成骨相关基因骨胶原A2、骨形态发生蛋白2、RUNX2等表达上调,micro-CT显示矿物质形成显着增多。CALABRESE等[34]将镁载入骨胶原/羟基磷灰石培养脂肪来源干细胞,茜素红染色显示钙沉积物增加,RUNX2、骨胶原1A1、碱性磷酸酶成骨相关因子表达上调,显示其促进脂肪来源干细胞成骨分化的能力。
胶原也可通过与不同高分子材料复合来增加其机械性能和改善成骨分化能力。TOOSI等[35]用胶原结合聚乙醇酸制备骨胶原/聚乙醇酸支架,脂肪来源干细胞接种到支架上并修复兔颅骨缺损,骨胶原聚乙醇酸/脂肪来源干细胞与骨胶原/聚乙醇酸组碱性磷酸酶等成骨相关基因表达均显着性上调,CT示两组均能显着修复颅骨缺损,且两者并无显着差异,这也许与移植细胞数量较少或观察时间短有一定相关性。MAISANI等[36]构建由Ⅰ型骨胶原和糖基-核苷-氟化组成的糖基-核苷-氟化-骨胶原复合水凝胶,物理水凝胶的加入防止了胶原的收缩和脂肪来源干细胞从凝胶中扩散出来,其机械性能、弹性模量和生物学特性均得以改善,碱性磷酸酶活性升高,茜素红染色和茜素红染色显示钙沉积物显着增加,证实糖基-核苷-氟化-骨胶原复合水凝胶促进人脂肪来源干细胞成骨分化的作用。NEDJARi等[37]基于聚(L-丙交酯ε-己内酯)和纤维蛋白原组成的电纺混合纳米纤维,制作出了一种3D蜂窝结构支架培养人脂肪来源干细胞,结果显示碱性磷酸酶活性升高,钙沉积增加,成骨基因碱性磷酸酶、RUNX2表达上调,证明该支架对人脂肪来源干细胞成骨分化有显着促进作用。CHEN等[38]制备出负载Sr的氧化石墨烯Sr-GO-Col纳米复合材料,此支架将可长期释放Sr离子,具有更高的保水性和机械性能,能够通过分泌血管内皮生长因子、骨形态发生蛋白2等血管生成因子经MAPK信号传导途径来刺激内皮细胞形成,进而促进脂肪来源干细胞的体外成骨分化,体内研究中将Sr-GO-Col复合材料移植到大鼠颅骨缺损中,12周时也能够表现出更好的骨再生和血管生成效果。
对胶原支架进行表面化学修饰可以改变其理化性质,为脂肪来源干细胞成骨分化提供特定的微环境,从而促进脂肪来源干细胞的成骨分化。SASAYAMA等[39]将表没食子儿茶素没食子酸酯修饰于明胶海绵支架,其亲水性增强,促进了脂肪来源干细胞的黏附能力,可有效诱导脂肪来源干细胞的成骨分化。GURUMURTHY等[40]将弹性蛋白样多肽修饰于胶原复合材料,18 g/L弹性蛋白样多肽和6 g/L骨胶原配比的弹性蛋白样多肽-骨胶原复合物具有更大的拉伸强度和弹性模量,培养的人脂肪来源干细胞上碱性磷酸酶活性增加,茜素红染色显示钙沉积物增加,骨钙素蛋白定量增高,显示弹性蛋白样多肽-骨胶原复合物具有更高的促进脂肪来源干细胞成骨分化能力。
2.2.2、 丝素蛋白
丝素蛋白主要来自蚕丝,容易获得且价格低廉,作为一种天然生物材料具有良好的生物相容性、缓慢的生物降解速率和低炎症反应等特征,在骨组织工程中应用广泛。由于单一丝素蛋白制备的支架力学性能降低、韧性减小,很难承受应力,骨细胞附着能力不佳,骨诱导能力有限,很难同时满足实际应用中对各种不同性质的要求。因此,丝素蛋白通常与其他材料相结合来制备丝素蛋白复合材料支架,通过组分和制备工艺来调节其各方面的性质,以满足骨组织工程的不同需求。
丝素蛋白支架最常用到的形态是丝素蛋白静电纺丝纤维,该支架及其改良产物被证实可增强骨缺损模型中干细胞的成骨分化和骨形成。KO等[41]应用静电纺丝技术制备制成丝素蛋白/羟基磷灰石支架,然后用聚多巴胺修饰丝素蛋白/羟基磷灰石支架的表面,以形成黏合剂层,最后羟基磷灰石沉积产生丝素蛋白/羟基磷灰石支架的第二层羟基磷灰石,负载人脂肪来源干细胞后植入小鼠颅骨临界骨缺损模型观察骨形成情况,证明羟基磷灰石/聚多巴胺/丝素蛋白/羟基磷灰石促进了人脂肪来源干细胞的成骨分化。WANG等[42]利用静电纺丝技术制备不同质量比的丝素蛋白/聚(丙交酯-共-ε-己内酯)纳米纤维支架,该支架可以通过增强骨唾液酸蛋白、骨钙素、骨胶原1A1、骨桥素成骨基因表达而促进细胞外基质矿化,证明其诱导人脂肪来源干细胞成骨分化的能力。RIBEIRO等[43]将2片由聚对苯二甲酸乙二醇酯单丝间隔开的致密丝素蛋白片组成丝素蛋白-聚对苯二甲酸乙二醇酯支架,该支架呈高度多孔状,培养的脂肪来源干细胞碱性磷酸酶表达增加,骨钙素、骨桥素、骨胶原L1成骨基因表达上调,显示丝素蛋白-聚对苯二甲酸乙二醇酯支架有促进脂肪来源干细胞成骨分化的能力。PINA等[44]采用盐浸法和冷冻干燥技术制备了结合了Sr、Zn、Mn等离子的丝素蛋白/磷酸三钙支架,具有可调的孔径、孔隙率、高互连性和更佳的机械强度,其中丝素蛋白/Zn-Sr-磷酸三钙支架有最大的孔径和孔隙率;支架中负载离子不同对脂肪来源干细胞增殖和分化的影响不同,Zn支架更好的促进了脂肪来源干细胞增殖,Sr和Mn支架诱导脂肪来源干细胞的成骨潜能更高,Sr和Zn组合支架对脂肪来源干细胞的增殖和成骨均产生积极影响。
丝素蛋白支架经改性后能够具备负载及稀释药物的能力,合适剂量的瑞舒伐他汀对骨生成具有潜在的促进作用。KALANI等[45]通过氩射频将瑞舒伐他汀固定在丝素蛋白纳米纤维上,成骨基因碱性磷酸酶、RUNX2水平上调,茜素红染色显示钙沉积物增加,证实瑞舒伐他汀可促进脂肪来源干细胞的增殖和成骨分化。之后KALANI等[46]改进了瑞舒伐他汀释放支架,将聚乙烯醇和丝素蛋白分别用作壳和核,瑞舒伐他汀分子在纳米纤维中以非晶态分散,通过调节壳体流速控制瑞舒伐他汀释放量,核-壳结构的体外释放曲线表现出双相释放曲线;在负载瑞舒伐他汀纳米纤维上培养的人脂肪来源干细胞钙沉积物增加,碱性磷酸酶、RUNX2、骨钙素、骨胶原1基因表达上调,显示改善了细胞增殖并辅助成骨分化。
2.2.3、 壳聚糖
壳聚糖化学名为(1,4)聚-2-氨基-2-脱氧-β-D-葡聚糖,可通过化学法和酶解法获得,是甲壳素脱乙酰基的产物,而甲壳素是甲壳类动物外骨骼的主要组成部分,具有良好的生物相容性、生物降解性、非抗原性、无毒性、抗菌性、止血活性,但其机械强度较差。
壳聚糖本身即有着良好的骨诱导性,由于其质地硬并且较脆,抗剪切力能力相对较弱,难以独立用作骨组织工程支架,因此多将壳聚糖与其他材料结合对其性能进行优化。ARDESHIRYLAJIMI等[47]将具有3种不同百分比(10%,15%,20%)的明胶加入到壳聚糖产生3种不同孔隙的多孔壳聚糖支架,孔径分别为(80±20),(130±20)和(180±20)?m,茜素红染色、碱性磷酸酶活性、钙含量测定及RUNX2、骨钙素、ON、骨胶原1基因表达结果显示,10%组对脂肪来源干细胞成骨分化促进效果最为明显。LIAO等[48]将透明质酸-壳聚糖-聚(N-异丙基丙烯酰胺)作为三维有机凝胶基质,嵌入双相磷酸钙陶瓷微粒作为矿化骨基质,并进一步用富血小板血浆强化,合成透明质酸-壳聚糖-聚(N-异丙基丙烯酰胺)/富血小板血浆/双相磷酸钙热凝胶水凝胶支架,与兔脂肪来源干细胞共培养并植入兔颅骨缺损模型中,证实富血小板血浆/双相磷酸钙可促进透明质酸-壳聚糖-聚(N-异丙基丙烯酰胺)凝胶基质中脂肪来源干细胞的成骨分化,此构建可有效促进缺损部位新骨形成。
在壳聚糖支架中加入促进成骨的元素,可诱导脂肪来源干细胞成骨。AKDERE等[49]将壳聚糖支架结合羟基磷灰石或结合包含硼(B)的羟基磷灰石(B-羟基磷灰石)构建壳聚糖复合体,培养并验证人脂肪来源干细胞在支架上的增殖和成骨分化能力,结果表明骨胶原1、RUNX2、骨桥素成骨基因表达上调,证实B-羟基磷灰石/壳聚糖支架具有骨诱导和骨传导性质,可促进人脂肪来源干细胞的黏附、增殖和成骨分化。
壳聚糖支架同时也能够作为靶向载药、药物缓释的载体。WU等[50]将载有AL的壳聚糖/羟基磷灰石微球纳入聚(L-乳酸)/纳米羟基磷灰石基质中制备新型微球-支架混合体系,显示新型微球-支架混合体系有长期释放AL的能力,体外碱性磷酸酶活性和茜素红染色显示新型微球-支架混合体系(10%)脂肪来源干细胞的成骨分化显着增强,体内实验通过X射线、苏木精-伊红以及Masson染色评估进一步显示新型微球-支架混合体系(10%)支架的成骨能力,新型微球-支架混合体系(10%)支架在8周内完全修复大尺寸(1.5 cm)骨缺损。
天然高分子材料普遍存在的问题是较差的机械强度,不能独立用作支架材料,往往需制备成复合材料。胶原支架是其中较早应用于骨组织工程的支架材料,改性的胶原支架在临床已有广泛应用,如胶原塞、矿化胶原骨粉。如何更好的提高胶原支架生物活性,使骨组织再生水平进一步优化,提高临床应用价值也是需要进一步研究的问题。由于丝素蛋白较低的机械性能和有限的骨诱导能力,在骨组织工程的研究仍有很大的空间。虽然已有不少研究起到改善丝素蛋白性能的作用,但改性丝素蛋白依然不能满足骨组织工程所需要的机械强度兼具成骨性能,而丝素蛋白改性的相关机制研究也相对缺乏,仍需要大量研究弥补空白。
2.3、 合成高分子材料
聚己内酯、聚乳酸、聚乙醇酸其共聚物-聚乳酸-羟基乙酸共聚物是目前应用较为广泛的骨组织工程支架材料。这类材料形成的支架可塑性强,可根据缺损设计外形,更有利于细胞的黏附与分化。但此类材料其亲水性较差,影响细胞的吸附;可导致机体发生无菌性炎症;其机械强度不能达到理想状态等,依然需要采用不同的方式对其性能进行优化。
2.3.1、 聚乳酸
聚乳酸有3种异构体:外消旋聚乳酸、左旋聚乳酸、右旋聚乳酸,是一种常见的生物可降解材料,但降解速率过快,并且聚乳酸的降解产物呈酸性,会引起周围组织的无菌性炎症反应,鉴于这一材料的局限性,常常选用复合生物材料满足骨组织工程需要。ZHANG等[51]设计100,200,300 nm的3种不同直径的聚乳酸纳米柱阵列,见图2,在无生长因子诱导下培养脂肪来源干细胞的碱性磷酸酶活性升高,成骨相关基因RUNX2、骨桥素、骨钙素表达上调,茜素红染色显示钙沉积增多。证实聚乳酸纳米柱阵列可诱导脂肪来源干细胞的成骨分化,其中200 nm纳米柱阵列诱导成骨效果最显着。TAVANGAR等[52]制备了一种陶瓷涂层纳米纤维支架,将左旋聚乳酸纳米纤维通过等离子体处理后吸附陶瓷,将具有优于羟基磷灰石骨诱导潜力的硬石包覆在等离子体处理的左旋聚乳酸纳米纤维上,其表面接种脂肪来源干细胞的碱性磷酸酶活性升高,钙沉积物增加,相关成骨基因碱性磷酸酶、骨钙素表达上调,证实支架提高了脂肪来源干细胞成骨分化程度。BAGESHLOOYAFSHAR等[53]将Zn硅酸盐矿物纳米颗粒涂覆于左旋聚乳酸支架,将马脂肪来源干细胞与其共培养,显示Zn硅酸盐矿物涂层左旋聚乳酸支架对脂肪来源干细胞增殖无毒,且促进脂肪来源干细胞的增殖和成骨分化。KARIMI等[54]将硅锆钙石纳米颗粒包覆于左旋聚乳酸支架,以脂肪来源干细胞评估其成骨性能,碱性磷酸酶活性升高、钙矿物沉积增多、骨相关基因RUNX2、碱性磷酸酶、骨钙素表达上调,证实了其成骨潜能。
图2 聚乳酸纳米柱阵列[51]
![图2 聚乳酸纳米柱阵列[51]](http://www.xueshut.com/uploads/allimg/191217/36-19121G43245322.jpg)
聚乳酸-羟基乙酸共聚物是聚乳酸的共聚物,是一种合成的、生物相容的、可生物降解的支架材料,已被用于临床填补骨缺损。MA等[55]将赤铁矿纳米颗粒依靠逐层组装技术结合到聚乳酸-羟基乙酸共聚物/聚己内酯复合材料表面,碱性磷酸酶活性增高,成骨相关基因RUNX2、骨胶原1、骨钙素、碱性磷酸酶表达上调,证实其成骨活性。HAJIHASANI BIOUKI等[56]将辛伐他汀接枝到聚乳酸-羟基乙酸共聚物,此支架呈现高孔隙率(91%)且辛伐他汀释放时间可超过80 d,碱性磷酸酶活性升高,茜素红染色结果显示矿化结节增多,证实辛伐他汀接枝聚乳酸-羟基乙酸共聚物支架可促进脂肪来源干细胞的成骨分化。
2.3.2、 聚己内酯
聚己内酯具有细胞相容性、组织相容性、可降解性和弹性功能,是可吸收材料研究的重点,缺点为柔性和弹性过强,主要通过表面改性或与其他有机高分子材料聚合来拓展其在骨组织工程的使用范围。
WANG等[57]用石墨烯接枝聚己内酯构建3D打印聚己内酯/石墨烯支架,证实石墨烯的添加对细胞活力和增殖具有积极影响。之后WANG等[58]将聚己内酯/石墨烯/脂肪来源干细胞移植入小鼠颅骨骨缺损,使用外源性微电流疗法(10μA)体外刺激缺损处,通过苏木精-伊红染色、马松染色观察结缔组织和新骨形成良好,碱性磷酸酶、β受体活化因子、β受体活化因子配体、骨保护素表达升高,证实电刺激聚己内酯/石墨烯支架对新骨重建起到积极影响。聚己内酯/磷酸三钙也是聚己内酯复合支架的主要形式,如前所述[11,12,13]。
2.3.3、 聚乙醇酸
聚乙醇酸具有良好的生物相容性、降解性和良好的加工性,同时它具有良好的可塑性,在医学领域广泛应用。然而和聚乳酸一样,聚乙醇酸的降解产物呈酸性,可引起局部组织的无菌性炎症,需要对其进行优化处理以适应骨组织工程的要求。
聚乙醇酸具有良好的可生物降解性和生物相容性,但细胞黏附性差。聚醚砜树脂支架具有良好的生物力学性能,但生物相容性低。结合2种材料特征制备的聚乙醇酸/聚醚砜树脂支架,是骨组织工程的常用类型,在此基础上对聚乙醇酸/聚醚砜树脂支架进行表面改性也会对脂肪来源干细胞成骨分化起到促进作用。KASHEF-SABERI等[59]利用静电纺丝技术制成共电纺富血小板血浆/聚醚砜树脂/聚乙烯醇复合支架,富血小板血浆添加后支架变得更有弹性,使支架有助于承受拉伸、扭曲和弯曲,碱性磷酸酶活性升高,茜素红染色矿化结节增多,RUNX2、碱性磷酸酶成骨基因表达上调,证实富血小板血浆/聚醚砜树脂/聚乙醇酸可有效促进脂肪来源干细胞的成骨分化。HEYDARI ASL等[60]探索增加物理刺激对聚乙醇酸/聚醚砜树脂支架脂肪来源干细胞成骨分化的影响,用电磁波(12 MHz)刺激聚乙醇酸/聚醚砜树脂/脂肪来源干细胞,碱性磷酸酶活性提高,RUNX2、碱性磷酸酶成骨基因表达增加,可见电磁场可有效刺激聚乙醇酸/聚醚砜树脂支架上的脂肪来源干细胞成骨潜力。
合成高分子材料可生物降解,具有良好的生物相容性。然而它们的其他性能如低亲水性和低基质刚度,使其在细胞黏附和成骨分化方面不够理想。支架表面结构作为细胞与支架之间的界面,在诱导干细胞成骨分化中发挥重要作用。因此,许多表面改性方法被用来改善支架的表面性能。通过对高分子材料进行复合材料改性及表面改性提高了其机械性能及成骨性能。
高分子材料目前依然普遍存在的问题:降解产物呈酸性,会引起周围组织的无菌性炎症反应,依然缺乏从酸性产物及炎症方面进行相应探讨的研究;对高分子材料降解时间的研究相对较少,已应用于临床的高分子材料降解时间跟踪报道依然不足,需要进一步的动物实验及临床研究验证,以及进一步研发降解可控的改性高分子材料。
2.4、 支架空间结构
传统的支架材料多为2D支架,即二维平面支架材料。2D支架制作简单,但2D支架很难模拟体内真实的环境,且干细胞在2D支架培养对增殖分化也会产生负面影响。目前骨组织工程更倾向于制备与临床更贴合的3D支架[61]。
随着3D打印技术的发展,3D支架在骨组织工程有了更大的发展,钛、β-磷酸三钙、聚乳酸等材料都可应用3D打印技术制备三维材料。3D打印是一种借助三维CT数据获得精确外形的材料制作技术,所制备外形更精确,使修复骨组织缺损获得更理想的效果,在骨组织工程具有广阔的前景。选择性激光烧结和熔融沉积成型技术是骨组织工程最常用的加工方式,前者更适合打印多孔仿生支架材料,且要求材料必须以粉末形式获得,其打印材料更加精确;后者设备体积更小,打印成本更低,是个性化3D打印的首选[62]。3D打印结合支架材料改性有望制备出个性化、精确形状、成骨优良、机械性能适合的支架材料。
3D支架材料的研发依然存在以下问题:制作成本较贵,个性化应用推广存在困难;不同材料修复骨缺损所需最佳孔隙率和孔径依然不能达到共识;支架材料的改性结合干细胞与3D打印技术融合的研究依然不足;如何实现3D支架材料的血管化问题尚需进一步研究;3D支架材料中添加活性因子促进成骨需要更多的研究资料进行验证。3D支架材料在骨组织工程的发展具有广阔的前景,但同时存在巨大挑战。
3、 小结与展望Conclusions and prospects
骨组织工程是一项迅速发展、不断革新的课题,以干细胞生物学和材料研究领域为主的骨组织工程正在蓬勃发展。脂肪来源干细胞在这一领域具有巨大的潜力,它的丰富性及易于获取的优势较其他干细胞更加明确。自骨组织工程出现以来,设计能与细胞相互作用以指导其生物反应和骨分化的材料研究一直层出不穷,如何营造更安全、更合理、更贴近生物体内细胞的生长微环境仍然面临着很多困难;同样支架材料对脂肪来源干细胞成骨诱导之外的血管化及植入后的感染也是需要关注的问题。脂肪来源干细胞分化为内皮细胞的能力及支持其分化的支架,在支架设计过程中加入抗感染因素,是未来骨组织工程支架材料可以展开的方向。
作者贡献:张圣敏进行综述设计、资料收集及成文,刘超审校。
经费支持:该文章接受了“临床医学科技创新计划(201805052)”“沧州市科技计划项目(183302068)”的资助。所有作者声明,经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
利益冲突:文章的全部作者声明,在课题研究和文章撰写过程中不存在利益冲突。
写作指南:该研究遵守《系统综述和荟萃分析报告规范》(PRISMA指南)。
文章查重:文章出版前已经过专业反剽窃文献检测系统进行3次查重。
文章外审:文章经小同行外审专家双盲外审,同行评议认为文章符合期刊发稿宗旨。
文章版权:文章出版前杂志已与全体作者授权人签署了版权相关协议。
开放获取声明:这是一篇开放获取文章,根据《知识共享许可协议》“署名-非商业性使用-相同方式共享4.0”条款,在合理引用的情况下,允许他人以非商业性目的基于原文内容编辑、调整和扩展,同时允许任何用户阅读、下载、拷贝、传递、打印、检索、超级链接该文献,并为之建立索引,用作软件的输入数据或其它任何合法用途。
参考文献
[1] ULLAH I, SUBBARAO RB, RHO GJ. Human mesenchymal stem cells-current trends and future prospective. Biosci Rep. 2015;35:1-18.
[2] DING ZZ, FAN ZH, HUANG XW, et al.Bioactive natural protein–hydroxyapatite nanocarriers for optimizing osteogenic differentiation of mesenchymal stem cells.J Mater Chem B. 2016;B4:3555-3561.
[3] WANG Y, SUN N, ZHANG Y, et al.Enhanced osteogenic proliferation and differentiation of human adipose-derived stem cells on a porous n-HA/PGS-M composite scaffold.Sci Rep.2019;9(1):1-10.
[4] SATTARY M, RAFIENIA M, KAZEMI M, et al.Promoting effect of nano hydroxyapatite and vitamin D3 on the osteogenic differentiation of human adipose-derived stem cells in polycaprolactone/gelatin scaffold for bone tissue engineering. Mater Sci Eng C Mater Biol Appl.2019;97:141-155.
[5] AMJADIAN S, SEYEDJAFARI E, ZEYNALI B, et al.The synergistic effect of nano-hydroxyapatite and dexamethasone in the fibrous delivery system of gelatin and poly(l-lactide)on the osteogenesis of mesenchymal stem cells.Int J Pharm. 2016;507(1-2):1-11.
[6] MA B, HAN J, ZHANG S, et al.Hydroxyapatite nanobelt/polylactic acid Janus membrane with osteoinduction/barrier dual functions for precise bone defect repair.Acta Biomater. 2018;71:108-117.
[7] GAO L, HUANG Z, YAN S, et al. Sr-HA-graft-Poly(γ-benzyl-l-glutamate)Nanocomposite Microcarriers:Controllable Sr2+Release for Accelerating Osteogenenisis and Bony Nonunion Repair. Biomacromolecules. 2017;18(11):3742-3752.
[8] BOSTANCIOGLU RB, GURBUZ M, AKYUREKLI AG, et al. Adhesion profile and differentiation capacity of human adipose tissue derived mesenchymal stem cells grown on metal ion(Zn, Ag and Cu)doped hydroxyapatite nano-coated surfaces.Colloids Surf B.2017;155:415-428.
[9] CANCIANI E, DELLAVIA C, FERREIRA LM, et al.Human Adipose-Derived Stem Cells on Rapid Prototyped Three-Dimensional Hydroxyapatite/Beta-Tricalcium Phosphate Scaffold.J Craniofac Surg.2016;27(3):727-32.
[10] LI Q, WANG T, ZHANG GF, et al.A Comparative Evaluation of the Mechanical Properties of Two Calcium Phosphate/Collagen Composite Materials and Their Osteogenic Effects on Adipose-Derived Stem Cells. Stem Cells Int.2016; 2016:1-12.
[11] PARK H, KIM JS, OH EJ, et al.Effects of three-dimensionally printed polycaprolactone/β-tricalcium phosphate scaffold on osteogenic differentiation of adipose tissue-and bone marrow-derived stem cells.Arch Craniofac Surg.2018;19(3):181-189.
[12] LEE JW, CHU SG, KIM HT, et al.Osteogenesis of Adipose-Derived and Bone Marrow Stem Cells with Polycaprolactone/Tricalcium Phosphate and Three-Dimensional Printing Technology in a Dog Model of Maxillary Bone Defects.Polymers.2017;9(9):1-16.
[13] KURZYK A, OSTROWSKA B,?WI?SZKOWSKI W, et al.Characterization and Optimization of the Seeding Process of Adipose Stem Cells on the Polycaprolactone Scaffolds.Stem Cells Int.2019;13:373-384.
[14] JAHANGIR S, HOSSEINI S, MOSTAFAEI F, et al.3D-porousβ-tricalcium phosphate-alginate-gelatin scaffold with DMOG delivery promotes angiogenesis and bone formation in rat calvarial defects.J Mater Sci Mater Med.2018;30(1):1-14.
[15] MAHDAVI FS, SALEHI A, SEYEDJAFARI E, et al.Bioactive glass ceramic nanoparticles-coated poly(L-lactic acid)scaffold improved osteogenic differentiation of adipose stem cells in equine.Tissue Cell.2017; 49(5):565-572.
[16] DU J, XIE P, LIN S, et al.Time-phase Sequential Utilization of ADSCs on Mesoporous Bioactive Glass for Restoration of Critical Size Bone Defects.ACS Appl Mater Interfaces. 2018; 10(34):28340-28350.
[17] JING X, YIN W, TIAN H, et al.Icariin doped bioactive glasses seeded with rat adipose-derived stem cells to promote bone repair via enhanced osteogenic and angiogenic activities.Life Sci.2018;202:52-60.
[18] LONGWEI LV, YUNSONG L, PING Z, et al.The nanoscale geometry of TiO2 nanotubes influences the osteogenic differentiation of human adipose-derived stem cells by modulating H3K4trimethylation.Biomaterials. 2015;39:193-205.
[19] MALEC K, G?RALSKA J, HUBALEWSKA-MAZGAJ M, et al. Effects of nanoporous anodic titanium oxide on human adipose derived stem cells.Int J Nanomedicine. 2016;14(11):5349-5360.
[20] MOON BS, KIM S, KIM HE, et al.Hierarchical micro-nano structured Ti6Al4V surface topography via two-step etching process for enhanced hydrophilicity and osteoblastic responses.Mater Sci Eng C Mater Biol Appl. 2017;73:90-98.
[21] JIANG H, MA X, ZHOU W, et al.The Effects of Hierarchical Micro/Nano-Structured Titanium Surface on Osteoblast Proliferation and Differentiation Under Diabetic Conditions.Implant Dent.2017;26(2):263-269.
[22] LI Y, WANG W, LIU H, et al.Formation and in vitro/in vivo performance of"cortex-like"micro/nano-structured TiO2 coatings on titanium by micro-arc oxidation.Mater Sci Eng C Mater Biol Appl. 2018;87:90-103.
[23] ZHOU J, ZHAO L. Multifunction Sr, Co and F co-doped microporous coating on titanium of antibacterial, angiogenic and osteogenic activities.Sci Rep.2016;6:29069.
[24] KIM HS,KIM YJ,JANG JH,et al.Surface Engineering of Nanostructured Titanium Implants with Bioactive Ions.J Dent Res.2016;95(5):558-565.
[25] MARYCZ K, KRZAK J, MAR?DZIAK M, et al.The influence of metal-based biomaterials functionalized with sphingosine-1-phosphate on the cellular response and osteogenic differentiation potential of human adipose derived mesenchymal stem cells in vitro.J Biomater Appl.2016;30(10):1517-1533.
[26] HEO DN, KO WK, LEE HR, et al.Titanium dental implants surface-immobilized with gold nanoparticles as osteoinductive agents for rapid osseointegration.J Colloid Interface Sci. 2016; 469:129-137.
[27] YUNSONG L, XIAO ZH, YANG L, et al.Bi-Functionalization of a Calcium Phosphate-Coated Titanium Surface with Slow-Release Simvastatin and Metronidazole to Provide Antibacterial Activities and Pro-Osteodifferentiation Capabilities. PLoS One.2014;9(5):e97741.
[28] FAZEL ANVARI-YAZDI A, TAHERMANESH K, HADAVI SM, et al.Cytotoxicity assessment of adipose-derived mesenchymal stem cells on synthesized biodegradable Mg-Zn-Ca alloys. Mater Sci Eng C Mater Biol Appl. 2016;69:584-597.
[29] HOU X, QIN H, GAO H, et al.A systematic study of mechanical properties, corrosion behavior and biocompatibility of AZ31B Mg alloy after ultrasonic nanocrystal surface modification. Mater Sci Eng C Mater Biol Appl.2017;78:1061-1071.
[30]王薇,窦丽鑫,王宏远.生物活性玻璃骨修复支架材料的研究进展[J].中国颌面修复学杂志,2018,19(6):362-366.
[31] AHN TK, LEE DH, KIM TS.Modification of Titanium Implant and Titanium Dioxide for Bone Tissue Engineering.Adv Exp Med Biol.2018;1077:355-368.
[32] DEWEY MJ, JOHNSON EM, WEISGERBER DW, et al. Shape-fitting collagen-PLA composite promotes osteogenic differentiation of porcine adipose stem cells.J Mech Behav Biomed Mater.2019;95:21-33.
[33] TIFFANY AS, GRAY DL, WOODS TJ, et al.The inclusion of zinc into mineralized collagen scaffolds for craniofacial bone repair applications.Acta Biomater.2019;93:86-96.
[34] CALABRESE G, GIUFFRIDA R, FABBI C, et al. CollagenHydroxyapatite Scaffolds Induce Human Adipose Derived Stem Cells Osteogenic Differentiation In Vitro.PLoS One. 2016;11(3):e0151181.
[35] TOOSI S, NADERI-MESHKIN H, KALALINIA F, et al.Bone defect healing is induced by collagen sponge/polyglycolic acid.J Mater Sci Mater Med.2019;30(3):1-10.
[36] MAISANI M, ZIANE S, EHRET C, et al.A new composite hydrogel combining the biological properties of collagen with the mechanical properties of a supramolecular scaffold for bone tissue engineering. J Tissue Eng Regen Med.2018; 12(3):e1489-e1500.
[37] NEDJARI S, AWAJA F, ALTANKOV G.Three Dimensional Honeycomb Patterned Fibrinogen Based Nanofibers Induce Substantial Osteogenic Response of Mesenchymal Stem Cells.Sci Rep.2017;7(1):1-11.
[38] CHEN Y, ZHENG Z, ZHOU R, et al.Developing a Strontium-Releasing Graphene Oxide-/Collagen-Based Organic-Inorganic Nanobiocomposite for Large Bone Defect Regeneration via MAPK Signaling Pathway. ACS Appl Mater Interfaces.2019;11(17):15986-15997.
[39] SASAYAMA S, HARA T, TANAKA T, et al.Osteogenesis of Multipotent Progenitor Cells using the Epigallocatechin Gallate-Modified Gelatin Sponge Scaffold in the Rat Congenital Cleft-Jaw Model.Int J Mol Sci.2018;19(3803):1-16.
[40] GURUMURTHY B, BIERDEMAN PC, JANORKAR AV, et al.Composition of elastin like polypeptide-collagen composite scaffold influences in vitro osteogenic activity of human adipose derived stem cells. Dent Mater. 2016;32(10):1270-1280.
[41] KO E, LEE JS, KIM H, et al.Electrospun Silk Fibroin Nanofibrous Scaffolds with Two-Stage Hydroxyapatite Functionalization for Enhancing the Osteogenic Differentiation of Human Adipose-Derived Mesenchymal Stem Cells.ACS Appl Mater Interfaces.2018;10(9):7614-7625.
[42] WANG Z, LIN M, XIE Q, et al.Electrospun silk fibroin/poly(lactide-co-ε-caprolactone)nanofibrous scaffolds for bone regeneration.Int J Nanomedicine. 2016;11:1483-1500.
[43] RIBEIRO VP, SILVA-CORREIA J, NASCIMENTO AI, et al. Silk-based anisotropical 3D biotextiles for bone regeneration. Biomaterials.2017;123:92-106.
[44] PINA S, CANADAS RF, JIM?NEZ G, et al.Biofunctional Ionic-Doped Calcium Phosphates:Silk Fibroin Composites for Bone Tissue Engineering Scaffolding.Cells Tissues Organs. 2017;204(3-4):150-163.
[45] KALANI MM, NOURMOHAMMADI J, NEGAHDARI B, et al. Osteogenic potential of Rosuvastatin immobilized on silk fibroin nanofibers using argon plasma treatment. Biomed Mater.2018;14(2):1-35.
[46] KALANI MM, NOURMOHAMMADI J, NEGAHDARI B, et al.Electrospun core-sheath poly(vinyl alcohol)/silk fibroin nanofibers with Rosuvastatin release functionality for enhancing osteogenesis of human adipose-derived stem cells.Mater Sci Eng C Mater Biol Appl.2019;99:129-139.
[47] ARDESHIRYLAJIMI A, DELGOSHAIE M, MIRZAEI S, et al. Different Porosities of Chitosan Can Influence the Osteogenic Differentiation Potential of Stem Cells.J Cell Biochem.2018; 119(1):625-633.
[48] LIAO HT, TSAI MJ, BRAHMAYYA M, et al.Bone Regeneration Using Adipose-Derived Stem Cells in Injectable Thermo-Gelling Hydrogel Scaffold Containing Platelet-Rich Plasma and Biphasic Calcium Phosphate.Int J Mol Sci. 2018;19(2537):1-18.
[49] AKDERE?E, SHIKHALIYEVA?, G?M??DERELIO?LU M, et al.Boron mediated 2D and 3D cultures of adipose derived mesenchymal stem cells. Cytotechnology. 2019;71(2):611-622.
[50] WU H, LEI P, LIU G, et al.Reconstruction of Large-scale Defects with a Novel Hybrid Scaffold Made from Poly(L-lactic acid)/Nanohydroxyapatite/Alendronate-loaded Chitosan Microsphere:in vitro and in vivo Studies.Sci Rep.2017;7(1):1-14.
[51] ZHANG S, MA B, LIU F, et al.Polylactic Acid Nanopillar Array-Driven Osteogenic Differentiation of Human Adipose-Derived Stem Cells Determined by Pillar Diameter.Nano Lett.2018; 18(4):2243-2253.
[52] TAVANGAR B, ARASTEH S, EDALATKHAH H, et al.Hardystonite-coated poly(l-lactide)nanofibrous scaffold and efficient osteogenic differentiation of adipose-derived mesenchymal Stem Cel s.Artif Organs.2018;42(11):E335-E348.
[53] BAGESHLOOYAFSHAR B, VAKILIAN S, KEHTARI M, et al. Zinc silicate mineral-coated scaffold improved in vitro osteogenic differentiation of equine adipose-derived mesenchymal stem cells.Res Vet Sci.2019;124:444-451.
[54] KARIMI Z, SEYEDJAFARI E, MAHDAVI FS.Baghdadite nanoparticle-coated poly l-lactic acid(PLLA)ceramics scaffold improved osteogenic differentiation of adipose tissue-derived mesenchymal stem cells. J Biomed Mater Res A. 2019;107(6):1284-1293.
[55] MA S, WANG Z, GUO Y. Enhanced osteoinduction of electrospun scaffolds with assemblies of hematite nanoparticles as a bioactive interface.Int J Nanomedicine. 2019;14:1051-1068.
[56] HAJIHASANI BIOUKI M, MOBEDI H, KARKHANEH A, et al.Development of a simvastatin loaded injectable porous scaffold in situ formed by phase inversion method for bone tissue regeneration.Int J Artif Organs.2019; 42(2):72-79.
[57] WANG W, CAETANO G, AMBLER WS, et al.Enhancing the Hydrophilicity and Cell Attachment of 3D Printed PCL/Graphene Scaffolds for Bone Tissue Engineering. Materials(Basel).2016;9(992):1-11.
[58] WANG W, JUNIOR JRP, NALESSO PRL, et al.Engineered 3D printed poly(?-caprolactone)/graphene scaffolds for bone tissue engineering.Mater Sci Eng C Mater Biol Appl. 2019; 100:759-770.
[59] KASHEF-SABERI MS, ROODBARI NH, PARIVAR K, et al. Enhanced Osteogenic Differentiation of Mesenchymal Stem Cells on Electrospun PES/PVA/PRP Nanofibrous Scaffolds. ASAIO J.2018;64(5):e115-e122.
[60] HEYDARI ASL S, HOSSEINPOOR H, PARIVAR K, et al. Physical stimulation and scaffold composition efficiently support osteogenic differentiation of mesenchymal stem cells. Tissue Cell.2018;50:1-7.
[61]徐竹,诸葛启钏,黄李洁.干细胞3D支架的研究进展[J].中国生物工程杂志,2017,37(9):112-117.
[62] 党莹,李月,李瑞玉.骨组织工程支架材料在骨缺损修复及3D打印技术中的应用[J].中国组织工程研究,2017,21(14):2266-2273.





