摘要:增材制造技术突破了传统模具加工工艺的限制, 可用于高效个性化定制生物医用材料。近年来, 医学上对骨骼修复和移植的个性化需求显着增加, 增材制造可满足该定制化的需求, 促使增材制造技术在生物医用材料领域占据重要地位。随着材料科学技术和计算机辅助技术 (CAD/CAM) 的发展, 可用于增材制造的生物植入材料不再局限于钛系、钽系、钴铬钼等合金, 聚醚醚酮、磷酸钙盐等非金属类材料因良好的生物相容性也得到了广泛应用, 增材制造技术制备仿生人造骨植入体成为新的研究热点。本文介绍了增材制造技术的原理, 对激光、电子束、光固化等增材制造技术进行了比较, 并阐述了增材制造在生物植入体和医疗器械方面的应用现状, 对增材制造技术在医疗领域的应用及发展做了展望。
关键词:增材制造; 生物材料; 植入体; 研究进展;
作者简介: *刘世锋 E-mail: Liushifeng66@126.com;
收稿日期:2018-10-24
基金: 国家自然科学基金资助项目 (51671152, 51874225);
Research progress on preparation of biological implant materials by additive manufacturing
ZHANG Guang-xi LIU Shi-feng YANG Xin SHI Ming-jun REN Yao-jia
School of Metallurgical Engineering, Xi'an University of Architecture and Technology Faculty of Materials Science and Engineering, Xi'an University of Technology
Abstract:Additive manufacturing technology breaks through the limitations of traditional mold processing technology, and it is an important method for the efficiently customizing biomedical materials. Recently, the personalization needs of medical bone repair and transplantation have increased significantly. The customized and individualized advantages gradually promote the additive manufacturing technology to play an important role in the field of biomedical materials. With the development of materials science and computer aided technology (CAD/CAM) , the biological implant materials used for additive manufacturing are no longer limited to the alloys such as titanium alloys, tantalum alloys, and vitallium. Because of good biocompatibility, the non-metal materials such as polyetheretherketone (PEEK) and calcium phosphate are widely used in biomaterials. The preparation of artificial bone implants by additive manufacturing technology has become a new research hotspot. The principle of additive manufacturing technology was reviewed, and the manufacturing techniques by laser, electron beam, and photocuring were compared in this paper. The application status of additive manufacturing in biological implants and medical devices was introduced, and the development prospects of additive manufacturing technology in medical field were prospected.
Keyword:additive manufacturing; biomaterials; implants; research progress;
Author: LIU Shi-feng E-mail: Liushifeng66@126.com;
Received: 2018-10-24
增材制造(additive manufacturing, AM)又名3D打印,是通过计算机建立三维模型,再由打印设备将材料逐点堆积、层层叠加[1,2],最终得到个性化产品的新型制备工艺。该制备工艺成型效率高,原料利用率高,所得成型件表面干洁,且在成型过程中主动可控,能够得到控形控性的个性化产品,受到生物医学领域科研工作者的广泛青睐。近年来,骨骼修复和重建对仿生人造骨的需求显着增加,利用增材制造技术制备生物植入体已成为主要技术手段。目前,增材制造用金属材料主要包括钛及钛合金、铁及铁合金、镁及镁合金、形状记忆合金、钴基合金、贵金属、纯金属(钽、铌、锆)等七大类,增材制造用非金属类主要包括生物陶瓷材料和新兴的聚醚醚酮高分子材料[3]。本文介绍了增材制造技术的原理,对激光、电子束、光固化等增材制造技术进行了比较,并阐述了增材制造在生物植入体和医疗器械方面的应用现状,对增材制造技术在医疗领域的应用及发展做了展望。
1 增材制造技术原理
在增材制造过程中,首先通过计算机建模,然后利用快速成型辅助设计软件对三维模型进行修复、添加支撑、切片,随后将数据导入成型设备,最后经逐层固化制备得到各种几何形状的实体零件。目前,增材制造技术主要包括光固化成型(stereo lithography apparatus, SLA)、熔融沉积成型(fused deposition modeling, FDM)、选择性激光烧结(selective laser sintering, SLS)、选择性激光熔融(selective laser melting, SLM)、电子束熔融成型(selective electron beam melting, SEBM)、三维喷印(three dimension printing, 3DP)及分层实体制造(laminated object manufacturing, LOM)[2],不同增材制造技术工艺特点如表1所示。以选择性激光熔融(selective laser melting, SLM)制备金属零件为例,其成形原理如图1所示,将经Materialise Magics软件处理过的Creo模型数据以STL格式导入计算机系统,分成若干层二维平面数据,利用计算机控制激光束按照指定路径扫描,工作台上的金属粉末在激光产生的高温下熔融并相互黏接,一层扫描完毕后工作台下移,使新的粉末原料铺到固化表层,继续按计算机指定路径逐层扫描黏接,最终获得定制型产品[4]。
表1 增材制造技术工艺特点

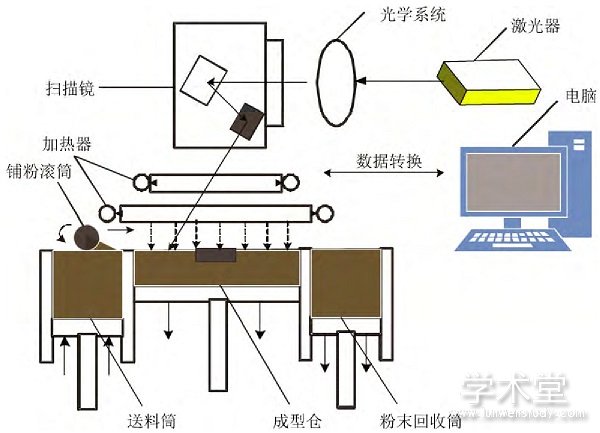
图1 选择性激光熔融成形原理示意图[4]
Fig.1 Schematic of the selective laser melting process[4]
2 生物医用植入体用增材制造材料
随着医疗水平的提升,对个性化仿生人造骨的需求显着增多,可通过增材制造技术制备的人造骨几乎涵盖了人体的各个部位,包括颌面修复及整形、融合器、人工椎体及人工关节(髋臼杯、胫骨平台、垫块)等。图2为增材制造在生物医疗仿生人造骨领域的主要应用部位,所用的植入体材料包括金属、陶瓷及高分子(聚醚醚酮)等诸多材料体系。
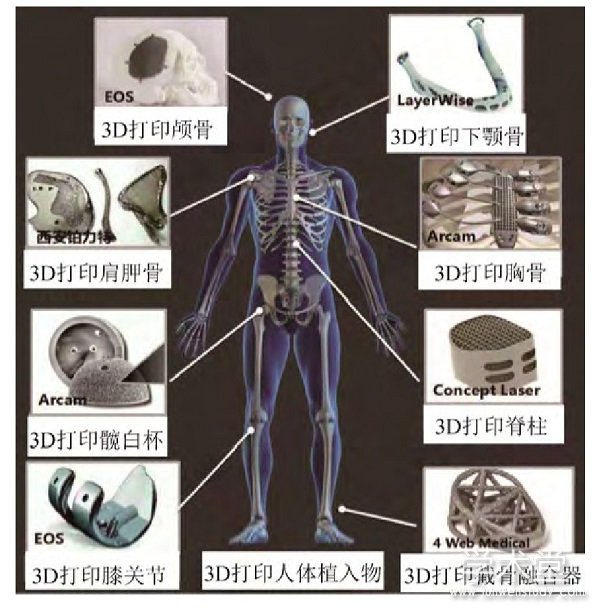
图2 增材制造植入体应用部位[3]
Fig.2 Application of implants by additive manufacturing[3]
2.1 金属材料
钛(Ti)系、钽(Ta)系及钴铬钼(Co Cr Mo)系合金因优异的耐蚀性、抗疲劳性、摩擦磨损性和良好的生物相容性,被广泛应用于生物医用植入体中[9]。Zhou等[10]研究了Ta质量分数分别为10%、30%、70%的Ti?Ta合金的耐腐蚀性、耐磨性和生物相容性,并与纯Ti和低间隙Ti?6Al?4V (ELI)对比,发现Ti?Ta合金耐磨性更优,且与纯Ti一样无毒,表明Ti?Ta合金在生物医学应用中具有良好前景。Kopova等[11]研究了Fe、Si元素对β-钛合金(Ti?35Nb?7Zr?6Ta)的影响,发现添加质量分数为0.5%Si和2%Fe的Ti?35Nb?7Zr?6Ta?2Fe?0.5Si合金弹性模量与人体骨相近,体外细胞培养表明骨诱导性能优异。施凤伟等[12]利用3D打印技术制造出与患者锁骨和肩胛骨呈1:1比例的钛合金假体,并成功植入到骨肿瘤患者体内,完成了3D打印个性化骨骼修复肩胛带不定性骨重建。Yang等[13]用钛合金材料3D打印定制化19 cm人工椎体,并成功植入患者,后期复查恢复良好。
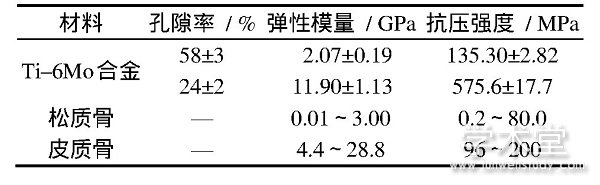
人体骨的弹性模量约为10~30 GPa,高致密度钛钽系合金的弹性模量约为55~191 GPa,与人体骨不匹配,易导致载荷从植入体到相邻骨组织之间传递中断,产生应力屏蔽,造成种植体松动或断裂[14,15]。为避免应力屏蔽现象,可通过控制孔隙率来调整材料强度和弹性模量[16],同时多孔结构有利于植入体周围细胞长入,诱导新骨生成,加强植入体与人体组织有效联合,使植入体骨整合性能更优异[17,18]。多孔材料的性能受孔隙率、孔径大小、孔隙分布及孔的连通性等影响显着,增材制造技术可灵活调节这些参数来制备具有不同力学性能的多孔材料[19,20,21]。杨广宇等[22]用电子束熔融成型技术制备了具有不同孔结构的Ti?5Ta?30Nb?7Zr医用合金,并对其力学性能和样品周围细胞的生长形态进行研究,发现电子束熔融成型能够灵活调控孔的性质,使植入体力学性能与人体骨匹配良好,且植入体的仿生骨小梁结构为细胞提供了良好的生长环境。Wauthle等[23]采用选择性激光熔融技术制备了互相连通的多孔纯Ta植入体,孔隙率为80%,屈服强度为12.7 MPa,疲劳极限为7.35 MPa,弹性模量为1.22 GPa,且具有韧性变形机制,综合性能与松质骨匹配,通过大鼠股骨缺损修复实验发现骨再生性和生物力学相容性良好,表明选择性激光熔融技术可以制造力学性能优异的高孔隙纯Ta矫形外科植入物。Balla等[24]研究发现可通过激光3D打印法调整多孔钽的孔隙率在27%~55%之间,使定制的多孔钽杨氏模量和屈服强度与人类皮质骨相近,分别处于2~20 GPa和100~746 MPa范围内,通过人胎儿成骨细胞培养实验发现,多孔Ta表面上有蛋白质高度表达及细胞生长、分化,表明生物相容性优异,可用于人体植入体。颉芳霞等[25]研究了选择性激光烧结法制备的多孔Ti?6Mo合金孔隙率与力学性能(弹性模量和抗压缩强度)的关系,并与人体骨力学性能对比,如表2所示,58%高孔隙率的Ti?6Mo合金弹性模量与松质骨相匹配,且强度优于松质骨;24%低孔隙率的Ti?6Mo合金性能优于皮质骨,表明多孔Ti?6Mo合金可用作人体骨的有效替代材料。
表2 Ti?6Mo合金与人体骨力学性能对比[25]
Co Cr Mo合金在口腔个体化修复中被广泛应用,作为口腔修复材料,CoCrMo合金不仅具有良好的生物相容性、耐疲劳性、抗腐蚀性及综合力学性能,还具有优异的耐磨性[26]。Schwindling等[27]分别用选择性激光熔融技术与铸造成型技术制备了CoCr合金,在模拟牙齿咀嚼环境下,对合金摩擦磨损和硬度做了对比研究,结果表明选择性激光熔融制备的CoCr合金性能更优异。张国庆等[28]对比了选择性激光熔融技术制备的CoCrMo合金和316L不锈钢,发现Co Cr Mo合金的摩擦性能更优异。Chiba等[29]对Co Cr Mo合金微观组织进行研究,发现晶粒细化容易诱发马氏体相变,使Co Cr Mo合金耐磨性增强,从而解释了选择性激光熔融制备CoCrMo合金耐磨性优异的原因。
2.2 陶瓷材料
以羟基磷灰石(hydroxy apatite, HA)和磷酸三钙(tricalcium phosphate, TCP)为代表的陶瓷材料由于骨传导性能优异,可不同程度融入宿主骨,被广泛用作骨替代材料[30]。羟基磷灰石是脊椎动物骨骼和牙齿的主要成分,理论密度为3.156 g?cm?3,莫氏硬度为5,和人体骨骼晶体成分及结构组成相似,因而相比于其他生物陶瓷材料被广泛应用[31]。Warnke等[32]对三维喷印制备的多孔结构羟基磷灰石支架进行细胞黏附培养实验,发现细胞在支架表面生长增殖良好,表明支架生物相容性良好。磷酸三钙也是骨骼的主要成分,该植入体材料不仅能在患者体内降解、与新骨融合,而且还能提供丰富的Ca、P元素促进新骨形成,因此,以磷酸三钙为基础的人工骨支架材料得到广泛的研究和应用[30]。庄静宇[33]通过调节选择性激光烧结中的激光能量密度,制备了与人体骨力学性能相近的磷酸三钙三维多孔人工骨支架,通过模拟体液和细胞黏附实验发现该多孔支架具有良好的生物相容性和生物降解性。此外,陶瓷材料还应用于整形外科领域中颌骨的修复与重建。Saijo等[34]使用喷墨3D打印机,根据患者颌面特征1:1定制了个性化α-TCP颌面骨,并通过手术植入颌面部畸形患者体内,经计算机断层扫描分析检测,发现人造骨与宿主骨组织之间形成部分结合,为3DP制备α-TCP定制人造骨的进一步临床研究提供了支持。连芩等[35]采用光固化原型工艺制备了双管道聚乳酸(polylactic acid, PLA)/β-TCP复合材料生物陶瓷支架,初级管道适合细胞附着、组织的长入和营养物质的代谢活动,次级管道通过填充PLA增强支架总体的力学强度;与单管道多孔β-TCP支架作对比后发现,其力学压缩实验最大压缩强度为(21.25±1.15) MPa,明显高于单管道支架(9.76±0.64) MPa,为解决多孔生物陶瓷支架力学性能差的问题提供了可行方案。
陶瓷材料多孔结构的骨引导性能优异,能为成骨细胞提供适宜生长的三维环境,促进新骨形成,但脆性大,不能用作承重材料[36]。多孔钛钽系合金综合力学性能良好,但本身为惰性材料,表面骨引导性能和生物相容性有待加强。因此,以多孔钛钽系合金为基体,用羟基磷灰石进行表面改性处理,既保证了植入体优良的力学性能,又能保证优异的生物相容性[14,36]。李祥等[37]用Unigraphix NX软件设计出用作支撑结构的多孔钛支架,然后通过选择性激光熔融制备出成型件,根据冷冻干燥技术在支架孔隙内制备出微孔壳聚糖/羟基磷灰石(chitosan/hydroxyapatite, CH/HA)海绵状结构,与孔隙结合形成力学性能和细胞亲和性能良好的复合多孔生物支架,为细胞的黏附生长和新骨形成营造了理想的微环境。
2.3 聚醚醚酮材料
聚醚醚酮(polyetheretherketone, PEEK)仿生人造骨生物相容性、耐磨性、化学稳定性良好,而且杨氏模量、屈服强度和热导性与人工骨相近,是理想的人体骨替换材料[38,39]。PEEK材料质量轻(密度仅为1.3 g?cm?3),避免了多孔化处理,而且在计算机断层扫描(computed tomography, CT)、B超及核磁共振等检查中弱显影,防止伪影干扰,同时可被X射线穿透,具有良好的可视性,可以在CT扫描或核磁共振成像辅助下精确定位,术后方便跟踪骨生长和愈合过程[40]。云南大学报报道的陈英涛等[41]3D打印出PEEK胡桃夹子模型,并根据有限元数值模拟技术在不同环境下对其安全性展开仿真分析,研究结果证实了PEEK仿生人造骨材料的安全性,然后根据胡桃夹子综合症患者的病理特征,使用高温热熔积式3D打印设备设计了个性化PEEK胡桃夹子并成功植入患者体内,术后跟踪检查良好。
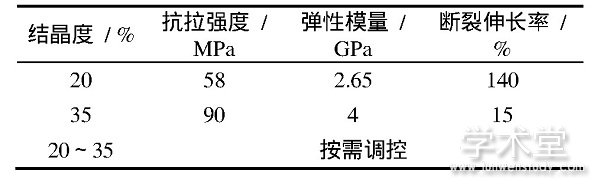
熔融沉积成型技术无需使用激光器且后处理简单,与PEEK材料结合制造人工骨是一项极具潜力的方法。PEEK在熔融沉积成型过程中存在晶态区晶体融化和结晶过程,表3为不同结晶度PEEK材料的力学性能。人体骨组织外层为刚度大、硬度高的皮质骨,内层为密度小、富有弹性的松质骨,因此要求植入体材料也具有类似仿生的功能梯度性。利用熔融沉积成型技术,通过全局控温、局部调温及热后处理调控PEEK植入体的整体或局部结晶度,形成功能梯度,满足不同的功能要求,实现功能一体化,从而实现复杂PEEK植入体的控形控性,达到低成本熔融沉积快速成型[42]。
表3 PEEK材料不同结晶度的力学性能[42]
3 医疗辅助器械用增材制造材料
通过增材制造技术可制备多种个性化医疗器械及模型,例如:假肢、牙齿矫正器、齿科手术模板、人体组织模型、个性化导航模板等[43]。术前可根据患者的计算机断层扫描、核磁共振等影像学资料,利用增材制造技术打印出需要的人体器官、骨骼等,通过有效观察,仿真操作和模拟复杂手术过程来提高实际手术的精确性和安全性[44,45,46]。Lan等[47]根据患者病理特征,通过计算机断层扫描和核磁共振成像,重建多色三维颅脑影像,并利用三维喷印制备具有高度代表性的质地逼真、富有弹性的中空动脉瘤模型,该颅脑动脉瘤模型清晰地显示了动脉瘤与周围组织间的空间关系,可用于术前模拟,以确定最佳手术方式,避免脑功能受损。此外,针对不同手术类型,外科医生需要个性化手术工具来精确控制手术过程,简化手术操作,提高手术效率[43]。传统个性化手术工具通常加工周期长,模具制备繁琐,相比之下,增材制造技术具有高效、无需加工的优势。
4 结论与展望
利用增材制造技术制备生物医用材料已成主要技术手段,且随着科技的发展,增材制造生物医用材料将呈现出精密化、智能化、通用化以及便捷化的特点。但增材制造生物植入体与人体相容性及安全性的协调和改善,仍将是科研工作者的努力方向,增材制造过程中材料特性的调控与工艺的融合仍需持续研究。目前来看,钛及钛合金仍将持续占据增材制造生物材料领域的制高点,随着增材制造技术的成熟与深入,钽及钽合金、聚醚醚酮材料等将成为医学领域的强力推力,其它新型植入物(结构功能一体化多孔材料、轻量化仿生结构材料等)也将得到广泛开发与应用。
参考文献
[1]Malik H H, Darwood A R, Shaunak S, et al.Three-dimensional printing in surgery:a review of current surgical applications.J Surg Res, 2015, 199 (2) :512
[2]Wang L, Dai K R.Individualized treatment of orthopaedics and 3D printing technology.J Med Biomech, 2014, 29 (3) :193 (王燎, 戴尅戎.骨科个体化治疗与3D打印技术.医用生物力学, 2014, 29 (3) :193)
[3]Han Q Y, Li S P, Xiao X F, et al.3D printing:The application in medicine devices.Sci Technol Rev, 2017, 35 (2) :72 (韩倩宜, 李淑萍, 肖雄夫, 等.3D打印技术在植入式医疗器械中的应用.科技导报, 2017, 35 (2) :72)
[4]Shi Y S, Yan C Z, Wei Q S, et al.Polymer based composites for selective laser sintering 3D printing technology.Sci China Inf Sci, 2015, 45 (2) :204 (史玉升, 闫春泽, 魏青松, 等.选择性激光烧结3D打印用高分子复合材料.中国科学 (信息科学) , 2015, 45 (2) :204)
[5]Scalera F, Corcione C E, Montagna F, et al.Development and characterization of UV curable epoxy/hydroxyapatite suspensions for stereolithography applied to bone tissue engineering.Ceram Int, 2014, 40 (10) :15455
[6] Wang H J, Cui Z W, Sun F, et al.Superalloy GH4169complicated components prepared by selective laser melting forming technique.Powder Metall Technol, 2016, 34 (5) :368 (王会杰, 崔照雯, 孙峰, 等.激光选区熔化成形技术制备高温合金GH4169复杂构件.粉末冶金技术, 2016, 34 (5) :368)
[7] Wu H, Ren J Y, Huang Q L, et al.Effect of laser parameters on microstructure, metallurgical defects and property of AlSi10Mg printed by selective laser melting.JMicromech Mol Phys, 2017, 2 (4) :5
[8] He C L, Tang Z H, Tian H Y, et al.Progress in the development of biomedical polymer materials fabricated by 3-dimensional printing technology.Acta Polym Sin, 2013 (6) :722 (贺超良, 汤朝晖, 田华雨, 等.3D打印技术制备生物医用高分子材料的研究进展.高分子学报, 2013 (6) :722)
[9]Liu C, Kong X J, Wu S W, et al.Research on powder injection molding of Ti6Al4V alloys for biomedical application.Powder Metall Technol, 2018, 36 (3) :217 (刘超, 孔祥吉, 吴胜文, 等.生物医用Ti6Al4V合金粉末注射成形工艺研究.粉末冶金技术, 2018, 36 (3) :217)
[10]Zhou Y L, Niinomi M, Akahori T, et al.Corrosion resistance and biocompatibility of Ti-Ta alloys for biomedical applications.Mater Sci Eng A, 2005, 398 (1) :28
[11]Kopova I, Strásk?J, Harcuba P, et al.Newly developed Ti-Nb-Zr-Ta-Si-Fe biomedical beta titanium alloys with increased strength and enhanced biocompatibility.Mater Sci Eng C, 2016, 60:230
[12]Shi F W, Fu J, Guo Z.The application of 3D printing technique in the oncology teaching of orthopedics.Chin JMed Educ, 2015, 35 (6) :916 (施凤伟, 付军, 郭征.3D打印技术在骨科学肿瘤教学中的应用.中华医学教育杂志, 2015, 35 (6) :916)
[13] Yang J, Cai H, LüJ, et al.In vivo study of a self-stabilizing artificial vertebral body fabricated by electron beam melting.Spine, 2014, 39 (8) :486
[14]Hu H B, Liu H Q, Wang J E, et al.Research progress of biomedical porous titanium and its alloys.Mater Rev, 2012, 26 (19) :262 (胡海波, 刘会群, 王杰恩, 等.生物医用多孔钛及钛合金的研究进展.材料导报, 2012, 26 (19) :262)
[15]Liu C, Kong X J, Wu S W, et al.Research progress on metal injection molding of titanium and titanium alloys.Powder Metall Technol, 2017, 35 (2) :150 (刘超, 孔祥吉, 吴胜文, 等.钛及钛合金金属粉末注射成形技术的研究进展.粉末冶金技术, 2017, 35 (2) :150)
[16]Li S J, Li X K, Hou W T, et al.Fabrication of open-cellular (porous) titanium alloy implants:osseointegration, vascularization and preliminary human trials.Sci China Mater, 2018, 61 (4) :525
[17] Palmquist A, Snis A, Emanuelsson L, et al.Long-term biocompatibility and osseointegration of electron beam melted, free-form-fabricated solid and porous titanium alloy:experimental studies in sheep.J Biomater Appl, 2013, 27 (8) :1003
[18]Shivaram A, Bose S, Bandyopadhyay A.Understanding long-term silver release from surface modified porous titanium implants.Acta Biomater, 2017, 58:550
[19]Taniguchi N, Fujibayashi S, Takemoto M, et al.Effect of pore size on bone ingrowth into porous titanium implants fabricated by additive manufacturing:An in vivo experiment.Mater Sci Eng C, 2016, 59:690
[20]Wauthle R, Ahmadi S M, Yavari S A, et al.Revival of pure titanium for dynamically loaded porous implants using additive manufacturing.Mater Sci Eng C, 2015, 54:94
[21]Butscher A, Bohner M, Hofmann S, et al.Structural and material approaches to bone tissue engineering in powder-based three-dimensional printing.Acta Biomater, 2011, 7 (3) :907
[22] Yang G Y, Tang H P, Liu N, et al.Fabrication and characterization of Ti?5Ta?30Nb?7Zr biomedical porous alloy by selective electron beam melting.Titanium Ind Prog, 2017, 34 (1) :33 (杨广宇, 汤慧萍, 刘楠, 等.Ti?5Ta?30Nb?7Zr合金医用多孔材料的电子束选区熔化成形及表征.钛工业进展, 2017, 34 (1) :33)
[23]Wauthle R, van der Stok J, Yavari S A, et al.Additively manufactured porous tantalum implants.Acta Biomater, 2015, 14:217
[24]Balla V K, Bodhak S, Bose S, et al.Porous tantalum structures for bone implants:Fabrication, mechanical and in vitro biological properties.Acta Biomater, 2010, 6 (8) :3349
[25] Jie F X, He X M, Yu J H, et al.Structural characteristics and mechanical behavior of selective laser sintered porous Ti?6Mo alloy for biomedical applications.Rare Met Mater Eng, 2016, 44 (6) :1477 (颉芳霞, 何雪明, 俞经虎, 等.生物医用多孔Ti?6Mo合金选择性激光烧结的结构特征和力学行为.稀有金属材料与工程, 2016, 45 (6) :1477)
[26]Lin H, Yang Y Q, Zhang G Q, et al.Tribological performance of medical CoCrMo alloy fabricated by selective laser melting.Acta Opt Sin, 2016 (11) :1114003-1 (林辉, 杨永强, 张国庆, 等.激光选区熔化医用钴铬钼合金的摩擦性能.光学学报, 2016, 36 (11) :1114003-1)
[27] Schwindling F S, Seubert M, Rues S, et al.Two-body wear of CoCr fabricated by selective laser melting compared with different dental alloys.Tribol Lett, 2015, 60 (2) :25
[28]Zhang G Q, Yang Y Q, Lin H, et al.Study on tribology performance of CoCrMo alloy parts manufactured by selective laser melting.Chin J Lasers, 2016, 43 (8) :167 (张国庆, 杨永强, 林辉, 等.激光选区熔化成型Co Cr Mo合金摩擦学性能研究.中国激光, 2016, 43 (8) :167)
[29]Chiba A, Kumagai K, Nomura N, et al.Pin-on-disk wear behavior in a like-on-like configuration in a biological environment of high carbon cast and low carbon forged Co-29Cr-6Mo alloys.Acta Mater, 2007, 55 (4) :1309
[30] Yu Q, Tian J.Application of three-dimensional printing technique in manufacturing scaffolds for bone tissue engineering.J Clin Rehabil Tissue Eng Res, 2015, 19 (30) :4870 (于强, 田京.构建骨组织工程支架中应用的3D打印技术.中国组织工程研究, 2015, 19 (30) :4870)
[31] Cao X.Research of Biomimetic Preparation and Characterization of Hydroxyap Coating on Titanium Matrix Surface[Dissertation].Xi’an:Shaanxi University of Science and Technology, 2015 (曹鑫.钛基羟基磷灰石涂层的仿生制备与性能研究[学位论文].西安:陕西科技大学, 2015)
[32]Warnke P H, Seitz H, Warnke F, et al.Ceramic scaffolds produced by computer-assisted 3D printing and sintering:Characterization and biocompatibility investigations.JBiomed Mater Res B, 2010, 93 (1) :212
[33]Zhuang J Y.Study on Preparation of TCP Scaffold via Selective Laser Sintering[Dissertation].Changsha:Central South University, 2013 (庄静宇.选择性激光烧结制备磷酸三钙人工骨支架的研究[学位论文].长沙:中南大学, 2013)
[34]Saijo H, Igawa K, Kanno Y, et al.Maxillofacial reconstruction using custom-made artificial bones fabricated by inkjet printing technology.J Artif Organs, 2009, 12 (3) :200
[35] Lian Q, Zhuang P, Li C H, et al.Mechanical properties of polylactic acid/β-tricalcium phosphate composite scaffold with double channels based on three-dimensional printing technique.Chin J Rep Reconstr Surg, 2014, 28 (3) :309 (连芩, 庄佩, 李常海, 等.3D打印双管道聚乳酸/β-磷酸三钙生物陶瓷复合材料支架的力学性能研究.中国修复重建外科杂志, 2014, 28 (3) :309)
[36]Zou L M, Yang C, Li Y Y.Research progress on preparing Ti-based biomedical materials by powder metallurgy.Mater Rev, 2011, 25 (15) :82 (邹黎明, 杨超, 李元元.粉末冶金法制备钛基生物医学材料的研究进展.材料导报, 2011, 25 (15) :82)
[37] Li X, Feng C D, Wang L, et al.Fabrication and in vitro biocompatibility of porous Ti/chitason/hydroxyapatite composite scaffold.Chin J Orthop Trauma, 2016, 18 (1) :6 (李祥, 冯辰栋, 王林, 等.3D打印多孔钛/壳聚糖/羟基磷灰石复合支架的制备与体外生物相容性研究.中华创伤骨科杂志, 2016, 18 (1) :6)
[38] Song J, Wang S, Liao Z H, et al.The research progress offriction and wear properties of polyetheretherketone and its modified materials for artificial joints.J Funct Mater, 2014, 45 (23) :23010 (宋剑, 王松, 廖振华, 等.聚醚醚酮及其改性的人工关节材料的摩擦磨损性能研究进展.功能材料, 2014, 45 (23) :23010)
[39] Zhang Y.Thermodynamic Simulation and Experiment of3D Printing of Bionic Artificial Bone with Polyetheretherketone (PEEK) [Disseration].Changchun:Jilin University, 2014 (张钰.聚醚醚酮仿生人工骨3D打印热力学仿真及实验研究[学位论文].长春:吉林大学, 2014)
[40]Tan L X, Liu Y X, Chen R M, et al.Multi-point flexible molding for personalized PEEK skull repair.J Xi'an Jiaotong Univ, 2016, 50 (8) :130 (谭力新, 刘亚雄, 陈若梦, 等.个性化聚醚醚酮颅骨植入物多点柔性注塑工艺.西安交通大学学报, 2016, 50 (8) :130)
[41] Yunnan Daxue Bao.The world's first 3D printed PEEKimplant for the treatment of nutcracker syndrome was completed successfully by Yunnan University and Air Force Military Medical University[J/OL].Yunnan Daxue Bao (2018?03?07) [2018?07?18].http://ynunews.cuepa.cn/show_more.php?doc_id=2381274 (云南大学报.云南大学联合空军军医大学成功实现世界首例3D打印PEEK植入体用于胡桃夹综合症治疗[J/OL].云南大学报 (2018?03?07) [2018?07?18].http://ynunews.cuepa.cn/show_more.php?doc_id=2381274)
[42]Yang C C, Tian X Y, Li D C, et al.Influence of thermal processing conditions in 3D printing on the crystallinity and mechanical properties of PEEK material.J Mater Process Technol, 2017, 248:1
[43] Wang J, Huang H, Wang S Y, et al.Shoulder hemiarthroplasty assisted by individualized navigation templates 3D printed.Chin J Orthop Trauma, 2017, 19 (7) :596 (王均, 黄河, 王少云, 等.3D打印个体化导航模板辅助半肩置换的有效性和精确性.中华创伤骨科杂志, 2017, 19 (7) :596)
[44]Liu F Z, Liu M X, Wang Y H, et al.Research progress on application of 3D printing technology in medical field.Mater China, 2016, 35 (5) :381 (刘凤珍, 刘明信, 王运华, 等.3D打印技术在医学领域中的应用研究进展.中国材料进展, 2016, 35 (5) :381)
[45] Tam M D, Laycock S D, Bell D, et al.3D printout of a DICOM file to aid surgical planning in a 6 year old patient with a large scapular osteochondroma complicating congenital diaphyseal aclasia.J Radiol Case Rep, 2012, 6 (1) :31
[46] Waran V, Narayanan V, Karuppiah R, et al.Utility of multimaterial 3D printers in creating models with pathological entities to enhance the training experience of neurosurgeons.J Neurosurg, 2014, 120 (2) :489
[47] Lan Q, Chen A, Zhang T, et al.Development of three-dimensional printed craniocerebral models for simulated neurosurgery.World Neurosurg, 2016, 91:434





