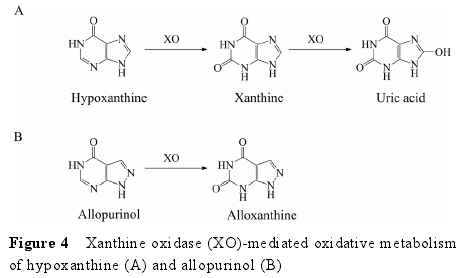
4.1 底物类型 XO 也是一类存在于胞浆中的钼?黄素蛋白, 与 AO 具有高度同源性。不同的是, AO 主要分布在脑和肝中, 而 XO 主要存在于小肠中[6].除了催化一些化合物的还原过程外[40], XO 的主要功能为催化嘌呤类化合物的代谢。例如, XO 催化次黄嘌呤(hypoxanthine) 氧化形成黄嘌呤 (xanthine), 进一步催化黄嘌呤形成尿酸 (uric acid)[6](图 4A)。此外, XO也可以催化别嘌呤醇 (allopurinol) 氧化形成别黄嘌呤 (alloxanthine)[6](图 4B)。
4.2 药物相互作用 别嘌呤醇是 XO 的经典抑制剂,临床上可以用于治疗体内尿酸过多引起的高尿酸血症及痛风[67, 68].此外, 文献报道的 XO 抑制剂还有甲氨蝶呤和奥昔嘌醇[1, 69]等。Barr 等[70]报道在由人的肝组织制备肝胞浆的过程中会使用含有别嘌呤醇的肝灌流液, 别嘌呤醇在 AO 作用下产生大量奥昔嘌醇(图 3C), 奥昔嘌醇显着抑制 XO 活性, 因此作者认为在利用人肝胞浆进行 XO 底物筛查实验前应先利用阳性底物考察人肝胞浆是否具有 XO 活性, 避免出现假阴性结果。XO 是一种可以被诱导的酶。文献报道干扰素、细菌脂多糖和 TCDD 均能够诱导部分啮齿类动物体内的 XO 活性[65, 71?73].此外, 也有文献[74]报道低氧条件 (0.5%~3% O2) 可以增加 XO 活性, 但此时 XO 的mRNA 和蛋白表达水平没有发生改变。
5 乙醇脱氢酶 (ADH)
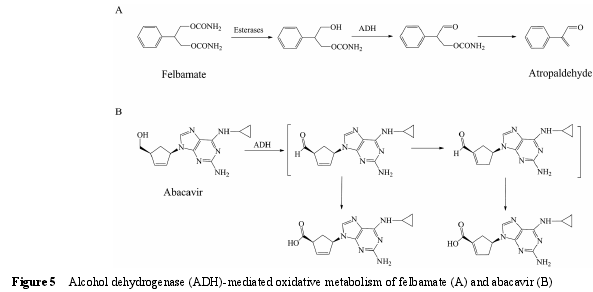
5.1 底物类型 ADH 是一类存在于胞浆中, 主要催化醇类化合物氧化形成相应的醛或酮的酶。ADH 催化的反应是可逆的, 需要辅助因子NAD+或NADH的参与。最常见的 ADH 底物为乙醇。此外, ADH 还参与非甾体抗炎药塞来昔布[75]、治疗脑缺血药丁苯酞[76]、抗癫痫药非尔氨脂 (felbamate)[77]、新型酪氨酸激酶抑制剂 tivantinib[7],以及逆转录酶抑制剂阿巴卡韦(abacavir)[78]等药物的代谢过程。ADH 催化的代谢反应可能与药物在临床上出现的不良反应有关。例如,非尔氨脂经酯酶 (esterases) 水解形成羟基代谢物,进一步经 ADH 氧化形成醛, 最后自发形成阿托醛(图 5A)[77].该代谢活化过程被认为与非尔氨脂在临床上出现的再生障碍性贫血及肝毒性等不良反应有关[79].类似的例子还有阿巴卡韦, 其在 ADH 催化下氧化产生醛中间体, 进一步发生异构化形成 α, β-不饱和醛 (图 5B)。α,β-不饱和醛若与体内蛋白结合, 可能产生过敏反应[80].值得注意的是, 与 P450 酶不同,ADH 在催化一些药物 (如阿巴卡韦) 的代谢反应时,pH 大于 7.4 条件下的催化活性要高于 pH 7.4 条件下的催化活性[78], 因此, pH 7.4 的孵育条件可能导致ADH 在一些药物代谢中的作用被低估。
5.2 亚型、分布及基因多态性 根据分子组成的不同,在人体内共鉴定出 5 种 ADH 亚型, 分别为 ADH1、ADH2、ADH3、ADH4 和 ADH5[81].除了 ADH4 主要分布于胃黏膜细胞及其他上皮细胞外, 其余亚型在肝脏中均有分布[82].ADH1、ADH2 和 ADH4 均参与乙醇的代谢过程[81].ADH3 几乎不催化乙醇的代谢, 它主要通过与 GSH 形成复合物发挥甲醛脱氢酶的活性[81].此外, 文献报道 ADH1 和 ADH2 是催化塞来昔布代谢的两种亚型[75], 而 ADH4 是催化tivantinib 代谢的主要亚型[7].目前, 关于 ADH5 催化的底物尚不清楚。ADH2 和 ADH3 具有基因多态性[83].Yamauchi 等[84]
报道 ADH2 的基因多态性可能与酒精性肝硬化在不同人群中的发生率有关。
5.3 药物相互作用 4-甲基吡唑 (4-MP) 是 ADH的经典抑制剂, 已广泛应用于 ADH 底物的筛查实验[78, 85, 86].ADH 也是一种可以被诱导的酶, 雌二醇以及雄性激素可以诱导大鼠或小鼠体内的 ADH 水平[87?89].
6 乙醛脱氢酶 (ALDH)
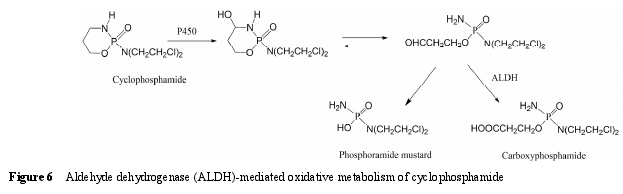
6.1 底物类型 ALDH 主要催化醛类化合物氧化生成羧酸, 该反应通常是不可逆的。ALDH 主要存在于线粒体中, 其次为胞浆。线粒体中 ALDH 催化的反应倾向于以 NAD+作为辅助因子 (NADP+也可以作为辅助因子参与反应); 而胞浆中 ALDH 催化的反应则依赖辅助因子 NADP+[90, 91]的参与。药物在代谢过程中产生的醛中间体一般具有较高的反应活性,可与蛋白发生共价结合导致毒性, 因此, ALDH 催化醛的氧化反应通常被认为是药物的解毒过程。例如,抗肿瘤药环磷酰胺 (cyclophosphamide) 在 P450 酶催化下氧化形成 4-羟基环磷酰胺, 该代谢物能够自发开环形成醛磷酰胺, 后者在缺氧的肿瘤细胞中能分解产生活性代谢物磷酰胺氮芥 (phosphoramidemustard), 发挥杀死肿瘤细胞的作用, 而在正常细胞中则经 ALDH 催化形成无毒性的代谢物羧基磷酰胺(carboxyphosphamide)[6, 13](图 6)。
6.2 亚型及基因多态性 目前, 在人类基因组中共鉴定出 17 种 ALDH 基因[8].线粒体乙醛脱氢酶 ALDH2被认为是催化乙醛氧化形成乙酸的主要亚型[92].ALDH2 基因在亚洲人群中缺失的现象较为常见, 这部分人在饮酒后体内产生大量乙醛, 无法及时代谢,使得毛细血管扩张, 引起脸红反应[92, 93].此外, 乙醛若与心脏内的蛋白结合可能导致酒精性心肌病的发生[94].近年来, 越来越多的文献报道 ALDH2 基因多态性与急性心肌梗死面积和冠状动脉疾病发病率紧密相关[95, 96].
6.3 药物相互作用 双硫仑是 ALDH 的经典抑制剂,已广泛应用于 ALDH 底物的筛查实验[97, 98].ALDH也是一种可以被诱导的酶。Vasiliou 等[99]报道苯巴比妥和甲基胆蒽能诱导大鼠、小鼠及豚鼠等动物肝胞浆中的 ALDH 活性。此外, 苯并芘和 TCDD 也能诱导大鼠肝中的 ALDH 活性[100, 101].
7 其他类氧化酶
除了上述非 P450 酶外, 其他氧化酶也能介导药物的氧化代谢, 如长链 L-α-羟基酸氧化酶、髓过氧化物酶、NADPH 氧化酶、谷胱甘肽过氧化物酶、嗜酸性粒细胞过氧化物酶[102]等。其中, 长链 L-α-羟基酸氧化酶可以介导 L-α-羟基酸类物质的代谢[103]; 髓过氧化物酶能够催化一些药物的代谢活化过程, 如氯氮平[104]、绿原酸[105]等。
8 结语
近年来, 非 P450 酶在催化药物氧化代谢方面的作用日益受到重视。与 P450 酶类似, 非 P450 酶既可直接催化药物发生氧化代谢, 也可进一步氧化经其他酶催化产生的代谢物。表 2 总结了常见的非 P450酶的催化反应类型、常见底物、诱导剂、抑制剂和基因多态性。
在药物发现和先导化合物优化过程中, 通常使用 P450酶相关的体外模型进行代谢研究, 非 P450酶在药物代谢中的贡献往往被低估。与P450酶不同, 大部分非 P450 酶, 如 MAO、AO、XO、ADH 和 ALDH,主要存在于胞浆或线粒体中。此外, P450 酶催化反应的辅助因子为 NADPH, 而 ADH 和 ALDH 催化反应的辅助因子为 NAD+或 NADP+.结合作者实验室的研究经验以及文献[46], 提出了一个决策树, 用来判断候选药物代谢的酶表型, 具体见图 7.
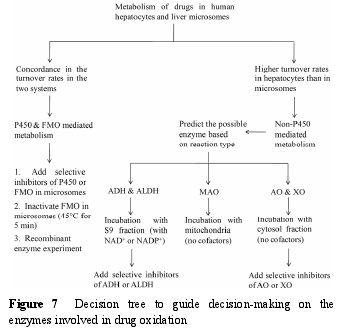
首先, 比较候选药物在人肝细胞和微粒体中代谢物的生成量, 若两种体系中代谢物的生成量较为一致, 提示为 P450 酶或 FMO 介导的代谢。接下来,可以将微粒体在45 ℃条件下预孵5 min使FMO失活,以及重组酶孵化等方法区分 P450 酶和 FMO 的作用。若代谢物在人肝细胞中的生成量明显高于微粒体,提示有非 P450 酶的参与, 可以根据反应类型判断可能的催化酶, 再选择合适的亚细胞器进行孵化。例如,MAO 主要催化胺类化合物发生氧化脱氨或脱氢反应,AO 主要催化含氮杂环类化合物杂原子邻位碳的氧化。当推测代谢途径由 ADH 或 ALDH 介导时, 可以考察药物在人肝 S9 (加入辅助因子 NAD+和 NADP+)中的代谢情况, 若产生该代谢物, 则进一步向孵化体系中加入 ADH 或 ALDH 的特异性抑制剂以区分ADH 和 ALDH 的作用。当推测由 AO 或 XO 介导时,可以考察候选药物在不加辅助因子的人肝胞浆中的代谢情况, 若产生该代谢物, 则进一步向孵化体系中加入 AO 或 XO 的特异性抑制剂, 以区分 AO 和 XO的作用。当推测由 MAO 介导时, 可以考察候选药物在不加辅助因子的人肝线粒体中的代谢情况。若候选药物同时经 P450酶和非 P450酶代谢时, 可以先向肝细胞中加入特异性抑制剂考察这两种类型酶的相对贡献, 再选择合适的亚细胞器进行酶表型实验。

在过去几十年里, 人们对 P450 酶介导的药物氧化代谢进行了大量且深入的研究, 对不同亚型 P450 酶的特征底物、选择性诱导剂和抑制剂, 以及种属差异已经有了充分的了解。然而, 人们对非 P450 酶的研究尚处于起步阶段。对不同亚型的非 P450 酶是否具有特征底物以及种属差异尚不清楚。此外, 由于一些非P450 酶 (如 MAO 和 XO) 参与内源性物质的代谢过程, 对这类酶选择性抑制剂的研究主要集中在治疗内源性物质水平异常导致的疾病中的作用[35, 36, 106, 107],而不是基于临床可能发生的药物相互作用。
由于对 P450 酶介导的药物氧化代谢充分认识,目前, 药物化学家在进行药物结构改造的一个策略是减少 P450 酶介导的代谢活性, 以提高候选药物的代谢稳定性或减少临床发生药物相互作用风险, 但这也往往提高了其他非 P450 酶参与体内代谢的可能性。因此深入研究非 P450 酶介导的氧化代谢机制、种属差异和药物相互作用, 对指导候选化合物的结构优化、合理选择安全性评价动物种属、判断药物是否有继续开发的价值、预测临床可能的药物相互作用等多方面均具有重要价值。
References
[1] Diamond S, Boer J, Maduskuie TP Jr., et al. Species-specificmetabolism of SGX523 by aldehyde oxidase and the toxico-logical implications [J]. Drug Metab Dispos, 2010, 38:1277?1285.
[2] Akabane T, Tanaka K, Irie M, et al. Case report of extensivemetabolism by aldehyde oxidase in humans: pharmacokineticsand metabolite profile of FK3453 in rats, dogs, and humans[J]. Xenobiotica, 2011, 41: 372?384.
[3] Vannelli TA, Dykman A, Ortiz de Montellano PR. The anti-tuberculosis drug ethionamide is activated by a flavoproteinmonooxygenase [J]. J Biol Chem, 2002, 277: 12824?12829.
[4] Dixon CM, Park GR, Tarbit MH. Characterization of theenzyme responsible for the metabolism of sumatriptan inhuman liver [J]. Biochem Pharmacol, 1994, 47: 1253?1257.
[5] alvie D, Zientek M. Metabolism of xenobiotics by aldehydeoxidase [J]. Curr Protoc Toxicol, 2015, DOI: 10.1002/0471140856.tx0441s63.
[6] Strolin Benedetti M, Whomsley R, Baltes E. Involvementof enzymes other than CYPs in the oxidative metabolism ofxenobiotics [J]. Expert Opin Drug Metab Toxicol, 2006, 2:895?921.
[7] Nishiya Y, Nakai D, Urasaki Y, et al. Stereoselectivehydroxylation by CYP2C19 and oxidation by ADH4 in thein vitro metabolism of tivantinib [J]. Xenobiotica, 2016, 46:967?976.
[8] Vasiliou V, Pappa A, Estey T. Role of human aldehydedehydrogenases in endobiotic and xenobiotic metabolism [J].Drug Metab Rev, 2004, 36: 279?299.
[9] Ziegler DM. Recent studies on the structure and function ofmultisubstrate flavin-containing monooxygenases [J]. AnnuRev Pharmacol Toxicol, 1993, 33: 179?199.
[10] Ziegler DM. Flavin-containing monooxygenases: catalyticmechanism and substrate specificities [J]. Drug Metab Rev,1988, 19: 1?32.
[11] Cashman JR. Some distinctions between flavin-containingand cytochrome P450 monooxygenases [J]. Biochem Bio-phys Res Commun, 2005, 338: 599?604.
[12] Yanni SB, Annaert PP, Augustijns P, et al. Role of flavin-containing monooxygenase in oxidative metabolism of vori-conazole by human liver microsomes [J]. Drug Metab Dispos,2008, 36: 1119?1125.
[13] Beedham C. The role of non-P450 enzymes in drug oxidation[J]. Pharm World Sci, 1997, 19: 255?263.
[14] Rodriguez RJ, Acosta D Jr. Metabolism of ketoconazoleand deacetylated ketoconazole by rat hepatic microsomes andflavin-containing monooxygenases [J]. Drug Metab Dispos,1997, 25: 772?777.
[15] Mani C, Hodgson E, Kupfer D. Metabolism of theantimammary cancer antiestrogenic agent tamoxifen. II.Flavin-containing monooxygenase-mediated N-oxidation [J].Drug Metab Dispos, 1993, 21: 657?661.
[16] Cashman JR, Park SB, Yang ZC, et al. Chemical, enzymatic,and human enantioselective S-oxygenation of cimetidine [J]. Drug Metab Dispos, 1993, 21: 587?597.
[17] Cashman JR, Park SB, Berkman CE, et al. Role of hepaticflavin-containing monooxygenase 3 in drug and chemicalmetabolism in adult humans [J]. Chem Biol Interact, 1995,96: 33?46.
[18] Meng J, Zhong D, Li L, et al. Metabolism of MRX-I, a novelantibacterial oxazolidinone, in humans: the oxidative ringopening of 2,3-dihydropyridin-4-one catalyzed by non-P450enzymes [J]. Drug Metab Dispos, 2015, 43: 646?659.
[19] Koukouritaki SB, Simpson P, Yeung CK, et al. Humanhepatic flavin-containing monooxygenases 1 (FMO1) and 3(FMO3) developmental expression [J]. Pediatr Res, 2002, 51:236?243.
[20] Cashman JR, Akerman BR, Forrest SM, et al. Population-specific polymorphisms of the human FMO3 gene: signify-cance for detoxication [J]. Drug Metab Dispos, 2000, 28:169?173.
[21] Ayesh R, Mitchell SC, Zhang A, et al. The fish odoursyndrome: biochemical, familial, and clinical aspects [J].BMJ, 1993, 307: 655?657.
[22] Al-Waiz M, Ayesh R, Mitchell SC, et al. A genetic polymor-phism of the N-oxidation of trimethylamine in humans [J].Clin Pharmacol Ther, 1987, 42: 588?594.
[23] Larsen-Su S, Williams DE. Dietary indole-3-carbinolinhibits FMO activity and the expression of flavin-containingmonooxygenase form 1 in rat liver and intestine [J]. DrugMetab Dispos, 1996, 24: 927?931.
[24] Katchamart S, Stresser DM, Dehal SS, et al. Concurrentflavin-containing monooxygenase down-regulation and cyto-chrome P-450 induction by dietary indoles in rat: implicationsfor drug-drug interaction [J]. Drug Metab Dispos, 2000, 28:930?936.
[25] Uehara S, Uno Y, Inoue T, et al. Activation and deactivationof 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine by cytochromeP450 enzymes and flavin-containing monooxygenases in com-mon marmosets (Callithrix jacchus) [J]. Drug Metab Dispos,2015, 43: 735?742.
[26] Zaragoza A, Andres D, Sarrion D, et al. Potentiation ofthioacetamide hepatotoxicity by phenobarbital pretreatment inrats. Inducibility of FAD monooxygenase system and ageeffect [J]. Chem Biol Interact, 2000, 124: 87?101.
[27] Hukkanen J, Dempsey D, Jacob P 3rd, et al. Effect ofpregnancy on a measure of FMO3 activity [J]. Br J ClinPharmacol, 2005, 60: 224?226.
[28] Kanazawa I. Short review on monoamine oxidase and itsinhibitors [J]. Eur Neurol, 1994, 34 Suppl 3: 36?39.
[29] Youdim MB, Finberg JP. New directions in monoamineoxidase A and B selective inhibitors and substrates [J]. Bio-chem Pharmacol, 1991, 41: 155?162.
[30] Thorpe LW, Westlund KN, Kochersperger LM, et al. Immu-nocytochemical localization of monoamine oxidases A andB in human peripheral tissues and brain [J]. J HistochemCytochem, 1987, 35: 23?32.
[31] Scott AK. Sumatriptan clinical pharmacokinetics [J]. ClinPharmacokinet, 1994, 27: 337?344.
[32] Cesura AM, Imhof R, Galva MD, et al. Interactions of thenovel inhibitors of MAO-B Ro 19-6327 and Ro 16-6491 withthe active site of the enzyme [J]. Pharmacol Res Commun,1988, 20 Suppl 4: 51?61.
[33] Castagnoli N Jr., Chiba K, Trevor AJ. Potential bioactivationpathways for the neurotoxin 1-methyl-4-phenyl-1,2,3,6-tetra-hydropyridine (MPTP) [J]. Life Sci, 1985, 36: 225?230.
[34] Chiba K, Trevor AJ, Castagnoli N Jr. Active uptake of MPP+,a metabolite of MPTP, by brain synaptosomes [J]. BiochemBiophys Res Commun, 1985, 128: 1228?1232.
[35] Van der Walt MM, Terre'Blanche G, Petzer JP, et al. Benzy-loxynitrostyrene analogues―a novel class of selective andhighly potent inhibitors of monoamine oxidase B [J]. Eur JMed Chem, 2016, 125: 1193?1199.
[36] Abbas N, Zaib S, Bakht SM, et al. Symmetrical aryl linkedbis-iminothiazolidinones as new chemical entities for theinhibition of monoamine oxidases: synthesis, in vitro biologicalevaluation and molecular modelling analysis [J]. BioorgChem, 2016, DOI: 10.1016/j.bioorg.2016.11.004.
[37] Strolin Benedetti M. FAD-dependent enzymes involved inthe metabolic oxidation of xenobiotics [J]. Ann Pharm Fr,2011, 69: 45?52.
[38] Fowler JS, Logan J, Wang GJ, et al. Comparison ofmonoamine oxidase a in peripheral organs in nonsmokersand smokers [J]. J Nucl Med, 2005, 46: 1414?1420.
[39] Sarabia SF, Liehr JG. Induction of monoamine oxidase Bby 17 beta-estradiol in the hamster kidney preceding carcino-genesis [J]. Arch Biochem Biophys, 1998, 355: 249?253.
[40] Ueda O, Sugihara K, Ohta S, et al. Involvement of molyb-denum hydroxylases in reductive metabolism of nitro poly-cyclic aromatic hydrocarbons in mammalian skin [J]. DrugMetab Dispos, 2005, 33: 1312?1318.
[41] Zhou L, Pang X, Xie C, et al. Chemical and enzymatic trans-formations of nimesulide to GSH conjugates through reductiveand oxidative mechanisms [J]. Chem Res Toxicol, 2015, 28:2267?2277.
[42] Hirao Y, Kitamura S, Tatsumi K. Epoxide reductase activityof mammalian liver cytosols and aldehyde oxidase [J].Carcinogenesis, 1994, 15: 739?743.
[43] Dick RA, Kanne DB, Casida JE. Identification of aldehydeoxidase as the neonicotinoid nitroreductase [J]. Chem ResToxicol, 2005, 18: 317?323.
[44] Sugihara K, Kitamura S, Tatsumi K. Involvement ofmammalian liver cytosols and aldehyde oxidase in reductivemetabolism of zonisamide [J]. Drug Metab Dispos, 1996, 24:199?202.
[45] Tatsumi K, Kitamura S, Yamada H. Involvement of liveraldehyde oxidase in sulfoxide reduction [J]. Chem PharmBull (Tokyo), 1982, 30: 4585?4588.
[46] Pryde DC, Dalvie D, Hu Q, et al. Aldehyde oxidase: anenzyme of emerging importance in drug discovery [J]. J MedChem, 2010, 53: 8441?8460.
[47] Dittrich C, Greim G, Borner M, et al. Phase I and pharma-cokinetic study of BIBX 1382 BS, an epidermal growth factorreceptor (EGFR) inhibitor, given in a continuous daily oraladministration [J]. Eur J Cancer, 2002, 38: 1072?1080.
[48] Sanoh S, Tayama Y, Sugihara K, et al. Significance of





