
牛病毒性腹泻/黏膜病( Bovine viral diarrhea/mucosal disease,BVD / MD) 是由牛病毒性腹泻病毒( Bovine viral diarrhea virus,BVDV) 引起的牛等动物的重要传染病。受感染牛可表现出多种临床症状,包括肺炎、腹泻、流产、出血性综合征等急性感染及持续性感染和黏膜病,同时,由于 BVDV 引起的免疫抑制可造成继发感染和其他疫苗免疫失败。据统计,在每100 万犊牛中,由于 BVDV 感染造成的损失可达2000 ~5700 万美元。该病毒除感染牛外,还可以感染鹿、羊驼、牦牛、骆驼等特种动物,对特种经济动物养殖危害较大。
BVDV 基因组核酸为单股、正链 RNA,长约12. 3kb,由 5'端非编码区( 5'UTR) 、1 个大的开放阅读框( ORF) 和 3'端非编码区( 3'UTR) 构成。大开放阅读框序列编码着所有的病毒蛋白,单个病毒蛋白的顺序为 Npro - C - Erns - E1 - E2 - p7 - NS 2/3 -NS4A - NS4B - NS5A - NS5B,多聚蛋白体形成后,经宿主细胞和病毒自身的多种蛋白酶进行翻译和翻译后加工,生成不同的病毒蛋白。依据 5'UTR 基因序列可将牛病毒性腹泻病毒分为 2 个基因型,即BVDV1 和 BVDV2。最近,典型牛瘟病毒( 包括Th /04?KhonKaen virus,D32 /00 -‘HoBi’等) 被定义为 BVDV3 型。根据能否使细胞发生病变效应将BVDV 分为致细胞病变型 CP 和非致细胞病变型NCP 2 种生物型。临床上分离毒株多为非致细胞病变型。感染非致细胞病变型 BVDV 的小牛血清已成为生物制品生产中较大的威胁。因此,快速准确地检测 BVDV 成为预防和控制牛病毒性腹泻的关键。常规检测 BVDV 的技术主要有病毒分离、血清学试验等。这些方法对于临床上无细胞病变毒株的诊断在敏感性、特异性、时效性等方面都存在各自的缺陷。用于病毒核酸检测的 Real - time PCR技术以其快速、灵敏、特异性强等优点在基因表达水平的分析、病原体的定性和定量检测等方面得到广泛应用。本研究建立了检测 BVDV 的 SYBRGreenⅠ Real - time PCR 方法,并对临床感染牛体内BVDV 进行定量检测,揭示病毒在宿主体内各脏器的分布情况。
1、 材料和方法
1. 1 病毒
牛病毒性腹泻病毒 JL 毒株( BVDV - 1) 、牛病毒性腹泻病毒 HEN03 毒株( BVDV - 2) 、牛传染性鼻气管炎病毒 ( IBRV) 、牛呼吸道合胞体病毒( BRSV) 、牛副流感病毒( PI3V) 、猪瘟病毒 C 株( CS-FV - C) 均由中国农业科学院特产研究所特种经济动物分子生物学重点实验室分离鉴定并保存。
1. 2 主要仪器和试剂
PCR 仪、Bio - rad 实时荧光定量 PCR 仪、ExTaq 酶、pMD18 - T 载体( 大连宝生物工程公司) ,Tr-izol、反转录试剂盒( Invitrogen 公司) ,质粒提取与胶回收试剂盒( AXYGEN 公司) 。
1. 3 引物的设计与合成
通过序列比对,根据牛病毒性腹泻病毒 5'UTR基因保守序列,利用 Oligo6. 0 软件设计了1 对引物。
上游引物 BF( 5' GGT AGC AAC AGT GGT GAG TTC3') ,下游引物 BR( 5' CTC AGG TTA AGA TGT GCTGTG 3') ,扩增片段 136bp,引物由上海生物技术服务有限公司合成。
1. 4 病毒 RNA 提取和 cDNA 的合成
采用 Trizol 试剂提取病毒的 RNA,提取步骤参照使用说明书进行。提取的 RNA 溶于 30μL DEPC处理的 ddH2O,反转录按照 Invitrogen 反转录试剂盒说明进行。
1. 5 标准品的制备
利用“1. 4”项下合成的牛病毒性腹泻病毒 cDNA作为模板进行常规 PCR,反应体系 25μL: cDNA 模板2μL、上下游引物 ( 10pmol) 各 1μL、dNTP ( 2. 5mM)2μL、10 × Ex Buffer 2. 5μL、Ex TaqTMDNA 聚合酶0. 25μL、ddH2O 16. 25μL。反应条件: 95℃ 5min,94℃30s,56℃ 30s,72℃ 20s,35 个循环,最后 72℃ 延伸7min。RT - PCR 产物经琼脂糖凝胶电泳鉴定,目的DNA 片段连接 pMD18 - T 载体转化后挑单克隆提取质粒送测序,序列正确质粒利用紫外分光光度计测其D260nm和 D280nm值,并计算出每微升拷贝数。
1. 6 SYBR GreenⅠreal - time PCR 反应条件
将质粒标准品10 倍倍比梯度稀释,并进行 Real- time PCR 反应,反应体系按照 SYBR Premix ExTaqTM( Perfect Real Time) 试剂盒说明书进行,反应条件: 95℃预变性 10s; 95℃ 5s,60℃ 20s,共 40 个循环,每个循环结束时检测荧光信号。标准曲线的绘制及扩增产物的熔解曲线由实时荧光定量 PCR 仪自动进行。
1. 7 敏感性、特异性和重复性试验
用牛传染性鼻气管炎病毒、牛呼吸道合胞体病毒、牛副流感病毒 3 型和猪瘟病毒的核酸进行实时荧光定量 PCR 检测,以此确定该检测方法的特异性; 方法敏感性的检测采用 10 倍倍比稀释108copies / μL ~ 101copies / μL的质粒标准品,确定检测的最低浓度限。选择 2 份牛病毒性腹泻病毒 1 型( BVDV - JL) 感染病料和 1 份牛病毒性腹泻病毒 2型( BVDV -HEN03) 感染病料,提取病毒核酸并反转录成cDNA 后,进行real -time PCR 检测,每个样品重复3 次,确定批内重复性。批间重复性是在同一反应条件下进行3 次独立的 real -time PCR 检测。
1. 8 临床病例主要脏器的病毒分布检测
临床病例的主要脏器样品来源于分离 BVDV -JL 毒株的病死牛脏器,主要包括脾脏、淋巴结、胸腺、肾脏、肝脏、肺脏和心脏等脏器。各脏器冻存于- 70℃ 冰箱中。提取各脏器总 RNA,通过 Real -time PCR 检测各脏器病毒含量。
2、 结果
2. 1 质粒浓度的计算
质粒浓度为12. 7μg/μL,A260/ A280为 1. 83,根据公 式 ( 6. 02 × 1023copies / moL ) × ( 浓度 g / μL ) /( MWg/moL) = copies/μL 计算其拷贝为 4. 1 ×108copies / μL。
2. 2 标准曲线的建立
实时荧光定量 PCR 反应条件优化后结果显示,BVDV 的标准品具有良好的线性关系,相关系数 R2为 0. 999,扩增效率 E 为 95. 9%( 图 1) ,熔解曲线为单一峰值,Tm 值为 85. 5。扩增产物进行琼脂糖凝胶电泳鉴定,大小为 136bp 左右。
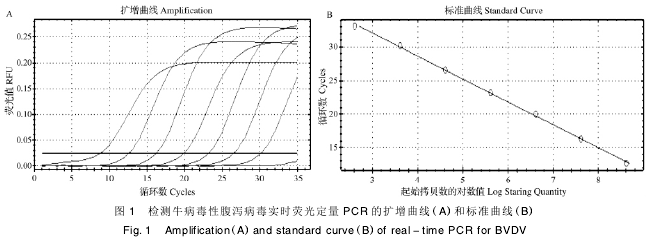
2. 3 荧光定量 PCR 的敏感性
Real - time PCR 检出的最低限为 4. 1 ×101copies / μL,常规 PCR 的检测极限 为 4. 1 ×103copies / μL( 图 2) ,其灵敏度为常规 PCR 的 100倍左右。
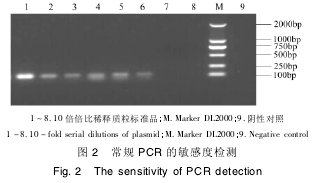
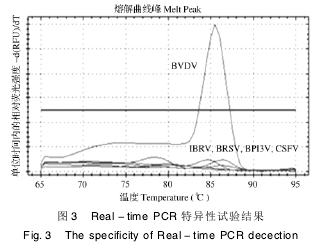
2. 4 荧光定量 PCR 的特异性
熔解曲线结果表明,只有 BVDV 才能扩增出特异性峰,Tm 值为 85. 5,而对其它牛源病毒( IBRV、BRSV、BPI3V) 和猪瘟病毒( CSFV) 检测结果均为阴性( 图 3) 。
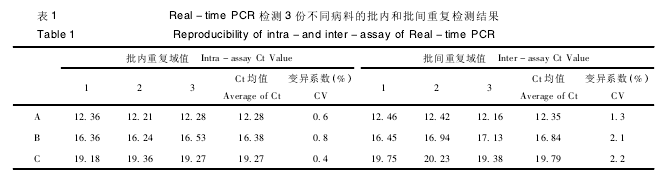
2. 5 荧光定量 PCR 的重复性
取 3 份不同病料,将提取的牛病毒性腹泻病毒RNA 反转录为 cDNA,进行实时荧光定量 PCR 检测,统计分析表明,批内变异系数 ( CV) 0. 4% ~0. 8% ,批间变异系数( CV) 1. 3% ~ 2. 2% ( 表 1) 。
2. 6 临床病料病毒检测
对冻存于 -70℃ 冰箱中临床病料采用 Real -time PCR 方法检测各脏器病毒含量。胸腺、淋巴结和脾脏的病毒含量最高,其中,胸腺的病毒含量为8. 94 × 106copies / μL,肺脏、肾脏、心脏和肝脏也检测到不同含量的病毒核酸,但在病毒分离中均未能够分离到病毒。
3、 讨论
牛病毒性腹泻/黏膜病呈世界性分布,给世界养牛业发展造成了巨大的经济损失。随着我国养牛业的迅速发展,目前已有 20 多个省、市、自治区存在该病。本研究前期流行病学调查表明,多数省份牛病毒性腹泻病毒血清中和抗体阳性率高达 70%。在我国,目前还没有商品化的疫苗,因此诊断成为防治该病的重要措施。BVDV 与 CSFV 同科同属,在免疫学上存在着交叉性,临床上猪感染 BVDV 症状与猪瘟类似,应用常规血清学方法很难将两者区分。
常规 PCR 检测虽然较常规分离病毒相比灵敏度高,但由于检测过程中需要进行电泳,容易污染。而Real - time PCR 技术可以实时监测反应过程中的扩增产物,建立标准曲线后,可以准确定量病毒核酸的拷贝数,试验结果无需再进行电泳评估,大大节省了试验时间和反应的灵敏度。
本试验建立了牛病毒性腹泻病毒实时荧光定量PCR 检测方法,该方法所建立的扩增曲线和标准曲线具有良好的线性关系( 相关系数 R2= 0. 999; 扩增效率 E =95. 9%) ,熔解曲线在 40 个循环内无引物二聚体等非特异性扩增,且与其它牛源病毒及猪瘟病毒不发生交叉反应,表明该方法具有高度的特异性; 该方法可检测到初始模板中 4. 1 ×101copies / μL的病毒核酸,其灵敏度为常规 PCR 的 100 倍; 重复性试验结果变异系数0. 4% ~ 2. 2%,表明该方法具有很好的重复性。应用所建立的 Real - time PCR方法检测了临床上牛病毒性腹泻病毒感染牛各脏器病毒含量,胸腺、淋巴结和脾脏等淋巴组织中病毒含量最高,其中胸腺的病毒含量为 8. 94 ×106copies / μL; 肺脏、肾脏、心脏和肝脏也检测到不同含量的病毒核酸,但在病毒分离中均未能够分离到病毒。该结果表明,病毒主要侵害淋巴器官,此研究可为临床病例选择病理组织进行病毒分离提供依据。





