
物理化学是高等学校化学、化工、材料、环境、生物及能源等理工科专业学生必修的一门基础理论课。该课程不仅能使学生对所学的无机化学、分析化学、有机化学等基础化学知识从理性上加以提高,而且为后续的化工原理、化学反应工程、功能高分子、新能源等课程打下了必要的数理基础,其重要性不容置疑。因此,为了提高物理化学教学质量,许多从事该课程教学的教师尝试了各种改革措施。[1-3]
本文从培养和提升学生发现问题、分析问题和解决问题的综合能力出发,在课堂教学中引入化工研发的具体案例,这种理论与实际紧密联系的案例式教学模式,既能向学生传授知识,又能通过对实际问题的分析与探索,激发学生的求知欲。
一、化学热力学原理的教学与应用
化学热力学既是物理化学的重点也是难点。
这部分内容概念多、公式多,且抽象不好理解、不易掌握。如果课堂教学中只注重讲解基本概念、数学推导及理论计算,学生不仅会感到枯燥乏味,而且也不知道所学理论有何应用,最终影响学习兴趣和对知识点的掌握。为此,我们在课堂教学中,引入化工开发中的实际例子,形成了理论与应用相结合的教学模式。
化学热力学的中心就是讨论化学变化的方向、限度及变化过程中的能量交换等问题,涉及ΔU、ΔH、ΔS及ΔG等热力学量的众多公式推导及计算。许多公式靠死记硬背是不可能正确掌握的,当使用条件稍有改变就会用错。如Kirchhoff公式:【1】
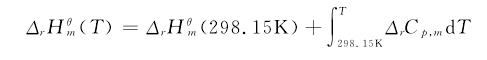
其在化工工艺开发中常用于能量交换的计算。但是,该公式适用于298.15K—T的温度范围内,参与反应的各组分只有温度变化的简单过程。[4]
而实际的化学反应体系常常是一个既有化学变化,也有相变化、温度变化及压力变化的复杂过程。
学生对于复杂变化过程中,相关热力学量的计算很难掌握准确。为此,课堂教学中引入化工开发中的热力学计算实例,有助于学生对所学知识点的理解和掌握。如碳酸二甲酯(DMC)“绿色”合成工艺的开发,其反应方程为:【2】
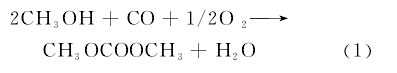
碳酸二甲酯分子结构中由于有甲氧基、羰基、甲基等多种官能团,且无毒,所以是一种应用广泛的“绿色”化工中间体。按反应方程(1)的合成工艺,原子利用率高,原料易得、无环境污染,是公认的“绿色”合成工艺。[5]
该反应体系的起始状态是室温、常压下的液态甲 醇、气 态O2和CO,终 态 为393.2K和2.5MPa下的产物碳酸二甲酯和水。反应体系从始状态到终状态中既有化学变化,也有相变化、温度变化及压力变化。
如何用化学热力学的基本理论,推算实际反应体系的ΔrHm、ΔrSm、ΔrGm及K等热力学量,是开发该工艺的重要理论依据。化学热力学的计算中常用到状态函数法,即在相同的始、终状态之间将复杂过程分解成若干个单因素变化的简单过程,如图1。【3】

在常压下,反应物甲醇及产物碳酸二甲酯和水的沸点分别为337.7K、363.5K和373.2K,根据Clausius-Clapeyron方程:【4】
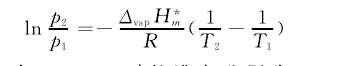
可估算,在2.5MPa时 的 沸 点 分 别 为448.2K、561.8K和496.2K。所以,在393.2K和2.5MPa的条件下,反应物甲醇及产物碳酸二甲酯和水均为液态。因此,图1中的状态变化不涉及相态变化,过程的状态变化设计合理。
由于状态函数只与状态有关,其改变量与变化的途径无关。所以,存在下列关系:【5】
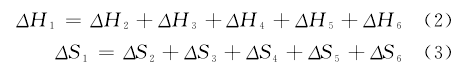
其中,ΔH1是在298.2K,0.1MPa条件下单纯化学变化过程的焓变。根据化学反应的标准摩尔反应焓ΔrHθm、标准摩尔生成焓ΔfHθm、标准摩尔燃烧焓ΔcHθm等概念及彼此的关系,可根据公式【6】
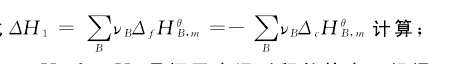
ΔH3和ΔH4是恒压变温过程的焓变。根据摩尔定压热容Cp,m的概念及应用,通过下述基本公式:ΔH =∫Cp,mdT,在298.2K~393.2K范围内积分计算,即:【7】
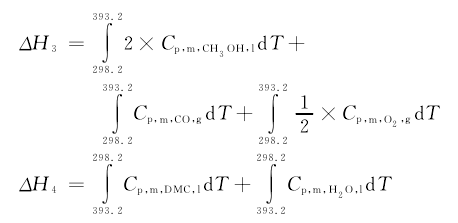
ΔH2和ΔH5是恒温变压过程的焓变。对于气体O2和CO可近似视为理想气体,理想气体的热力学能、焓仅仅是温度的函数,压力对液体性质的影 响 很 小,一 般 可 忽 略。 所 以,ΔH2≈ 0,ΔH5≈0;因此,在393.2K和2.5MPa的实际反应条件下,化学反应(1)的焓变可根据关系式(2)计算,为ΔH6=-368.6kJ·mol-1。
同理,由 热 力 学 第 三 定 律,借 助 各 物 质 在298.2K的标准摩尔熵Sθm及Cp,m等基础热数据,对 于 单 纯 的 化 学 变 化 的 熵 变,根 据ΔS1=∑BνBSθB,m(298.2K)计算;单纯温度变化的ΔS3和ΔS4,根据ΔS =∫Cp,mTdT基本公式计算;忽略压力对液体性质的影响,气体O2和CO可视为理想 气 体 时, 单 纯 压 力 变 化 的ΔS2≈0,ΔS5≈0。[6,7]
由关系式(3)可以计算在393.2K和2.5MPa的 实 际 反 应 条 件 下,化 学 反 应 (1)的 熵 变 为ΔS6= -269.8J·mol-1。
根据热力学关系式ΔG6=ΔH6-TΔS6和ΔG =-RTlnK,可以计算反应(1)在393.2K和2.5MPa实际条件下的反应吉布斯函变和平衡常数 分 别 为,ΔG6= -262.5kJ·mol-1,K =7.47×1034。
上述热力学计算结果说明,甲醇液相氧化羰化反应为放热反应,温度升高不利于平衡向产物方向移动。但是,温度太低时,反应速率太小,影响生产效率。当温度升高到393.2K时,已满足生产实际效率的需要,此时反应的平衡常数为7.47×1034,极大地趋于产物。可见,甲醇和CO的理论转化率应该很大。只要有高效的催化剂,该工艺的热力学趋势将极大地趋向产物碳酸二甲酯。
通过上述化工开发实际案例的讲授,学生可以全方位梳理所学理论知识点,提高对所学理论的认知程度,同时了解实际化工工艺研发过程,培养了应用理论知识解决实际问题的综合能力。
二、化学动力学原理的教学与应用
物理化学中动力学的基本内容是动力学方程的建立,温度、浓度及压力等各种因素对反应速率的影响。课堂教学中讲授了许多相关知识,习题也做了不少。但学生对于动力学方程的建立及动力学参数的测定仅局限于教科书中的纸上谈兵,不会具体应用。因此,课堂教学中仍以甲醇氧化羰化合成碳酸二甲酯的反应动力学研究为例,进行理论与科研实际相结合的案例式教学。甲醇氧化羰化合成碳酸二甲酯,其反应方程如(1)式,反应过程中存在的副反应为CO2的生成反应:
CO+1/2O ?→2CO2(4)反应体系中的甲醇既做反应物又做溶剂,在单程反应过程中甲醇的总量变化很小,可近似认为浓度不变。根据化学反应动力学方程的一般表达式可得:[4]【8】
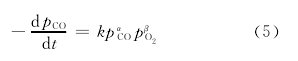
反应进行时,可测定的物理量只有体系的总压力和反应时间。体系的总压包含CO,O2,CO2的分压,以及甲醇、碳酸二甲酯和水的蒸气压。如何将不可测量的物理量———反应物CO分压随时间的变化率,转化为可测量的物理量———体系的总压力随时间的变化率,是建立该反应动力学模型的关键,也是物理化学动力学课堂教学与实验教学中学生要重点掌握的内容。通过对此实际问题的具体分析、讨论,捋清如何用所学理论知识建立该反应体系动力学模型的思路,引导学生通过分析、演绎得到动力学方程:[8]pt =[(n-1)K(t+tc)]11-n+p0(6)式中的Pt是反应体系的总压,可以通过反应釜上的压力表测定,t是时间,可以用秒表记录,n是反应总级数,K是与速率常数有关的常数。
将建立的动力学方程与不同催化体系的实验数据拟合,可得到不同催化体系的反应速率常数、反应级数及活化能等动力学参数。[8]【9】
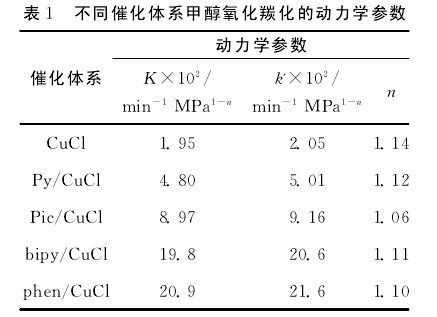
对比上述不同催化体系的速率常数、反应级数,学生可以清晰了解到催化剂可以明显改变反应速率,但对反应级数没有影响。加入有机含氮化合物后,CuCl的催化剂性能明显提高,反应的活化能从单纯CuCl催化剂的64.68kJ/mol降到以phen/CuCl为催化剂的44.31kJ/mol,所以,反应速度明显提高,后者是前者的十倍。
通过引入科研开发中用理论知识解决实际问题的案例,学生能切实体会到所学理论对实际的指导,开阔了视野,激发并培养了对科学研究的兴趣及创新意识。
三、结束语
以上基本理论与实际案例相结合的教学实践,提高了相关知识点的教学质量,学生在课间和课后能积极主动地与老师讨论和交流,迫切希望参与老师的科研与开发,表现出对本门课程学习的极大兴趣,在作业和考试中对相关问题的理解和解决能力都有所提高。
参考文献:
[1]朱志昂.物理化学课程教学内容和教学方法的改革[J].大学化学,2012,27(5):9-13.
[2]彭昌军,史济斌,胡军等.从充分发挥专业基础课程作用的视角论物理化学课程的教学内容[J].化工高等教育,2012,(1):12-14.
[3]伊廷锋,金红,朱彦荣等.工科专业物理化学教学提高学生学习兴趣的几点尝试[J].化工高等教育,2010,(2):71-74.
[4]刘俊吉,周亚平,李松林.物理化学[M].北京:高等教育出版社,2009.83-84.





