3 红细胞载体的制备
3. 1 红细胞载体的来源
红细胞及红细胞膜的来源与提取相对简单,一般通过离心方法得到血液中的红细胞,采用低渗溶血的方式取得红细胞膜,也有化学合成仿生的红细胞膜[25].
3. 2 红细胞载体的载药方式
3. 2. 1 将药物包载入红细胞内 目前,人们运用一系列技术将治疗成分包裹入红细胞内,常用的有低渗法、化学法、电穿孔、胞吞法和脂质融合法等[26-28].对于可自由扩散的小分子药物,常将其前药或其药物结合蛋白包载入红细胞内,通过前药的代谢或结合蛋白对小分子药物的亲和力实现药物的缓慢释放。大分子蛋白例如一些酶类( 其作用底物可穿过红细胞膜进入胞内的) 可直接包载入红细胞内,如此既可保持药物本身的稳定性,亦可实现缓慢催化作用[29].
3. 2. 2 将药物连接在红细胞膜上 若药物( 酶或其他药物) 必须同红细胞膜外不能穿膜的底物直接作用才能产生治疗效果,则常用不同的连接方法将药物连接于红细胞膜上。其中亲和素-生物素方法是膜与药物( 特别是生物药物) 结合的最常用技术[30].哺乳动物红细胞膜生物素酰化可通过生物素 N-溴代琥珀酰亚胺酯( NHS-biotin) 引入氨基,也可生物氧化红细胞膜的醛基。Magnani 等[31]比较了这些方法,发现通过 NHS-biotin 生物素酰化的细胞活性最好,每 1 个红细胞膜连接约 1 000 个生物素,在体内 24 h 的活性不受影响。
4 基于红细胞载药系统的最新进展
红细胞载药的优势主要依靠红细胞膜的结构及功能实现,且红细胞膜提取分离较简单,因此许多研究者提取单纯红细胞膜来考察其药物输送作用。例如 Gupta 等[32]提取纯净红细胞膜经挤压制成直径为 100 ~200 nm 的纳米红细胞小体,运载法舒地尔治疗肺动脉高血压。红细胞膜包裹纳米粒( RBC-NP) 以及红细胞膜纳米海绵这两种新型红细胞膜载体的研究进展介绍如下。
4. 1 红细胞膜包裹纳米粒( RBC-NP)
RBC-NP 药物载体是将纳米粒内核和红细胞膜结合,既能弥补纳米粒体内清除速度快及红细胞载体释药缺乏可控性的缺点,又能发挥这两类药物载体的各自优势,是一种十分具有发展前景的新型药物载体。
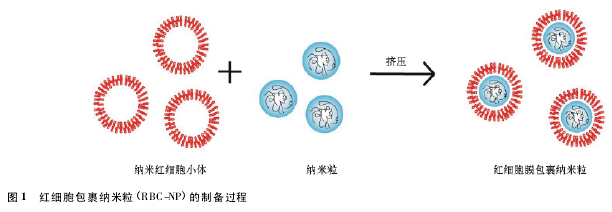
4. 1. 1 RBC-NP 的制备、载药和释药方式 制备RBC-NP 一般采用低渗透析挤压法。制备基本原理如图 1 所示,在低渗环境下红细胞膜孔打开将内容物释出,得到的红细胞膜经纳米膜挤压形成纳米红细胞小体,再将纳米红细胞小体和纳米粒经反复挤压形成 RBC-NP( 直径约80 nm) .通过透射电镜( TEM) 观察以及蛋白酶消化等试验证明,合成的RBC-NP 能够稳定存在,且膜包裹的方向为红细胞膜的外侧朝外,膜内侧邻纳米粒内核。Luk 等[33]探究了纳米粒内核的表面电性、曲率半径等因素对红细胞膜包裹纳米粒的影响。结果显示,红细胞膜可包封粒径为 65 ~ 340 nm 纳米粒,负电性内核与负电性红细胞膜间的静电作用是能包裹并保持稳定的主要原因。
RBC-NP 主要是通过纳米粒内核载药,目前常使用 PLGA,载药方式分为物理包封和化学键接。有研究通过这两种方式将多柔比星载入 RBC-NP,得到的 RBC-NP 在 PBS 缓冲液中具有近似的高稳定性,且药效均高于单纯多柔比星给药,但化学键接载药的 RBC-NP 药物释放更加持久[34].
RBC-NP 的释药方式主要有被细胞吞噬后膜破裂释药和通过细胞膜扩散或特殊的转运体系释药[35].Gao 等[36]研 究 发 现,将 脂 质 体 中 装 载NH4HCO3,温度上升至 42 ℃时产生二氧化碳气泡破坏脂质体膜,可释放出药物。如此实现温度敏感性释药,且无有害化学成分残留。除了内部作用,也可通过外界触发释药。Delcea 等[37]发现,金纳米粒附于红细胞膜上,用激光照射后金纳米粒聚集处的膜性质改变,可形成孔道释放膜内的药物,这些成果为日后进一步发展 RBC-NP 释药技术提供了新思路。
4. 1. 2 RBC-NP 作为药物载体的特点及应用RBC-NP 与普通药物载体相比,可显着延长药物的体内循环时间。Hu 等[38]将 RBC-NP( PLGA 为内核) 、PEG 修饰的 PLGA 纳米粒( PEG-PLGA NP) 以及 PLGA 纳米粒( PLGA NP) 3 种药物载体进行荧光染色后,尾静脉注射入小鼠体内,按一定时间眼眶取血进行检测。结果显示,在 24 和 48 h 后,RBC-NP 在血液中的残留量分别为 29% 和 16% ,显着高于 PEG-PLGA NP 组( 11% 和 2%) 和 PLGANP 组( 2 min 后基本不存在) .
RBC-NP 可稳定持续释放药物,增加给药靶向性。Aryal 等[34]将多柔比星载入 RBC-NP 进行体外药物释放研究,发现 72 h 内药物释放率仅为20% ,约为对照组 ( PEG 修饰的 PLGA 纳米粒) 释放速率的二分之一。为使 RBC-NP 具有更好的功能性和靶向性,Fang 等[39]将两种配体即叶酸( 相对分子质量约 441) 和核仁素配体 AS1411( Mr约9 000) 以磷脂分子为连接剂对红细胞膜进行修饰。
结果显示叶酸修饰的 RBC-NP 在 KB 细胞中摄取量提高了 8 倍,AS1411 修饰的 RBC-NP 在 MCF-7细胞中摄取量提高了 2 倍。此外,采用这种脂质植入的修饰方式避免了普通化学修饰造成的膜蛋白变性、功能损害等问题。受到 RBC-NP 启发,Fang等[40]采用肿瘤细胞膜包裹纳米粒制成新型肿瘤靶向载体( CC-NP) ,通过细胞-细胞之间的相互作用,CC-NP 在肿瘤细胞的摄取量可达 PLGA 纳米粒的20 倍。
本课题组目前基于 RBC-NP 展开小干扰 RNA( siRNA) 的主动靶向输送研究。siRNA 类药物存在快速降解的风险[41],在前期筛选获得高效、低毒氨酯类聚乙烯亚胺衍生物( PEI-Et) 材料的工作基础上,将 PEI-Et 复合 siRNA,得到稳定的载体核心纳米粒( PEP)[42-43]; 将半乳糖修饰的红细胞膜包裹 PEP 作为新型输送系统( Gal-RBC-PEP NPs) ,实现 siRNA 的稳定包封。本课题组将考察该系统输送 siRNA 的长效、靶向、安全性,以此探索构建具有长效、主动靶向功能的新型红细胞膜类 siRNA输送载体。
4. 2 红细胞膜纳米海绵
RBC-NP 的红细胞膜可捕获体内毒素并使其被清除掉,从而对抗细菌感染,这种本身可吸收细菌毒素的特性 RBC-NP 被称作红细胞膜纳米海绵。
4. 2. 1 作为解毒剂 Hu 等[44]通过研究发现,PL-GA 为内核的纳米海绵,可特定吸收成孔毒素类( PFTs) ,显着降低其毒性。在注射纳米海绵的情况下再给予小鼠致死剂量的 α-毒素,小鼠存活率可达 80% ( 存活时间超过 360 h) .通过与 PEG-PLGA NP、PEG-Lipid NP、纳米红细胞小体的试验对比,证实 PLGA 纳米粒内核与红细胞膜对于吸收PFTs 缺一不可。PFTs 普遍具有细胞膜穿孔能力,纳米海绵的红细胞膜结构可作为该毒素作用底物吸引 PFTs 嵌入膜内,但在纳米粒的稳定作用下不发生溶血,且能在体内长时间循环继续吸收毒素,如此纳米海绵可将绝大部分毒素带离其靶细胞。当被巨噬细胞吞噬后,纳米海绵也可增强溶酶体对毒素蛋白的消化作用,最终可通过肝脏安全代谢。
研究者紧接着进行了链球菌及蜂毒肽等其他 PFTs解毒试验,结果均可显着减轻毒素对动物的伤害,说明红细胞膜纳米海绵的抗菌解毒作用具有普适性,可应用于各种 PFTs 的解毒治疗,克服了普通解毒治疗中不同的病毒必须采用不同解毒药物的缺点。
4. 2. 2 作为抗毒疫苗 除了用纳米海绵直接进行解毒治疗外,也可将抗原蛋白嵌入纳米海绵的红细胞膜中制成抗毒素疫苗。Hu 等[45]将 PFTs 嵌入纳米海绵的膜上,PFTs 在纳米海绵的限制下不会对细胞产生毒性,且仍能保持原有结构形态,通过皮下注射后随淋巴循环可被有效运输到免疫系统。
被浆细胞吞噬后,能产生大量与毒素特异性结合的IgG.与通过加热或化学手段灭活的疫苗相比,这种疫苗产生的抗体数量更多,亲和力更强,且不会引发其他针对输药载体的免疫并发症。在体内循环过程中,对正常细胞亦没有危害。
4. 2. 3 治疗免疫系统疾病 纳米海绵在治疗Ⅱ型超敏反应类疾病方面也有了新的研究进展。抗体诱导型贫血症的致病机制是患者体内产生了可与自体红细胞膜表面抗原结合的病理性抗体,正常的红细胞与之结合后被吞噬细胞吞噬而导致贫血。
Copp 等[46]的最新研究发现,纳米海绵膜上的相应抗原能够保持裸露并与该病理性抗体特异性结合,可作为诱饵大量中和病理性抗体,然后经吞噬细胞作用将其清除,最终使病理性抗体不能与正常红细胞结合,从而大大缓解自身免疫性溶血反应或药物诱导的贫血症。纳米海绵可吸收各型病理性抗体,这为解决免疫疾病治疗中药物不能普遍适用的问题[47]提供了思路。
5 展 望
红细胞载药体系具有极高的生物相容性和可降解性,在延长体内循环时间、提高靶向性和稳定性、提高药物效果等方面也具有其他传统药物载体不可比拟的优势[48-49].相比于单纯的红细胞载药,复合型红细胞膜载药体系可实现更多的功能( 靶向性等)[39].目前,已有红细胞载体进入临床试验阶段[29].其中,地塞米松红细胞载体治疗溃疡性结肠炎已完成临床Ⅱ期试验; L-天门冬酰胺酶红细胞载体治疗急性淋巴细胞白血病复发正在进行临床Ⅲ期试验。
但对于大规模生产和使用,红细胞药物载体的来源和储存仍是阻碍其应用的主要问题。与其他药物载体相比,红细胞源于生物体,不同来源的载体本身就具有较大的差异性,且制备过程缺少统一控制标准。在红细胞的提取和载药过程中如何减少污染、降低对膜功能的损害,如何储存红细胞载体并保持其生物活性等,都是亟待解决的问题。对于新型 RBC-NP 的研究才刚起步,接下来应进一步探明红细胞膜与不同纳米粒内核的作用机制和原理,研究如何将较大粒径的纳米粒包裹入红细胞膜内且尽量减少对红细胞膜的损害。红细胞膜纳米海绵在抗菌解毒治疗上将有着极为广阔的发展前景,在其他临床应用方面也存在一定潜力,值得深入研究。最后,基于红细胞的载药体系还需通过各种科学优化,进一步提高药物的包封率、靶向性和控释性。随着相关研究不断深入,相信在不远的将来就会掀起一场临床药物载体的新变革。
参 考 文 献
[1] Alabi CA,Love KT,Sahay G,et al. Multiparametric approach forthe evaluation of lipid nanoparticles for siRNA delivery[J]. ProcNatl Acad Sci U S A,2013,110( 32) : 12881 - 12886.
[2] Bhateria M,Rachumallu R,Singh R,et al. Erythrocytes-basedsynthetic delivery systems: transition from conventional to novelengineering strategies[J]. Expert Opin Drug Deliv,2014,11( 8) :1219 - 1236.
[3] Yoo JW,Irvine DJ,Discher DE,et al. Bio-inspired,bioengineeredand biomimetic drug delivery carriers[J]. Nat Rev Drug Discov,2011,710( 7) : 521 - 535.
[4] Hamidi M,Tajerzadeh H. Carrier erythrocytes: an overview[J].Drug Deliv,2003,10( 1) : 9 - 20.





