摘要:目的 通过分析近5年北京大学图书馆“中文核心期刊”中诊断试验纳入、排除标准的报告质量,发现存在的问题,规范纳入、排除标准的报告方式。方法 遴选北大核心目录下临床医学类期刊,检索2017年1月1日至2022年6月7日的诊断试验,提取纳入、排除标准,统计研究中缺失纳入、排除标准的篇数,分析纳入、排除标准的报告内容和书写位置,结合诊断准确性研究报告标准和诊断准确性研究的质量评价工具-2,发现存在的问题。结果 共纳入226篇诊断试验,其中74篇既无纳入标准也无排除标准,97篇缺少纳入标准,91篇缺少排除标准;书写位置上,120篇将纳入、排除标准置于一般资料之前,33篇置于一般资料之后;有28篇将纳入标准的反面写入排除标准,形成“互补型”条件的情况。结论 目前诊断试验中的纳入、排除标准存在内容欠完整、位置不统一、内容重复的问题。本研究提出规范纳入、排除标准的三点要求,并初步拟定纳入、排除标准书写范式。
关键词:诊断试验;纳入标准;排除标准;质量分析;书写规范;
Quality evaluation of reports on inclusion and exclusion criteria in diagnostic tests
Abstract:Objective To analyze the quality of reports on inclusion and exclusion criteria from Chinese Core Journals of Peking University Library in the past five years, to find out the existing problems and to standardize the reports on inclusion and exclusion criteria. Methods We selected the clinical medical journals under the core catalog of Peking University, searched the diagnostic tests from January 1, 2017 to June 7, 2022, identified the inclusion and exclusion criteria, counted the number of articles missing inclusion and exclusion criteria, and analyzed the content and writing position of criteria. Standards of research reports on quality accuracy studies and quality evaluation tools of diagnostic accuracy studies 2 were also taken into consideration to identify the existing problems. Results A total of 226 diagnostic test reports were included in our study, in which there were neither inclusion nor exclusion criteria in 74 articles, no inclusion criteria in 97 and no exclusion criteria in 91. In terms of writing position, eligibility criteria reports were located before the general data in 120 articles, and after the general data in 33 articles.The exclusion criteria in 28 articles were the reverse side of inclusion criteria to form a "complementary" condition. Conclusion Incomplete reporting, inconsistent position, and duplicated contents are the three major problems in reports on inclusion and exclusion criteria. We thus proposed three requirements and drafted the writing from.
Keyword:diagnostic tests; inclusion criteria; exclusion criteria; quality analysis; writing norms;
制定纳入、排除标准(以下简称纳排标准)是临床试验中至关重要的一步。合理的纳排标准是保证试验顺利开展的前提,PAWLIK在《临床试验》[1]中提到:纳入标准是所有研究对象必须满足的条件,根据临床试验的目的确定,排除标准是符合纳入标准基础上的其他不满足试验要求的特殊情况。诊断试验往往基于横断面和病例对照设计[2,3],同时也应是真实世界的研究[4,5],其纳入的对象应包括目标疾病中的各种临床类型,也应包括需鉴别的疑似病例[6],若纳排标准有偏差,将会高估或低估试验的效能[7,8]。
目前,诊断试验的纳排标准无书写规范提供参考,导致临床研究中纳排标准的写法与内容各不相同[9],有些甚至缺乏纳排标准[10],影响诊断试验的质量和进行二次研究[11,12]。本研究检索近5年北京大学图书馆“中文核心期刊”(以下简称北大核心期刊)中的诊断试验,提取其中的纳排标准,分析书写现状和存在的问题,并查阅诊断试验报告规范和质量评价工具,为规范书写纳排标准提供思路与借鉴。
1 资料与方法
1.1 期刊遴选
北大核心期刊目录下临床医学类期刊,剔除康复、护理、影像类期刊后,纳入《中华检验医学杂志》《中华危重病急救医学》《中华临床医师杂志(电子版)》《中国循证医学杂志》《中华急诊医学杂志》《中国组织工程研究》《中国疼痛医学杂志》和《中国感染与化疗杂志》8本期刊。
1.2 文献检索
计算机检索中国知网(CNKI)数据库,检索范围为2017年1月1日至2022年6月7日北大核心期刊中临床医学目录下期刊,提取期刊中发表的诊断试验。检索公式为:TKA=(诊断)AND JN=(中华检验医学杂志、中华危重病急救医学、中华临床医师杂志、中国循证医学杂志、中华急诊医学杂志、中国组织工程研究、中国疼痛医学杂志、中国感染与化疗杂志)。
1.3 纳入标准
(1)诊断试验;(2)发表时间为2017年1月1日至2022年6月7日。
1.4 排除标准
(1)仅有摘要;(2)重复发表的研究。
1.5 资料提取
逐篇阅读文献,筛选出诊断试验。建立“诊断试验纳排标准信息表”,提取以下内容:篇名、年份、纳排标准内容及书写位置、研究设计类型,并将信息录入Excel表中。
2 结果
2.1 文献检索结果
共检索相关文献2086篇。阅读文题和摘要后,筛除不符合条件的1674篇,下载文献并阅读全文,筛除非诊断试验186篇,最终纳入226篇诊断性试验。其中《中华检验医学杂志》81篇、《中华急诊医学杂志》50篇、《中华危重病急救医学》35篇、《中华临床医师杂志(电子版)》31篇、《中国感染与化疗杂志》14篇、《中国组织工程研究》10篇、《中国循证医学杂志》3篇和《中国疼痛医学杂志》2篇。2017年39篇,2018年27篇,2019年54篇,2020年49篇,2021年47篇,2022年10篇。文献检索流程见图1。
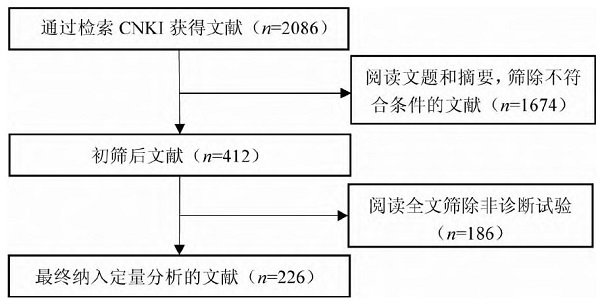
图1 文献检索流程与结果
纳入的8本期刊中,《中华检验医学杂志》近5年诊断试验的发文量最多,共计81篇,其次是《中华急诊医学杂志》和《中华危重病急救医学》,分别是50篇和35篇。《中华危重病急救医学》的纳排标准书写质量最高,35篇诊断试验中共28篇研究包含了完整的纳入标准和排除标准,部分研究还写明剔除标准,总体完整率高达80.0%,其次是《中华急诊医学杂志》和《中国组织工程研究》,分别达到了72.0%和70.0%。见表1。
近5年,诊断试验的发文量呈上升趋势,以2019年发文量最多,共54篇,其次为2020年和2021年。诊断试验中纳排标准的书写完整率有所提升,2018年的完整率为40.7%,2019年提升至44.0%,2021年纳排标准的书写质量最佳,完整率达到63.8%,详见表2。整体上,诊断试验中纳排标准的书写质量正在逐步提升。
表1 不同期刊诊断试验发文量以及纳排标准的完整率
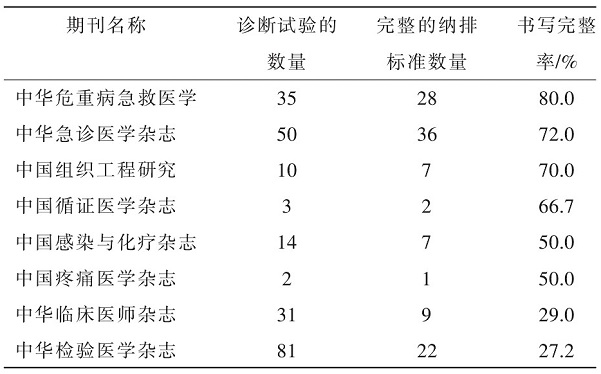
表2 近5年诊断试验发文数量以及纳排标准完整率

2.2 纳排标准的数量
226篇诊断试验中,112篇含有完整的纳排标准;74篇既无纳入标准,也无排除标准;23篇研究仅有排除标准,缺少纳入标准;17篇仅有纳入标准,缺少排除标准。详见图2。
根据RUTJES等[2]的研究,诊断试验有四类研究设计,分别为A型单门设计、B型单门设计、C型双门设计(健康人群对照)和D型双门设计(其他疾病对照),如图3所示。前两类设计使用统一的纳排标准纳入对象,后两类设计亦称为“病例对照设计”[13],通过双重的纳排标准,分别纳入疾病组和对照组进入研究。
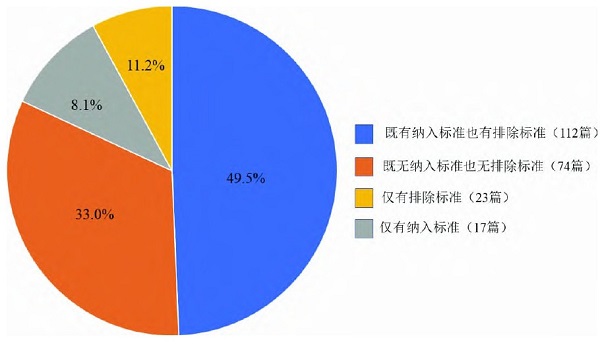
图2 含有/缺少纳入标准和排除标准的篇数
本文纳入的研究中,A型设计22篇、B型76篇、C型34篇、D型89篇。共123篇研究为双门设计,此类研究将试验人群分为对照组和疾病组,其中107篇的对照组缺少纳排标准。
2.3 纳排标准的书写位置
所有的纳排标准都置于研究的第一部分。这一部分内容中,除了纳排标准之外,还包含研究对象的一般资料,如疾病类型和病情严重程度等。其中120篇研究将纳排标准置于一般资料之前,32篇放置在一般资料之后。
2.4 纳排标准的书写内容
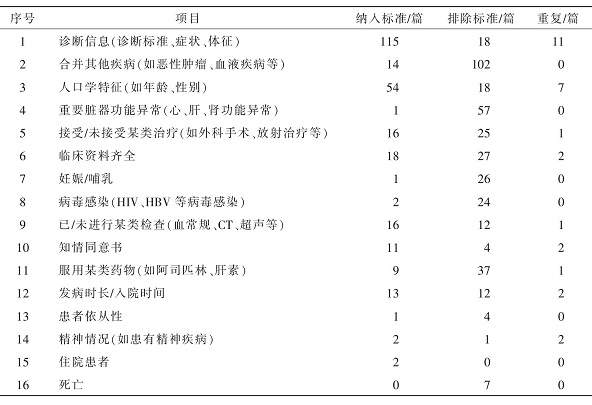
共提取130份纳入标准和134份排除标准。其中,115篇研究的纳入标准包含诊断信息,如症状、体征和诊断标准;54篇设定了纳入对象的人口学特征,如性别、年龄;18篇要求临床资料完整;11篇要求含有知情同意书。
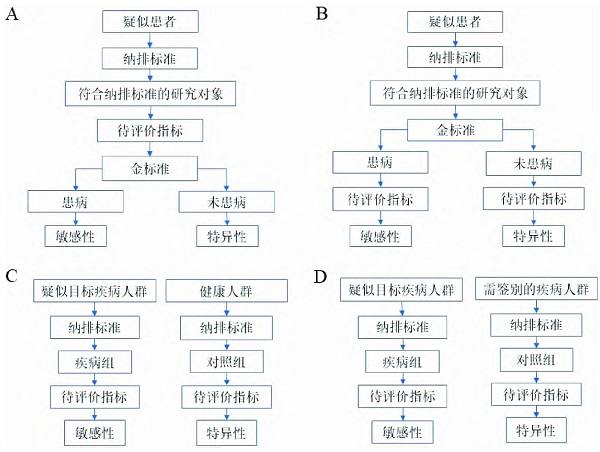
图3 诊断试验中的四种研究设计
注:A.A型单门设计,B.B型单门设计,C.C型双门设计(健康人对照),D.D型双门设计(其他疾病对照)。
102篇研究的排除标准剔除了合并其他疾病的患者,如恶性肿瘤、血液疾病等;57篇排除重要脏器功能异常的人群,如心、肝、肾衰竭;37篇排除服用某类药物的患者;27篇排除临床资料不齐全的研究对象;26篇排除妊娠或哺乳期女性。同时,有部分研究将纳入标准的反面写入排除标准,这种重复书写的情况出现在28篇研究中。详见表3。
3 讨论
3.1 纳排标准的内涵及关系
纳入标准是纳入对象必须满足的条件,一般较宽泛,内容简明扼要,通常包括诊断信息和人口学特征,排除标准是用来剔除满足纳入标准但不适合进入研究的个体[14,15]。因此,排除标准并非纳入标准的对立面,两者不是“互补”关系[16],而应以纳入标准为主,确定研究主体,以排除标准为辅,排除研究主体中会干扰结果的个体,两者关系如图4所示。
不恰当的纳排标准将影响研究的进展和结论的可靠性。过于严格的纳排标准,会降低研究的可行性,限制结论的外延性;过于宽泛的纳排标准,研究对象的异质性过高,会影响研究结论的可靠性[14]。因此,纳排标准应兼顾外延性和可靠性。
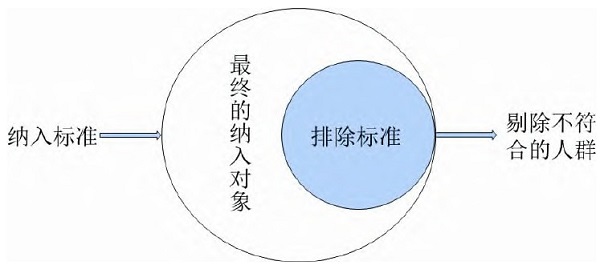
图4 纳入标准与排除标准的关系
3.2 纳排标准的主要问题
本研究结果显示,目前北大核心期刊所刊载的诊断试验中纳排标准存在3点不足:(1)内容欠完整;(2)位置不统一;(3)纳排标准内容重复。
3.2.1 内容欠完整
纳入226篇诊断试验中,74篇研究既无纳入标准也无排除标准,97篇无纳入标准,91篇无排除标准,缺乏纳排标准将无法客观地评估结论的有效性[17]。115篇纳排标准中无知情同意书,一部分随意放在文中的其他位置,知情同意书的书写位置决定了何时签署它[18],因此,应作为入选条件之一置于纳入或排除标准中;15篇缺乏诊断信息,无法得知纳入对象的疾病情况、症状和体征;123篇研究采用病例对照设计,大多数研究默认写明“诊断标准”可替代“纳入标准”,实际上,病例对照设计也应有明确的纳排标准[2],“诊断标准”如果作为纳入对象的标准之一,应置于纳入标准中。
3.2.2 位置不统一
根据诊断准确性研究报告标准(standards for reporting of diagnostic accuracy studies,STARD)报告规范[19],纳排标准是在研究开始之前确定的,一般资料是最终纳入对象的信息。因此,纳排标准应写在前,一般资料写在后。本研究发现,目前诊断试验中纳排标准的书写位置不统一,或在一般资料前,或在一般资料后,或包含于一般资料之中,不便于读者寻找纳排信息。
表3 纳入标准和排除标准的书写内容
3.2.3 纳排标准内容重复
纳排标准不是“互补关系”。在关于D-二聚体诊断髋关节置换后慢性假体周围感染的诊断试验中[20],纳入标准为D-二聚体、降钙素原和白细胞总数等指标齐全者,而排除标准是D-二聚体、降钙素原、白细胞总数等指标不齐全者,此为典型的“互补”条件。这种将纳入标准的反面写入排除标准是无意义的重复,在112篇同时含有纳排标准的研究中,28篇含有此类“错误的重复”,是由于对纳排标准定义不明确而造成的。
3.3 诊断试验相关规范中关于纳排标准的内容
在每年发表的诊断试验中,仅有约20%的研究报告遵循了STARD[21],其中有相当一部分研究缺少纳排标准。这将无法对研究存在的偏倚和适用范围进行判断,也无法准确评价诊断试验的有效性。为了规范纳排标准的书写,本文查阅STARD报告规范[22]、诊断准确性研究的质量评价工具(quality as-sessment of diagnostic accuracy studies,QUADAS)-2,诊断试验质量评价工具[23]以及国家药监局发布的相关规定[24],提取与纳排标准相关内容,总结如下:
3.3.1 STARD报告规范
(1)描述研究对象的入选条件;(2)描述潜在研究对象的特征,如症状、体征、病理资料等;(3)描述潜在研究对象纳入的时间和地点;(4)描述研究对象的纳入方式:连续纳入或随机纳入。
3.3.2 QUADAS-2质量评价工具
(1)是否描述病例的选择和纳入病例的情况?(2)是否连续或随机地纳入病例?(3)是否避免了病例对照设计?(4)是否避免了不合理的排除?
3.3.3《体外诊断试剂临床试验技术指导原则》
“受试人群应能够代表目标人群的特征,包括人口学特征(性别、年龄)、症状、体征、合并症以及疾病的阶段、部位和严重程度等;同时受试者应排除不适合该临床试验的生理或病理特征,并根据以上要求合理设计受试者的纳入和排除标准。”
综合以上内容,诊断试验中“纳入研究对象”应注意以下问题:(1)完整并具代表性的纳排标准;(2)尽量避免病例对照设计和不合理的排除;(3)详述纳入研究对象的时间和地点;(4)随机或连续地纳入研究对象。
3.4 诊断试验中纳排标准的书写建议
根据以上内容,诊断试验的纳排标准可从以下3点进行规范:
3.4.1 内容需完整
完整的纳排标准应同时包含纳入标准和排除标准,且诊断标准不能代替纳排标准。纳入标准的内容包括:诊断信息、人口学特征和知情同意书等。排除标准的内容可包括:合并其他疾病、重要脏器功能异常、妊娠/哺乳等,具体的内容应围绕研究目标来确定。
3.4.2 标准要统一
在诊断试验中,对照组和疾病组通过统一的纳排标准、连续募集研究对象的设计属于“单门设计”[7],这是最为理想的研究设计,即图3所示的A型单门设计。但目前很多研究尤其是回顾性研究,多预先设定好其他疾病与目标疾病进行鉴别,并招募一定数量的个体作为对照组,这属于“双门设计”。尽管这类设计易于开展,成本较低,适合于诊断试验初期,但应尽量避免仅有健康人群作为对照[25],且实验组和对照组都应具有相应的纳排标准[2]。
3.4.3 定义需明确
应明确纳入标准和排除标准的定义。纳入标准是研究对象入组的基本条件,排除标准是满足纳入标准但不适宜参与试验的特殊人群,两者不是正反面的关系。其次,在表达方式上,应尽量使用肯定句来表达,尤其在排除标准中,双重否定容易造成混淆。
除此之外,在书写纳排标准之前,应先阐述对象来源,包括纳入对象的时间、地点和方式(连续或随机)。并于纳排标准之后写明研究对象的一般资料。本研究初步拟定了纳排标准的书写范式。详见表4。应依次书写对象来源、纳排标准和一般资料,其具体内容应结合临床实际和研究目的确定。
表4 诊断试验中纳排标准的书写范式

在诊断试验中,不同患病率、不同的患者构成、不同的对照组会直接影响对诊断试验结果的评价[26,27]。因此,使用规范的纳排标准,一定程度上能降低因不合理的纳入对象造成的偏倚;另一方面,规范的纳排标准能便于读者判断结论的可信度和适用范围,更好地应用于临床实践,提升诊断试验的质量。
参考文献
[1] PAWLIK T M, SOSA J A. Clinical Trials[M]. Cham:Springer International Publishing, 2020.
[2] RUTJES AW S. Sources of bias and variation in diagnostic accuracy studies[D]. Amsterdam:University of Amsterdam, 2005.
[3]刘雅莉,彭晓霞《诊 断准确性研究证据质量评价:研究设计、偏倚风险、间接性》文献解读[J]中国循证儿科杂志,2021,16(6):469-471.
[4]胡志德,仲人前.诊断准确性试验的偏倚来源及其控制[J].临床与病理杂志,2015,35(2):177-183.
[5]张丽帆,刘晓清诊断试验准确性研究设计及临床应用[J]协和医学杂志, 2020,11(1):96-101.
[6]刘芬.诊断试验研究在医学科研中的理论、设计和实践[J].北京 医学,2020.4211)1151-1155.
[7] MANDER G T W, MUNN Z. Understanding diagnostic test accuracy studies and systematic reviews:A primer for medical radiation technologists[J]. Journal of Medical lmaging and Radiation Sciences, 2021, 52(2):286-294.
[8]彭晓霞,刘雅莉.《诊断准确性研究证据质量评价:不一致性、不精确性、发表偏倚以及其他》文献解读[J] .中国循证儿科杂志2021, 16(6):472-474.
[9] PORZSOLT F, WIEDEMANN F, BECKER S 1, et al. Inclusion and exclusion criteria and the problem of describing homogeneity of study populations in clinical trials[J]. BMJ EvidenceBased Medicine, 2019, 24(3):92-94.
[10]胡志德诊断准确性试验中的STARD报告规范自系统评价员的观点[J].临床与病理杂志,2016,36(8):1059-1061.
[11]张永刚,杨乐天,杨盎等.诊断准确性试验的系统评价/Meta分析报告规范(PRISMA-DTA)的解读[J].中国循证医学杂志.2018,18(9):1007-1016.
[12]曲艳吉,杨智荣,孙凤,等偏倚风险评估系列:(六)诊断试验[J]中华流行病学杂志.2018,39(4):524-531.
[13] RUTJES A W, REITSMAJ B. VANDENBROUCKE J P, et al.Case- control and two-gate designs in diagnostic accuracy studies[J]. Clinica1 Chemistry, 2005, 51(8):1335-1341.
[14] COLLI A, FRAQUELLI M, CASAZZA G, et al. The architecture of diagnostic research:Research guidelines using liver stiffness as an example[J]. Hepatology, 2014, 60(1):408-418.
[15] PATINO C M, FERREIRAJ C. Inclusion and exclusion criteria in research studies:Definitions and why they matter[J] Jornal Brasileiro De Pneumologia, 2018, 44(2):84.
[16]吴泰相,刘关键李静影响系统评价质量的主要因素浅析[J].中国循证医学杂志,2005,5(1):51-58.
[17]朱-丹,李 会娟.武阳丰诊断准确性研究报告规范(STARD)2015介绍与解读[J].中国循证医学杂志,2016, 16(6):730-735.
[18]张强蒙萍,单爱莲关于药物临床试验方案中纳入、排除标准的若干思考[J]中国临床药理学杂志,2017 ,33(2)-:99-101.
[19] COHEN J F, KOREVAAR D A, ALTMAN D G, et al. STARD2015 guidelines for reporting diagnostic accuracy studies: Explanation and elaboration[J]. Microbiology Spectrum, 2016, 6(11):e012799.
[20]刘永裕,徐景利,林天烨,等.D-二聚体诊断髋关 节置换后慢性假体周围感染的敏感性和特异性[J].中国组织工程研究,2021,25(12):1853-1857.
[21]臧长海李茁立.应用诊断准确性研究报告规范(STARD 2015)提高论文报告质量[J]山西医药杂志2018,47(8):883-885.
[22]陈新林,胡月莫传伟,等诊断准确性研究报告指南:S TARD2015简介[J]中国循证医学杂志,2016, 16(10):1227-1230.
[23] WHITING P F, RUTJES A W, WESTWOOD M E, et al. QUADAS -2:a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8):529-536.
[24]国家药品监督管理局关于发布体外诊断试剂临床试验技术指导原则的通告( 2021年第72号) [EB/OL].(2021-09-272022-4-30)http://pnlib.imu.edu.cn:80/rwt/CNKl/https/P75YPLUPNWZGCLUHN75C6Z5P/ylqx/ylqxggtg/20210927152837140.html.
[25]王巍巍,杨智荣,田金徽等诊断试验准确性研究系统评价和Meta分析摘要的报告规范(PRISMA-DTA for abstracts )解读[J].中国循证医学杂志,2021 ,21(10):1235-1240.
[26]翁可为诊断试验中研究对象选择的常见缺陷分析[J]现代实用医学2007,19(7):590-591.
[27]吕敏之.刘天舒.朱畴文新型冠状病毒肺炎诊断试验设计的思考[J].中国临床医学,2020,27(3):345-348.





