摘要:目的 分析苯丙氨酸羟化酶(PAH)基因突变与蛋白结构、功能改变的关系及其机制,为PKU的早期基因诊断与治疗提供参考。方法 选取云南地区汉族苯丙酮尿症(PKU)患者PAH基因突变研究中发现的6例数据库中未收录的外显子区域的新突变作为材料,通过生物信息学分析手段对其中1例错义突变和2例插入突变的基因突变所在外显子进行同源建模,探讨其空间构象变化和功能改变的关系,并尝试用剪接突变预测软件探讨剪接突变的致病机制。结果 同源建模结果显示,1例错义突变和2例插入突变的三级结构发生明显改变,从而影响蛋白的功能; 3例剪接突变分析显示c.441+2T>A突变可能导致外显子4的5'端发生了跳跃,c.842+4A>T突变可能导致外显子7的3'端发生了跳跃,c.1200+1T>G的突变可能是因为此突变降低了11内含子5'端的隐蔽剪接位点的活性,从而影响剪接。结论 6例新发突变中2例插入突变及1例错义突变对疾病的影响均较为深刻,并初步推测了3例剪接突变的剪接方式。
关键词:苯丙酮尿症; 苯丙氨酸羟化酶; 生物信息学; 基因突变; 表型; 蛋白结构与功能; 剪接突变;
Bioinformatics analysis of phenylalanine hydroxylase gene mutation
LAI Yijun CHEN Hong ZHANG Yinhong ZHANG Jie ZHU Baosheng TANG Xinhua
Abstract:Objective To analyze the relationship between phenylalanine hydroxylase( PAH) gene mutations and changes in protein structure and function,as well as its mechanism,in order to provide references for early gene diagnosis and treatment of PKU.Methods New PAH gene mutations in the exon region not included in database of 6 patients with phenylketonuria( PKU) from the Han in Yunnan Province were founded as materials.The homology modeling of exons of gene missense mutation in one case and the insertion mutation in two cases was performed by using bioinformatics analysis,and the relationship between spatial conformational changes and functional changes was explored.In addition,the disease mechanism of the splicing mutation was analysed by using the specialized online tools.Results The results of homology modeling showed that the tertiary structure of one missense mutation and two insertion mutations changed significantly,which affected the function of protein.The analysis of three splicing mutations revealed that the c.441+2 T>A mutation was likely to cause a jump at the 5' end of exon 4,and the c.842+4 A>T mutation was likely to cause a jump at the 3' end of exon 7; and the c.1200+1 T>G mutation probably due to the mutation reducing activity of the 5' end of the hidden splice site 11 intron,consequently affected the splicing. Conclusion Of the 6 new PAH gene mutations,the two insertion mutations and one missense mutation have a profound impact on the PKU,and three splicing methods for splicing mutations are predicted preliminarily.
苯丙酮尿症(phenylketonuria,PKU)是一种常见的氨基酸代谢障碍性疾病,属常染色体隐性遗传病,临床表现为智力低下、自闭症、运动障碍等[1]。该病主要因肝脏中的苯丙氨酸羟化酶(phenylalanine hydroxylase,PAH)缺乏或者活性不足导致苯丙氨酸不能正常代谢为酪氨酸而产生[2]。早在1983年PAH基因就被成功分离和克隆,并被公认为是PKU的致病基因[3]。近几年,随着基因组和外显子组测序的发展,很多新发突变,特别是一些症状相对较轻的突变也逐渐被检测出来[4]。截至目前,已经在患有PKU的患者中鉴定了约1 000种不同的PAH基因突变体[5]。并且PAH基因具有突变异质性,不同种族与地区的突变位点及分布有较大差异[6]。本研究采用云南省汉族PKU患者中发现的6例PAH基因新发突变为材料,从生物信息学角度分析PAH基因的错义突变与蛋白结构,以及进一步可能导致的功能改变的关系,并利用生物信息学方法尝试探讨新发剪接突变的发生机制,为以后关于PKU的研究提供有价值的信息。
1 材料与方法
1.1 材料
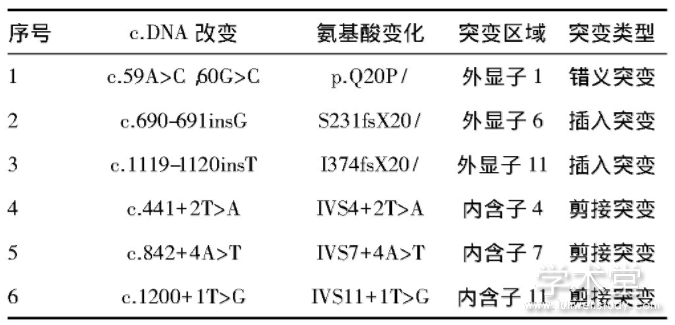
(1)6例数据库中未收录的PAH基因新突变见表1。(2)使用的网络资源,包括美国国立生物技术信息中心(NCBI,网址:https://www.ncbi.nlm.nih.gov/)、Swiss-Model软件(https://www.swissmodel.expasy.org/)、CRYP-SKIP(http://cryp-skip.img.cas.cz/)、BDGP软件(http://www.fruitfly.org/seq_tools/splice.html)、HSF(http://www.umd.be/HSF/)等。
表1 云南地区PKU患者PAH基因新突变[7]
1.2 方法
1.2.1 获取人类PAH基因全序列及其分析
从NC-BI的GenBank中基因数据库获取人类PAH基因组定位和其编码的蛋白质序列信息。
1.2.2 PAH新发错义突变及插入突变位点所在外显子的同源建模及功能分析
利用Swiss-model在线工具对1例错义突变和2例插入突变所在外显子区域进行外显子同源建模,分析基因突变对其所在外显子的蛋白结构和功能的影响。
1.2.3 PAH新发剪接突变的生物学效应分析
采用3种基于不同网络算法的生物信息学工具分析新发现的剪接变异。其中,在CRYP-SKIP界面上直接将变异序列按其要求的格式输入即可获得预测结果,包括因剪接变异导致的隐蔽剪接位点激活(PCR-E)和外显子跳跃(1-PCR-E)的可能性大小两个结果[8]。柏克莱果蝇基因组项目(Berkeley Drosophila Genome Project,BDGP)和人类剪接查找服务器(the Human Splicing Finder,HSF)可预测可能存在的隐蔽剪接位点及基因变异对剪接位点的改变,使用时分别将野生型基因序列和变异型基因序列进行在线分析,即可获得变异前后目标基因序列所有可能的剪接位点及分值。
2 结果
2.1 PAH结构
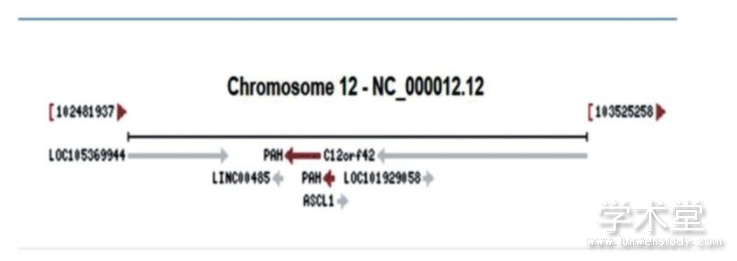
在GenBank中基因数据库查找PAH基因可知:PAH基因全长79 278 bp,位于人类12号染色体长臂上(12q23.2),包含13个外显子,12个内含子,CDS编码452个氨基酸,在66~1 421 bp见图1。
图1人类PAH基因结构
2.2 PAH突变位点外显子的同源建模及功能分析
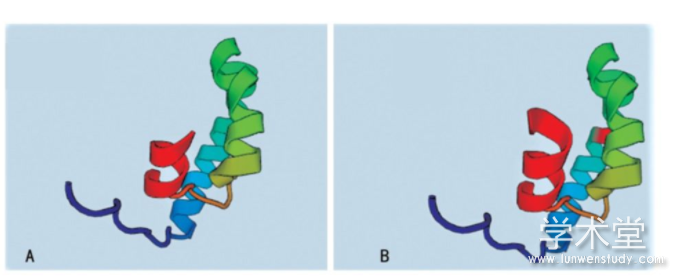
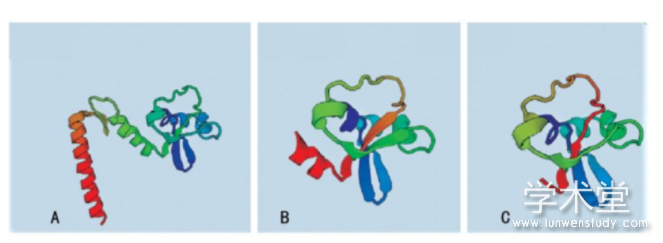
由于本研究中的3例突变分别发生在外显子1、外显子6和外显子11上,而外显子1因其序列太短未找到同源序列,因此将外显子1,2结合起来对外显子1处发生的点突变(c.59A>C,60G>C)进行同源建模,并对突变后的外显子6和外显子11分别进行同源建模,见图2。其中,图2A是正常的外显子1,2结构,图2B是点突变(c.59A>C,60G>C)突变后的外显子1,2预测结构,可以看出突变导致外显子的一处β片层消失。图3A是正常的外显子6的空间结构,图3B中由于(c.690-691insG),导致移码突变S231fsX51,即该三联密码子下游第51位氨基酸处蛋白合成终止,致使外显子6的空间构象发生明显改变。外显子11上的第1 119位和1 120位插入碱基T(c.1119-1120insG),导致移码突变I374fsX,即374位后第20位氨基酸处蛋白合成终止,由于此处突变可能会影响外显子12和13的合成,因此选择从正常的外显子10开始到外显子13进行同源建模,同时对(c.1119-1120insG)突变后的外显子10之后的部分进行同源建模。图4A是正常的外显子10,11,12,13的结构;图4B是正常的外显子10,11的结构;图4C是(c.1119-1120insG)突变后外显子10,11,12,13的结构,可以看出(c.1119-1120insG)的突变导致外显子11三级结构部分缺失。
2.3 PAH新发剪接突变的生物学效应分析
经3种生物信息学软件综合分析上述突变,CRYP-SKIP预测值中,PCR-E(在右边的刻度盘上用红色指针表示)取值介于0和1之间,较高的值表示支持隐蔽剪接位点激活,较低值则表示支持外显子跳跃。突变预测结果显示c.441+2T>A突变后第4外显子5'端产生隐蔽剪接位点(PCR-E)的可能性为0.35,3'端的值接近于0,c.842+4A>T突变后第7外显子5'端产生隐蔽剪接位点(PCR-E)的可能性为0.39,3'端的值接近于0。c.1200+1T>G突变后外显子11中5'端产生隐蔽剪接位点(PCR-E)的可能性为0.66,3'端的值接近于0。
BDGP显示正常PAH基因第4内含子5'端剪接位点(AGgt,g为突变处)的预测值为0.94(预测值为0~1),c.441+2T>A突变后第4内含子5'端剪接位点(AGgt,g为突变处)的预测值则为0.96(预测值为0~1),而IVS4+2T>A和IVS7+4A>T突变后BDGP预测值均消失(预测值为0)。
HSF预测中CV值高于80者具有较强剪接信号,CV值为70~80的剪接位点剪接信号较弱,少部分剪接位点的CV值为65~70[9](预测值为0~100)。预测结果显示c.441+2T>A使第4内含子的5'剪接供体共识值(CV值)由正常的83.22变为56.39。c.842+4A>T使第7内含子的5'剪接供体CV值为由82.11变为73.32,而3'剪接受体CV值由68.35变为39.4。c.1200+1T>G突变使第11内含子的5'剪接供体CV值为由95.95变为69.12,而3'剪接受体CV值并无明显变化。
图2外显子1,2的同源建模结果
A:正常的外显子1,2结构;B:外显子1处点突变突变后的预测结构
图3外显子6 的同源建模结果
A:正常外显子6的空间结构;B:外显子6空间构象发生改变
图4外显子1 0-13的同源建模
A:正常的外显子10,11,12,13的结构;B:正常的外显子10,11的结构;C:突变后外显子10,11,12,13的结构
3 讨论
一般认为,PKU是由于PAH基因突变引起PAH蛋白功能损坏或丧失而导致的,PAH基因中细微的改变都会引起酶蛋白三维结构的改变,并可造成PAH活性降低甚至完全丧失,导致在临床上产生PKU病患。而PAH蛋白的三级结构是一个同源四聚体。此前对于PKU基因型与表型关系的研究多是利用质谱技术和X射线衍射技术构建PAH的3D晶体结构模型来进行的[10],而最新研究发现了全长哺乳动物(大鼠)PAH的第1个X射线晶体结构[11]。本研究中使用Swiss-model对1例错义突变和2例插入突变所在的第1、第6和第11外显子的同源建模分析中发现(c.59A>C,60G>C)突变导致外显子1,2区域的片层结构消失,另外此突变位于外显子与内含子的交界处,可能会严重影响PAH基因后续的转录、翻译和蛋白折叠等[6]。(c.690-691insG)突变导致外显子6的空间构象发生改变;而外显子11上的(c.1119-1120insG)突变不仅影响了外显子11的空间构象,并且严重影响了后续外显子12和外显子13的构象,这3例突变预测的结果显示突变会直接影响PAH单体的结构完整性。而最近有研究揭露PKU相关的基因突变会对PAH同源四聚体的稳定性产生影响,造成PAH蛋白不同程度的降解,从而导致严重的PKU表型[12]。例如PAH基因R408W突变后导致翻译的蛋白质极易降解,最终在患者体内或体外测不出PAH,从而导致严重的PKU表型,而R413P突变则导致PAH四聚体结构的高度不稳定,影响正常的单体状态和蛋白酶的功能,临床表现为严重代谢障碍型PKU。所以作者大胆推测,这3例突变甚至有可能导致突变体的稳定性受到影响,致使PAH蛋白降解,从而影响其功能。
目前,在PKU相关的PAH基因缺陷中,约13%的突变影响保守的3'和5'剪接位点,而大多数报道的剪接突变都是通过影响5'端剪接供体位点从而引起疾病的[13]。本研究中对于3种剪接突变的多种预测结果显示,第7内含子处的c.842+4A>T突变可能导致外显子的3'端发生了跳跃,第4内含子的c.441+2T>A突变和第11内含子处c.1200+1T>G的突变都有可能是由于外显子的5'端影响剪接,其中第4内含子的c.441+2T>A突变可能原因是其5'端发生了跳跃。在最近一项PAH基因外显子11处两个致病剪接突变(c.1199+17G>A和c.1199+20G>C)的研究中发现,与5'剪接位点相结合的小核糖核蛋白颗粒U1 snRNA在与外显子11的剪接过程中起着重要作用,而突变则会破坏U1 snRNA和内含子5'剪接位点的结合,从而影响剪接。此外还证明了通过修饰U1 snRNA可以实现对剪接突变的校正[14]。本研究中第11内含子处c.1200+1T>G突变的预测结果说明,突变可能降低了11内含子5'端隐蔽剪接位点的活性,但c.1200+1T>G突变是否同样破坏U1 snRNA和内含子5'剪接位点的结合还不得而知,需要进一步的实验验证。
尽管本研究采用生物信息学方法对PAH基因突变进行了分析,但基因突变对功能的影响是一个复杂的过程,且生物信息学方法还有待提升,具体的基因突变与功能的关系及突变后的机制还要以实验结果为准,这需要后续进一步的系统研究。
参考文献
[1] FLLING A.Uber ausscheidung von phenylbrenztraubensaure in den harn als stoffweshselanomalie in verbindung mit imbezillitat[J].Hoppe-Seylers Z Physiol Chem,2009,277(1/4):169-181.
[2] YILDIZ Y,DURSUN A,TOKATLI A,et al.Partial hydatidiform mole in a phenylketonuria patient treated with sapropterin dihydrochloride[J].Gynecol Endocrinol,2017,33(1):19-20.
[3] WOO S L,LIDSKY A S,GUTTLER F,et al.Cloned human phenylalanine hydroxylase gene allows prenatal diagnosis and carrier detection of classical phenylketonuria[J]. Nature,1983,306(5939):151-155.
[4] LEK M,KARCZEWSKI K J,MINIKEL E V,et al.Analysis of protein-coding genetic variation in 60,706 humans[J]. Nature,2016,536(7616):285-291.
[5] BLAU N.Genetics of phenylketonuria:then and now[J].Hum Mutat,2016,37(6):508-515.
[6]张志,何蕴韶.苯丙酮尿症分子遗传学研究进展[J].遗传,2004,26(5):729-734.
[7]唐新华,陈红,章印红,等.云南地区汉族苯丙酮尿症患者苯丙氨酸羟化酶基因突变的研究[J].中华医学遗传学杂志,2015,32(2):153-157.
[8] DIVINA P,KVITKOVICOVA A,BURATTI E,et al.Ab initio prediction of mutation-induced cryptic splice-site activation and exon skipping[J].Eur J Hum Genet,2009,17(6):759-765.
[9] DESMET F O,HAMROUN D,LALANDE M,et al. Human Splicing Finder:an online bioinformatics tool to predict splicing signals[J].Nucleic Acids Res,2009,37(9):e67.
[10] KOBE B,JENNINGS I G,HOUSE C M,et al.Structural basis of autoregulation of phenylalanine hydroxylase[J].Nat Struct Biol,1999,6(5):442-448.
[11] ARTURO E C,GUPTA K,HROUX A,et al.First structure of full-length mammalian phenylalanine hydroxylase reveals the architecture of an autoinhibited tetramer[J]. Proc Natl Acad Sci U S A,2016,113(9):2394-2399.
[12] SCHELLER R,STEIN A,NIELSEN S V,et al.Toward mechanistic models for genotype-phenotype correlations in phenylketonuria using protein stability calculations[J].Hum Mutat,2019,40(4):444-457.
[13] KRAWCZAK M,THOMAS N S,HUNDRIESER B,et al.Single base-pair substitutions in exon-intron junctions of human genes:nature,distribution,and consequences for mRNA splicing[J].Hum Mutat,2007,28(2):150-158.
[14] MARTINEZ-PIZARRO A,DEMBIC M. Intronic PAH gene mutations cause a splicing defect by a novel mechanism involving U1snRNP binding downstream of the 5'splice site[J].PLoS Genet,2018,14(4):e1007360.