探索CeA在抑郁以及抑郁引起的痛觉减退中的作用
时间:2014-07-16 来源:未知 作者:学术堂 本文字数:4858字
临床上经常观察到抑郁和疼痛两种疾病的共病现象。疼痛特别是慢性痛,经常伴随抑郁症状的存在,而抑郁症患者也会伴发腰背痛、关节痛等多种躯体症状。阐明两者共病的机制对于临床慢性痛的治疗有重要的意义。近年来,在临床和实验室研究中均发现抑郁会降低个体对诱发痛的敏感性,但目前对这一现象的潜在机制并没有详尽的研究。抑郁会伴随杏仁核活动增加,同时杏仁核也参与对疼痛信息的加工与调控。杏仁中央核 (CeA) 是杏仁核的主要输出核团,所以本研究利用慢性不确定温和应激 (UCMS) 建立大鼠抑郁模型,然后在 CeA内注射 GABAA受体激动剂蝇蕈醇 (muscimol),通过抑制 CeA 的活动,观察大鼠抑郁样行为以及辐射热诱发痛行为的改变,旨在探索 CeA 在抑郁以及抑郁引起的痛觉减退中的作用。
方 法
1. 动物分组与实验流程
选用体重为 220 ~ 250 g 的成年雄性 wistar 大鼠50 只,军事医学科学院实验动物中心提供。动物自由进食,单笼饲养于 22℃和 12 h 昼夜循环的环境中。
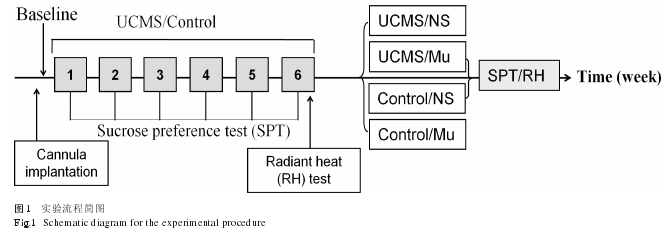
动物在正式实验前适应 1 周,每天抚摸 3 ~ 5 min。动物适应期结束后,测试基线糖水偏好和辐射热痛阈。根据糖水偏好和辐射热痛阈值将 50 只大鼠分为正常 / 盐水 (n = 12)、正常 /muscimol (n = 12)、UCMS/ 盐水 (n = 13) 和 UCMS/muscimol (n = 13) 4组进行实验。UCMS 组大鼠接受为期 6 周的慢性不确定温和应激,正常(控制)组不做任何处理。应激过程中,每周一次固定时间测试动物的糖水偏好和体重。6 周后,再次测试所有动物的辐射热痛阈。
第 6 周糖水偏好测试之后 2 d,根据分组向大鼠双侧CeA 微量注射 GABAA受体激动剂 muscimol 或同等体积的生理盐水,1 h 后进行糖水偏好测试。2 d 后,再次根据分组向大鼠双侧 CeA 微量注射 muscimol或同等体积的生理盐水,1 h后进行辐射热痛阈测试。
实验流程简图(见图 1)。整个实验中抑郁组动物和控制组动物独立饲养在不同的房间,以避免相互影响。
大鼠 UCMS 抑郁模型的建立方法为:以 2 周为一个周期,各种应激以伪随机的方式给予。应激包括 22 h 和 40 h 的水剥夺;20 h 和 22 h 的食物剥夺;1 h 的空瓶应激 ( 在断水 40 h 后立即给予空瓶 );1次3 h的限制饮食(在断食20 h后给予两小片食物);8 h 和 16 h 的斜笼子 (45 度 );7 h 和 8 h 的频闪光;2 次 16 h 的群养 (8 只老鼠 1 个笼子 );2 次 16 h 的持续照明;2 次 5 h 的白噪音 (75 dB);2 次 16 h 的气味应激;2 次 30 min 的热房间以及 2 次 30 min 的冷房间。
抑郁大鼠接受持续连续 6 周的应激,抑郁水平通过糖水偏好测试测定。糖水测试在动物应激前(基线水平 ) 以及应激过程中每周测试一次。实验前进行糖水测试的训练,给予动物1瓶水和1瓶糖水(1%蔗糖溶液 ),24 h 后,糖水和水瓶左右交换,再给予 24 h。让动物习惯分辨糖水和水。然后,进行正式的糖水基线的测试,断水断食 22 h 后,同时给予动物 1 瓶水和 1 瓶糖水,让动物自由饮用 1 h。通过称量测试前后糖水和水的重量,计算大鼠在 1 h内饮用糖水和水的重量,再依据下列公式计算大鼠糖水偏好值: 糖水偏好 = 糖水的饮用量 /( 糖水的饮用量 + 水的饮用量 )×100%。
3. 辐射热痛阈测定
辐射热通过 1 个 100 瓦的灯泡给予,光线经聚焦后由直径 4 mm 的小孔投射出来,透过 1 mm 厚的有机玻璃板垂直照射大鼠后肢足底,动物出现回避行为后手动关闭辐射热灯。抬脚潜伏期是指每次开始给予足底热刺激直到大鼠抬脚之间的时间间隔。设定最大结束时间为 22 s,以防止组织损伤。
调整照射强度使得正常大鼠的抬脚潜伏期为 10 s 左右。每只大鼠接受 5 次足底热刺激,同 1 只大鼠两次热辐射刺激之间至少间隔 5 min,取后 4 次热辐射刺激的缩脚阈值进行平均用于统计学检验。
4. 埋管手术及脑内微量注射
1% 戊巴比妥钠 50 mg/kg 腹腔注射麻醉大鼠。不锈钢套管 (30 gauge) 通过立体定位系统埋入 CeA,CeA 脑区的定位为前囟后 2.8 mm,旁开 4.0 mm,距离颅骨表面深 7.5 mm。引导套管用 3 个螺丝以及牙科水泥固定于颅骨。直到注射药物前每个引导套管用 1 个消毒的套管芯使之保持封闭。大鼠休息 7 d 后进行正式实验。
微量注射针通过引导套管直到最底端低于引导套管 1 mm。微量进样器连接一个内含空气泡的聚乙烯导管,监测皮层内给药。将 muscimol ( 购于 Tocris 公司 , 产自 Ellisville) 微量注射到双侧 CeA( 每侧 0.5 μg/0.5 μl,溶于生理盐水 ),此剂量的muscimol 可以有效地抑制 CeA 的活动。对照组大鼠接受相同体积的生理盐水。注射过程持续 1 min,之后注射针在套管中停留 1 min,使得针尖处的药物最大限度扩散。
5. 组织学定位
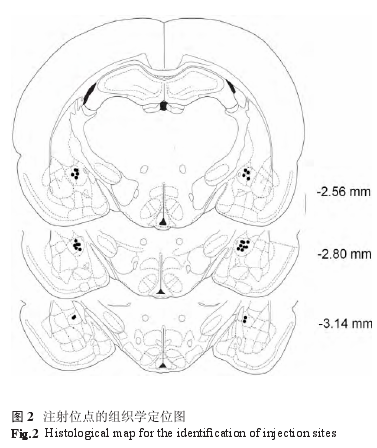
实验结束后,在大鼠 CeA 内注射 1% 的滂胺天蓝 0.5 μl,灌流取脑,冰冻切片 (50 μm 厚 )。切片用 HE 染色。根据图谱在显微镜下鉴定微量注射点位置 , 定位不准确者不列入统计。注射位点的组织学定位(见图 2)。
应用 Prism 5.0 统计软件包分析数据和作图,数据以均数 ± 标准误 (x±SEM ) 表示。数据包含两个或者三个因素的情况下采用多因素方差分析,Bonferroni 作为多重比较的事后检验方法。以 P <0.05 为差异有统计学意义。
结 果
1.UCMS 抑郁模型的建立以及抑郁引起的痛觉减退
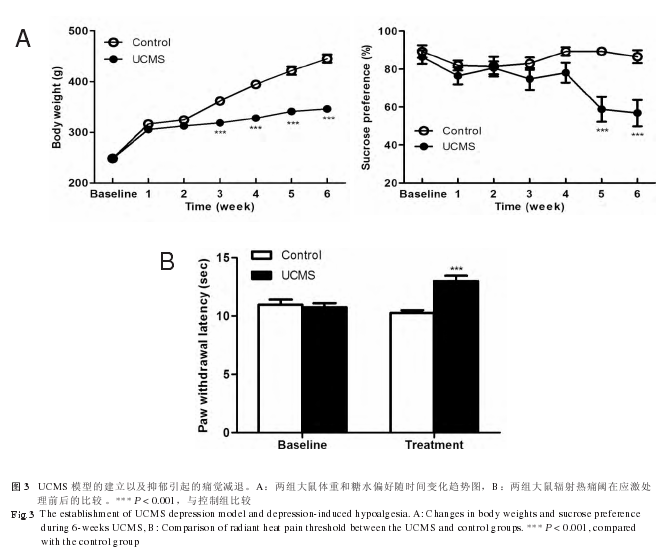
在基线水平上,即应激处理之前,控制组与UCMS 组的体重和糖水偏好差异均无统计学意义 (P >0.05)。经过 6 周应激后,UCMS 组与控制组相比体重显着降低 (P < 0.001,见图 3A),两组在第 3 ~ 6周差异均有统计学意义 (P < 0.001)。UCMS 组糖水偏好值也显着降低 (P < 0.001),两组在第 5、6 周差异存在统计学意义 (P < 0.001),表明 UCMS 抑郁模型成功建立。另外,两组大鼠在应激处理之前辐射热痛阈差异无统计学意义,但经过 6 周应激后,UCMS 组痛阈显着增加 (P < 0.001),提示抑郁状态下大鼠对热诱发痛的敏感性降低 ( 见图 3 B)。
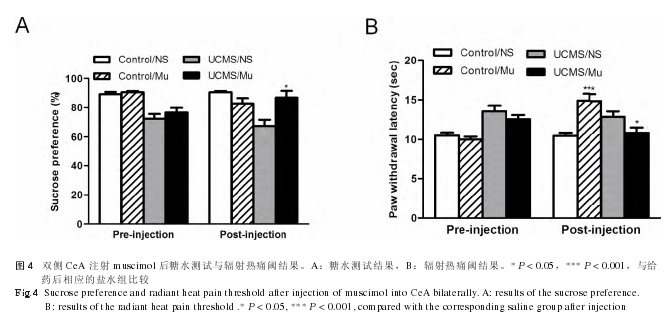
对于控制组来说,双侧 CeA 内注射 GABAA受体激动剂 muscimol 与注射生理盐水相比,糖水偏好差异无统计学意义 (P > 0.05);而 UCMS 组注射muscimol 后糖水偏好显着增加 (P < 0.05),表明抑制 CeA 的活动能够缓解抑郁症状 ( 见图 4A)。另外,双侧 CeA 内注射 muscimol 后控制组辐射热抬脚潜伏期显着增加 (P < 0.001),而 UCMS 组抬脚潜伏期则显着降低 (P < 0.05),恢复到正常水平,与控制 /盐水组没有显着差异 (P > 0.05,见图 4 B)。
本研究发现向 UCMS 抑郁造模后的大鼠 CeA内注射 muscimol 抑制 CeA 的活动可以缓解抑郁水平以及抑郁产生的痛觉减退。在本研究中笔者采用了大鼠的 UCMS 抑郁模型模拟临床抑郁患者。该模型由一系列慢性的不确定预期的温和应激组成,模拟人类日常生活中遇到的各种应激。经过 6 周的应激处理,UCMS 组大鼠与控制组相比体重显着降低,糖水偏好下降,抑郁模型成功建立。同时笔者发现UCMS 组大鼠的辐射热诱发痛阈显着增加,这一结果再次验证了本次研究之前的结论,即抑郁会降低个体对诱发痛的敏感性。
抑郁状态会伴随杏仁核在结构和功能上都发生改变。抑郁患者杏仁核的体积增大,在清醒和睡眠状态下杏仁核局部脑血流量增加,并且抗抑郁治疗可以降低杏仁核的活动。杏仁核活动异常增加可能与 GABA 受体功能降低有关,有研究发现自杀的抑郁患者杏仁核内 GABAA受体的 mRNA 表达降低。所以在本研究中向 UCMS 抑郁样大鼠杏仁中央核内注射 GABAA受体激动剂抑制杏仁中央核的活动使糖水偏好增加,缓解了大鼠的抑郁症状。
杏仁核是疼痛下行调控的重要结构,参与情绪对疼痛的调控。杏仁中央核是杏仁核的主要输出核团,它接收基底外侧杏仁核传入的与情绪有关的信息,并将其与脊髓 - 臂旁 - 杏仁中央核上传的伤害性信息进行整合。由杏仁中央核下行投射到中脑导水管周围灰质(Periaqueductal gray, PAG)经由延髓头端腹内侧区(Rostral ventromedial medulla,RVM)RVM 作用于脊髓的疼痛下行抑制通路是情绪镇痛的重要路径。抑郁状态下个体对诱发痛敏感性降低可能是杏仁中央核活动异常增加,疼痛下行抑制路径过度激活所致。所以本研究中向 CeA 内注射 muscimol 可能使疼痛下行抑制降低,从而减轻了抑郁引起的诱发痛不敏感。
另外,本研究发现向正常大鼠 CeA 内注射muscimol 使辐射热抬脚潜伏期显着增加。前人的研究发现损毁杏仁核后虽然应激镇痛消失,但并不影响甩尾测试的基线值。也有研究发现损毁或抑制 CeA 的活动只影响疼痛的情绪维度,对感觉维度没有影响。在本研究中,笔者采用的是相对较高的剂量 (500 ng),有文献报道高剂量 (>200 ng) 的muscimol 有镇静作用,可能会影响运动功能。与甩尾测试相比,抬脚反应更多依赖于许多肌群的协调工作,所以本研究中抬脚潜伏期增加可能与高剂量 muscimol 的镇静作用有关。
综上所述,UCMS 抑郁样大鼠杏仁中央核内注射 muscimol 抑制杏仁中央核活动可以缓解抑郁水平以及抑郁引起的痛觉不敏感。所以,杏仁中央核活动异常增加是抑郁引起痛觉异常的重要原因。
这为临床上探索抑郁与疼痛共病的机制提供了重要证据。
参 考 文 献
[1] Bar KJ, Terhaar J, Boettger MK, et al. Pseudohypoalge-sia on the skin: a novel view on the paradox of painperception in depression. J Clin Psych-opharmacol,2011, 31:103 ~ 107.
[2] Kundermann B, Hemmeter-Spernal J, Strate P, et al .Pain sensitivity in major depression and its relationshipto central serotoninergic function as reflected by theneuroendocrine response to clomipramine. J PsychiatrRes, 2009, 43:1253 ~ 1261.
[3] Davidson RJ, Pizzagalli D, Nitschke JB, et al. Depressi-on: perspectives from affective neuroscience. Annu RevPsychol, 2002, 53: 545 ~ 574.
[4] Neugebauer V, Li W, Bird GC, et al. The amygdala andpersistent pain. Neuroscientist, 2004, 10: 221 ~ 234.
[5] Hasanein P, Mirazi N, Javanmardi K. GABAAreceptorsin the central nucleus of amygdala (CeA) affect on painmodulation. Brain Res, 2008, 1241: 36 ~ 41.
[6] Shi M, Wang JY, Luo F. Depression shows divergenteffects on evoked and spontaneous pain behaviors inrats. J Pain, 2010, 11: 219 ~ 229.
[7] Lange C, Irle E. Enlarged amygdala volume and reduc-ed hippocampal volume in young women with majordepression. Psychol Med, 2004, 34: 1059 ~ 1064.
[8] Poulter MO, Du L, Zhurov V, et al. Altered Organizationof GABA(A) Receptor mRNA Expression in the Depre-ssed Suicide Brain. Front Mol Neurosci, 2010, 3: 3.
[9] Gauriau C, Bernard JF. Pain pathways and parabrachialcircuits in the rat. Exp Physiol, 2002, 87: 251 ~ 258.
[10] Fox RJ, Sorenson CA. Bilateral lesions of the amygdalaattenuate analgesia induced by diverse environmentalchallenges. Brain Res, 1994, 648: 215 ~ 221.
[11] Helmstetter FJ, Bellgowan PS. Lesions of the amygdalablock conditional hypoalgesia on the tail flick test. BrainRes, 1993, 612: 253 ~ 257.
[12] Manning BH, Martin WJ, Meng ID, et al . The rodentamygdala contributes to the production of cannabinoidi-nduced antinociception. Neuroscience, 2003, 120: 1157 ~1170.
[13] Tanimoto S, Nakagawa T, Yamauchi Y, et al. Differentialcontributions of the basolateral and central nuclei of theamygdala in the negative affective component of chem-ical somatic and visceral pains in rats. Eur J Neurosci,2003, 18: 2343 ~ 2350.
[14] Enna SJ, McCarson KE. The role of GABA in themediation and perception of pain. Adv Pharmacol,2006, 54: 1 ~ 27.
[15] Gilbert AK, Franklin KB. GABAergic modulation of des-cending inhibitory systems from the rostral ventromedialmedulla (RVM). Dose-response analysis of nociceptionand neurological deficits. Pain, 2001, 90: 25 ~ 36.
[16] Mogil JS. Animal models of pain: progress and challen-ges. Nat Rev Neurosci, 2009, 10: 283 ~ 294.
- 相关内容推荐
- 探索人体生理学与病理生理学之间的课程融合关联2018-06-26
相近分类:
推荐阅读





