河南华溪蟹MT的mAb的制备及其鉴定
时间:2014-07-07 来源:未知 作者:小韩 本文字数:5760字
金属硫蛋白( metallothionein,MT) 于 1957 年由哈佛大学的 Margoshes 和 Vallee 在研究马肾脏蓄积镉的过程中首次发现并分离,是一类低分子质量( Mr) 、富含半胱氨酸、不含芳香族氨基酸和组氨酸、能被多种金属诱导并结合多个金属原子的非酶类蛋白质.
MT 普遍存在于生物界中,在生物体内其所有的半胱氨酸均处于还原状态,具有清除体内自由基、解除重金属毒性、增强机体对各种不良适应能力等功能.
特别是作为一种重要的重金属解毒蛋白,体内唯一能有效解离、解毒重金属的一种生物途径,MT 成为重金属污染监测和治理的研究热点.重金属进入机体可特异性诱导 MT 的高水平表达,进而螯合一定的重金属形成重金属-MT 复合物,或者夺取与其他功能蛋白结合的重金属离子来降低功能蛋白的损伤,减少重金属对组织的损害.由于水生生物体内的MT与水环境和体内组织中重金属之间显著的相关性,因而生物组织中的 MT 含量可以作为水环境监测重金属暴露的一个分子生态毒理学指标,为确定水环境污染程度提供客观和全面的指标.现阶段 MT含量的测定方法主要有金属结合法、电化学法、色谱分析法等,因 MT 蛋白的特殊性,上述测定方法无一不受 MT 结合金属种类、MT 同形体多态性等因素的影响而对结果产生偏差.受制于 MT 定量测定方法的限制,MT 在环境监测中的应用尚未进一步开发。目前许多学者通过制备特异性抗体建立免疫学检测方法定量检测 MT,相关报道主要集中在鱼类和贻贝、牡蛎等海洋动物中,且主要通过制备多克隆抗体来实现.而与淡水蟹类的相关研究,特别是 MT单克隆抗体( monoclonal antibodies,mAb) 制备尚未见报道。
河南华溪蟹( Sinopotamon henanense) ,由海洋蟹多元转化而成,终身栖息于淡水中,属于甲壳纲、十足目中一个特殊分支。作为生活于水体基底层的低等生物,溪蟹直接面对沉积在水体的金属离子,是一种理想的水环境监测指示生物.本研究在原核表达纯化重组河南华溪蟹 MT 的基础上,制备其 mAb,为深入研究 MT 的生物学功能以及建立快速、敏感的新型免疫学检测方法奠定基础。
1 材料和方法
1. 1 材 料
重组工程菌 PET-28a-SUMO-MT /BL21 ( DE3 ) 、phoA-MT / BL21( DE3 ) 由本实验室构建、保存。 健康雌性BALB / c 小鼠购自北京维通利华实验动物技术有限公司;Quick Antibody-Mouse5W 免疫佐剂购自北京康碧泉生物技术公司; PEG1500 购自 Roche 公司; HT、HAT、ITS 合剂、青-链霉素、胰岛素、L-谷氨酰胺、抗体亚类鉴定试剂盒均购自Sigma公司; NCTC-109 培养基购自 Gibco 公司; DMEM / F12 培养基、胎牛血清购自 HyClone 公司; β-巯基乙醇购自北京索莱宝科技有限公司; PVDF 膜、NC 膜购自 Bio-Rad 公司; HRP 标记的山羊抗小鼠 IgG 购自 GeneTex 公司; 碱性磷酸酶( alkalinephosphatase,AP) 标记的山羊抗小鼠 IgG 购自生工生物工程( 上海) 股份有限公司; 邻苯二胺( o-phenylenediamine,OPD)和 NBT/BCIP 显色剂购自 Amresco 公司; 其余常规试剂均为国产分析纯。HGPRT 缺陷型小鼠骨髓瘤细胞株 Sp2/0 购自中国典型培养物保藏中心,融合前经 8-氮鸟嘌呤筛选 2 周。
1. 2 方法
1. 2. 1 抗原的制备 免疫用抗原小泛素样修饰蛋白-金属硫蛋白( small ubiquitin-like modifier-metallothionein,SUMO-MT)的制备: 重 组 工 程 菌 PET-28a-SUMO-MT/ BL21 ( DE3) 经1 mmol / L IPTG 诱导表达可溶性重组融合蛋白 SUMO-MT,利用 Ni 离子螯合柱分离纯化后超滤浓缩交换至 pH7. 8、0. 01 mol / L Tris-HCl 储存液,操作步骤依据文献方法进行.检测用抗原 His-MT 的制备: MT 基因片段与质粒 phoA 通过NcoⅠ和 BamHⅠ双酶切位点进行连接,转化大肠杆菌 BL21( DE3) 构建重组工程菌 phoA-MT/BL21( DE3) ,经低磷酸盐诱导后分泌表达可溶性重组蛋白 His-MT,同样经 Ni 离子螯合柱分离纯化,超滤浓缩交换至储存液保存。
1. 2. 2 动物免疫 选择 6 周龄雌性 BALB / c 小鼠,取纯化后的重组 SUMO-MT 蛋白免疫小鼠。初次免疫用免疫抗原SUMO-MT与等体积 Quick Antibody-Mouse5W 水溶性免疫佐剂迅速混合后,于小鼠后腿小腿肌肉注射免疫,每只小鼠注射100 μL,免疫剂量为 25 μg.免疫前尾部静脉取血作为阴性对照。3 周后按照同样的方式加强免疫 1 针。5 周后,采微量尾血进行间接 ELISA 检测。当血清滴度达到要求后,融合前3 d 加倍剂量与等体积生理盐水混匀,腹腔注射冲击免疫。融合前,小鼠摘除眼球取血,并分离血清作为阳性对照。
1. 2. 3 细胞融合 将免疫小鼠脾细胞悬液和生长状态良好的 Sp2/0 细胞以 10∶1 的比例在 PEG1500 作用下进行融合,融合前 PEG1500 于 50 mL/L CO2培养箱中孵育 24 h.加入含HT 筛选培养基 ( 含 50 mL / L DMEM / F12 培养基、10 mL / LNCTC-109 培养基、20 mL / L 胎牛血清和 1 mL / L ITS 合剂) ,接种 于 96 孔 培 养 板 中,1 × 106/ mL,100 μL / 孔。37℃ 、80 mL / L CO2培养 1 d 后,换成含 HAT 筛选培养基培养。7 ~ 14 d后改用含 HT 筛选培养基培养,14 d 后换用普通培养基培养。
1. 2. 4 杂交瘤细胞筛选与克隆 根据 Kim 等建立的间接ELISA 筛选分泌抗 MT mAb 的杂交瘤细胞株。选取 96 孔酶标板,每孔用碳酸盐缓冲液( 0.5 mol/L Na2CO3/ NaHCO3,pH9.6) 包被重组 His-MT( 10 μg/mL,100 μL/孔) ,以 1∶1 000 的免疫小鼠血清为阳性对照,1∶1 000 的未免疫正常 BALB/c 小鼠为阴性对照,1∶5 000 稀释的山羊抗小鼠 IgG-HRP 为二抗; 以邻苯二胺( OPD) 溶液为反应底物,492 nm 处酶标仪测定各孔 A 值,以 P/N≥2. 1 时判定为阳性。同时用含 His-tag 的重组 IGF 蛋白包被做交叉筛选。采用有限稀释法对连续 3 次检测为阳性的细胞株进行亚克隆,即调整细胞数 至 每 毫 升 10 个,100 μL / 孔铺 96 孔细胞培养板,亚克隆培养 10 d 后检测上清。重复进行 3 次亚克隆,至 100% 杂交瘤细胞上清液均呈阳性时为建株标准。
1. 2. 5 抗 MT mAb 亚类鉴定 处于对数生长期、生长旺盛的杂交瘤细胞,更换培养于未添加胎牛血清的 DMEM/F12 培养基,继续培养 2 ~3 d 后收集细胞培养上清,按照抗体亚类鉴定试剂盒操作说明进行亚类鉴定。
1. 2. 6 mAb 腹水制备及纯化 以液体石蜡作为致敏剂,选取 22 周龄经产 BALB/c 小鼠,以 0. 5 mL/只注射液体石蜡。
将筛选获得的杂交瘤细胞株扩大培养后,以 1 × 105/ mL ~1 × 107/ mL 的细胞数接种杂交瘤细胞株至小鼠腹腔内生产腹水。10 ~12 d 后收集腹水,3 000 r/min 离心 15 min,收获上清。间接 ELISA 测定腹水效价。收获的腹水上清,采用疏水性电荷诱导层析 ( hydrophobic charge induction chromatography,HCIC) 和蛋白 A 亲和层析相结合的方法纯化腹水,操作步骤依据文献[11]方法进行。纯化的样品经 120 g/L SDS-PAGE分析其纯度。
1. 2. 7 Western blot 法和 Dot-ELISA 鉴定 重组 SUMO-MT 和重组 His-MT 行 150 g/L SDS-PAGE 后,电转印至 PVDF 膜上;用含 50 g/L 脱脂奶粉的 PBST 封闭过夜,PBST 洗膜 4 次,10 min / 次,加入 1 ∶ 2 000 稀释的 mAb 作为一抗,4℃ 过夜;PBST 洗膜 4 次后,加入 1∶5 000 稀释的 AP 标记的山羊抗小鼠IgG,室温反应 2 h; 用 PBST 洗膜 4 次后,最后用 BCIP / NBT显色试剂盒避光显色并拍照。按照本实验建立的方法制备河南华溪蟹肝胰腺组织 MT 粗提液.分别取经 IPTG 和低磷酸盐诱导的 PET-28a-SUMO-MT/BL21( DE3) 、phoA-MT/BL21( DE3) 裂解液上清、重组 SUMO-MT、重组 His-MT、重组His-IGF及河南华溪蟹肝胰腺组织 MT 粗提液各 5 ~ 10 μL 点1封闭液振荡封闭 30 min.PBST 洗涤后,加入所获的 mAb,37℃ 振荡孵育 30 min; PBST 充分洗涤后,加入 HRP 标记的山羊抗小鼠 IgG( 1∶5 000 稀释) ,37℃振荡孵育 30 min; 充分洗涤、滤纸吸干后,DAB 显色分析。
1. 2. 8 mAb 抗原识别位点分析 按照文献方法,利用ELISA 叠加试验对 2 株 mAb 的抗原识别位点进行分析检测。利用间接 ELISA 测定 mAb-MT2 和 mAb-MT3 2 株 mAb 饱和值。按照上述建立的 ELISA,一抗分别为饱和浓度 mAb-MT2、饱和浓度 mAb-MT3、饱和浓度 mAb-MT2 联合饱和浓度 mAb-MT3、饱和浓度mAb-MT3 联合饱和浓度 mAb-MT2,测定 A492nm值,计算增殖指数( AI) .按如下公式计算: AI = ( A1 + 2- A1) /A2×100% .式 中: A1为 mAb-MT2 A492值; A2为 mAb-MT3 的A492值; A1 + 2为 mAb-MT2 叠加 mAb-MT3 的 A492值。AI <10%为针对同一抗原位点,AI≥10%为针对不同抗原位点。
2 结果
2. 1 SUMO-MT 和 His-MT 重组蛋白的表达和纯化重 组 工 程 菌 PET-28a-SUMO-MT/BL21 ( DE3 ) 、phoA-MT / BL21( DE3) 分别经 1 mmol / L IPTG 和低磷酸盐诱导后,重组可溶表达重组蛋白 SUMO-MT 和His-MT,利用 Ni 离子螯合柱分离纯化目的蛋白。
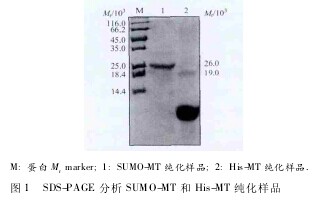
SDS-PAGE 结果显示 SUMO-MT 和 His-MT 相对分子质量( Mr) 分别为 26 000 ( SUMO 标签 Mr19 000,MT Mr7 000) 和 7 000 左 右, 且 蛋 白 纯 度 较 高( 图 1) .【图1】
2. 2 抗 MT mAb 杂交瘤细胞株的筛选 选择免疫后血清抗体效价较高的小鼠进行细胞融合。将状态良好的 Sp2/0 骨髓瘤细胞与小鼠脾细胞融合,融合率达 99%.融合后 10 d 左右,待细胞长至孔底的1 /2以上时,取细胞上清采用间接 ELISA 进行交叉筛选。仅选择与 His-MT 蛋白反应为阳性,而与含His-tag的 IGF 蛋白反应为阴性的克隆,判定为阳性克隆。经初筛、复测,3 次亚克隆培养后,最终筛选获得2 株能稳定分泌抗华溪蟹 MT 抗体的杂交瘤细胞株,分别命名为 mAb-MT2 和 mAb-MT3,冻存、保种。
2. 3 IgG 亚类鉴定 按照试剂盒说明操作,2 株杂交瘤细胞株的 DMEM/F12 培养基无血清培养上清经夹心 ELISA 亚类鉴定为 IgG1 亚型。
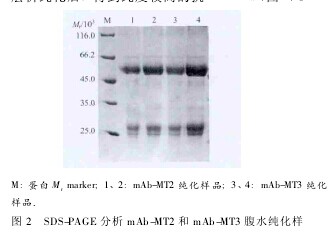
2. 4 腹水制备及效价测定 将杂交瘤细胞接种于经产 BALB/c 小鼠腹腔,12 d 左右收集腹水。间接ELISA 测定 mAb-MT2 和 mAb-MT3 腹水效价分别为1∶500 000、1∶1000 000.腹水经 HCIC 和蛋白 A 亲和层析纯化后,得到纯度较高的抗 MT mAb( 图 2) .【图2】
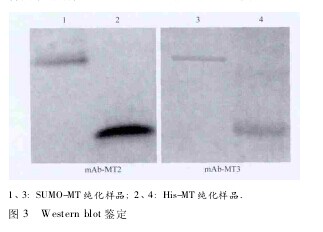
2. 5 Western blot 鉴 定 以纯化的 mAb 为一抗,AP 标记的山羊抗小鼠 IgG 为二抗进行 Western blot分析鉴定。结果显示,2 株杂交瘤分泌的 mAb 均能特异性识别重组 SUMO-MT 和 His-MT( 图 3) .【图3】
2. 6 Dot-ELISA 检 测抗 MT mAb 的 特 异 性Dot-ELISA分析结果表明,2 株 mAb 均能与重组菌PET-28a-SUMO-MT/ BL21( DE3) 、phoA-MT/ BL21( DE3) 、重组 SUMO-MT、重组 His-MT 及肝胰腺组织 MT 粗提液反应,具有良好的反应特异性,而与重组 His-IGF、PET-28a-SUMO / BL21( DE3) 没有特异反应性( 表 1) .【表1】

2. 7 mAb 识别的抗原位点分析 利用 ELISA 叠加法分析了 2 株 mAb 的抗原识别位点,结果显示:mAb-MT2 和 mAb-MT3 叠加后,增殖指数 ( AI ) 为6% ,小于 10% ,说明 mAb-MT2 和 mAb-MT 可能识别同一表位( 表 2) .【表2】

3 讨论
MT 由于分子质量较小,半衰期短,在大肠杆菌体内不稳定且易被酶降解; 富含半胱氨酸,极易形成无生物活性的包涵体和影响宿主体内的氧化还原环境; 易结合金属离子影响宿主细胞的正常生理代谢、对细胞的毒性以及细胞对金属离子的耐受性差等问题,成为一种较难获得重组表达的蛋白.在前期研究中,将河南华溪蟹 MT 基因亚克隆至 PET-28a、PQE30 等一系列常规表达载体上,发现其无法正常表达,这也进一步验证了 MT 由于其独特的性质而较难获得重组表达的推理。为解决这一问题,研究者多利用融合技术将 MT 基因与具有协助蛋白正确折叠的融合蛋白如谷胱甘肽 S 转移酶 ( glutathioneS-transferase,GST) 融合表达.在前期工作中,利用 GST 表达系统也成功实现了河南华溪蟹的表达,但目的蛋白多以包涵体的形式存在,可溶表达量有限。本研究利用两种特殊的表达系统: SUMO 融合表达系统和 phoA 分泌表达系统,实现了河南华溪蟹MT 的重组可溶表达。在 SUMO 系统中,MT 通过融合 SUMO tag,利用其促溶、促折叠等特性实现了体外重组可溶表达。而在 phoA 表达系统中,河南华溪蟹 MT 蛋白被分泌表达至细胞周质中,降低了 MT 的细胞毒性,同时细胞周质中氧化还原环境较弱,能够最大程度的保证 MT 的天然构象,克服了仅带有6 × His小分子量标签 MT 的表达困难,实现了其可溶分泌表达。MT 的 Mr较低、免疫原性较差.
SUMO-MT 的成功制备,在最大程度保持 MT 天然构象的基础上,大大提高了 MT 的免疫原性。同时利用仅带有较弱免疫原性的6 × His tag 完成了 MT 的重组表达,以 His-MT 作为检测抗原筛选 mAb,大大提高了抗体筛选的特异性和准确性。在杂交瘤筛选过程中,以 His-MT 作为检测抗原避免 SUMO tag 假阳性的影响,同时利用 His-IGF 进行交叉筛选也规避了针对 6 × His tag 假阳性,获得仅针对 MT 的阳性杂交瘤细胞株。同时,重组 SUMO-MT 和 His-MT 均以可溶形式表达,最大程度的保持了 MT 的天然构象,为我们同时筛选针对线性抗原表位和构象表位的 mAb 提供了可能。
本研究通过 2 种不同表达形式实现了河南华溪蟹 MT 蛋白的重组表达,进一步利用 SUMO-MT 良好的免疫原性和 His-MT 较强的特异性,利用杂交瘤技术制备了 mAb.实验结果表明,制备的 mAb 不仅可以特异性识别重组 SUMO-MT 和 His-MT,而且与内源性组织 MT 也具有良好的反应性。抗 MT mAb 的制备,对建立敏感、准确、标准化的免疫学检测方法及深入研究 MT 的重金属解毒机制具有重要意义。
参考文献:
[1] Hamer DH. Metallothionein[J]. Ann Rev Biochem,1986,55:913 - 951.
[2]Kgi JH,Schffer A. Biochemistry of metallothionein[J]. Biochemistry,1988,27( 23) : 8509 - 8515.
[3] Carpenè E,Andreani G,Isani G. Metallothionein functions andstructural characteristics [J]. J Trace Elem Med Biol, 2007,21( Suppl 1) : 35 - 39.
[4]Hassinen VH,Tuomainen M,Perniemi S,et al. Metallothioneins 2and 3 contribute to the metal-adapted phenotype but are not directlylinked to Zn accumulation in the metal hyperaccumulator,Thlaspicaerulescens[J]. J Exp Bot,2009,60( 1) : 187 - 196.
[5]Amiard JC,Amiard-Triquet C,Barka S,et al. Metallothioneins inaquatic invertebrates: their role in metal detoxification and their useas biomarkers[J]. Aquat Toxicol,2006,76( 2) : 160 - 202.
[6]Saito H,Nakazato K,Kato M,et al. Determination of metallothionein-3by a competitive enzyme-linked immunosorbent assay in experimentalanimals[J]. J Toxicol Sci,2013,38( 1) : 83 - 91.
- 相关内容推荐





