摘 要: 目的 探讨肌动蛋白连接蛋白1(actin-binding protein 1,Abp1)对调节性T细胞(Treg)发育及功能的影响。方法 通过流式细胞术检测野生型小鼠(WT组)和Abp1基因敲除小鼠(KO组)的胸腺、脾脏、浅表淋巴结及肠系膜淋巴结中T淋巴细胞及Treg细胞的比例、数量以及相关功能性分子的表达,并利用体外抑制试验检测Abp1缺失对Treg抑制功能的影响。结果 与WT小鼠相比,Abp1 KO小鼠的胸腺、脾脏、浅表淋巴结及肠系膜淋巴结中的Treg的比例和细胞数目均没有明显的变化,同时缺失Abp1的Treg细胞的主要功能性分子ICOS、CTLA4、PD-1和NRP-1的表达亦没有显着的差异,进一步实验发现缺失Abp1的Treg细胞对初始T细胞向活化T细胞分化的抑制作用较WT相比无明显变化。结论 Abp1对Treg细胞的发育和功能没有显着影响。
关键词: 肌动蛋白连接蛋白1; 调节性T细胞; 抑制功能;
Abstract: This study was designed to investigate the effect of progranulin actin-binding protein 1(Abp1) on the differentiation and function of regulatory T cell,and the molecule mechanism.We detected the proportion,number and functional molecule expression of T lymphocytes and Treg cells in the thymus,spleen,peripheral lymph nodes and mesenteric lymph nodes of wild-type mice(WT group) and Abp1 knockout mice(KO group) by cytometry flow,and the effect of Abp1 deletion on the inhibitory function of Treg in vitro was measured as well.Compared with WT mice,Abp1 KO mice had no significant differences on the proportion and number of Tregs in the thymus,spleen,peripheral lymph nodes and mesenteric lymph nodes,meanwhile,the expression of the main functional molecules ICOS,CTLA4,PD-1 and NRP-1 in Treg cells lacking Abp1 were not significantly different.Furthermore,Abp1-absent Treg cells showed no significant changes in inhibiting T cells activation as comparing with WT Treg cells.In conclusion,Abp1 has no significant effect on the development and function of Treg cells.
Keyword: Actin-binding protein 1; Regulatory T cell; Suppressive function;
肌动蛋白结合蛋白1(actin-binding protein 1,Abp1)也称为HIP-55或SH3P7,是一种由436个氨基酸组成,相对分子质量为48 600的肌动蛋白效应蛋白。Abp1主要包含4个结构域,包括N端肌动蛋白解聚因子同源区(ADF-H)、带电荷的α-螺旋形结构域(charged helix)、富含脯氨酸的结构域(PRD)和C末端Src同源性3(SH3)结构域[1],Abp1可通过ADF-H和charged helix可直接结合F-actin,在各种组织中广泛表达[2,3,4]。

早期的研究发现Abp1参与酵母细胞的增殖和生存[5],在成纤维细胞中,研究发现Abp1可通过其SH3区域与GTP酶dynamin直接结合进而参与细胞的内吞[6]。在大脑皮层发育过程中Abp1可通过调控N-钙黏附素的表达从而影响神经元细胞的迁移、多极形态和细胞极性[7],并且在神经元突触的形成和形态控制过程中也同样发挥重要作用[8]。在癌细胞中增强Abp1的表达可以促进肺癌细胞的增殖、集落形成、迁移和侵袭,而抑制Abp1的表达则可逆转这些作用[9,10]。但另有文献报道,Abp1与FHL2(four and a half LIM domain protein2)的相互作用可抑制乳腺癌细胞的侵袭[11]。
同时,Abp1在淋巴细胞中也发挥重要作用。B细胞激活后BCR信号可诱导Abp1的磷酸化并促进Abp1和与其结合的dynamin2向胞膜聚集,使其定位于细胞膜上的BCR与F-actin、dynamin2与细胞骨架的相互作用进一步促进了B细胞的抗原处理和递呈[12]。缺失Abp1后不仅引起BCR介导的B细胞抗原递呈功能受损,而且因Abp1缺失所致的肌动蛋白重塑异常致使与B细胞早期活化密切相关的BCR小体聚集及B细胞收缩亦受到显着影响,导致缺失Abp1小鼠的边缘区B细胞、生发中心B细胞的数量以及自身免疫抗体的水平显着增加[13]。在T细胞中Abp1是TCR信号传导的重要调节分子,通过将肌动蛋白、细胞骨架和内吞作用[13]联系起来共同调节T细胞的激活[14,15]。调节性T细胞(regulatory T cell,Treg)是一群具有免疫抑制功能的CD4+T细胞亚群,而Abp1对Treg功能的影响机制目前尚不清楚。
Treg是调节免疫系统维持自身抗原耐受性和预防自身免疫性疾病的T细胞亚群。根据来源不同,Treg细胞可分为由胸腺分化的自然性Treg(natural Treg,n Treg)和主要存在于肿瘤组织和外周血中的诱导性Treg(induced Treg,i Treg),早期称为抑制性T细胞[16]。Treg能够抑制T细胞增殖和细胞因子产生,并且在预防自身免疫中起关键作用[17]。然而目前尚未建立起Abp1敲除小鼠模型来研究其对Treg发育及功能的影响。
本研究旨在探讨Abp1对Treg的发育及功能的影响机制。因此,使用Abp1敲除小鼠来进行实验分析在Abp1缺失的情况下对Treg的发育和功能所产生的影响。
1、 材料与方法
1.1、 实验小鼠
本实验所用Abp1 KO小鼠为Balb/c背景,饲养在IVC环境中。所有的小鼠实验均遵循重庆医科大学动物管理委员会和重庆医科大学儿童医院伦理委员会的规定。
1.2 、试剂和仪器
HBSS、1640培养基均购于Hyclone公司;胎牛血清购于Gibco公司;流式抗体以及染色剂分别购于BD、Biolegend、e Bioscience公司,分别为FITC-Annexin V、PE-ICOS(TE.17G9)、Percp/CY5.5-CD44(IM7)、Percp-7AAD(BBllife science)、APC-CD25(PC61)、APC/CY7-TCRβ(H57-597)、PE/CY7-CD62L(MEL-14)、PB-CD4(RM45)、BV510-CD8a(53-6.7)、FITC-FOXP3(FJ-16s)、PE-CTLA4(UC10-4B9)、PE/CY7-PD-1(RMP1-30)、PE-CD103(2E7)、APC-neuropilin(3E12)、PE-CY7-KI67、PE-CD4(GK1.5)、APC-IL-4(11B11)、BV421-IL-17(TC11-18H10.1)、PE/CY7-IFNγ(XMG1.2);普通流式固定打孔剂购于美国BD公司;Foxp3固定打孔剂购于e Bioscience公司;PMA、离子霉素均购于美国Sigma公司;高尔基体阻断剂购于BD Bioscience公司;小鼠淋巴细胞分离液Ficoll购于GE Healthcare公司。生物安全柜(Forma)、高压灭菌锅(Tomy ES-315)、超纯水系统(Millipore)、流式细胞仪(BD)、台式冷冻离心机(Thermo Scientific)、室温台式离心机(Hettich Mikro)、细胞计数仪(Count star)。
1.3 、单个核细胞的制备
用CO2麻醉小鼠后将其断颈处死,分别取出小鼠脾脏、胸腺、浅表淋巴结和肠系膜淋巴结,在无菌条件下研磨,脾脏细胞悬液用3 ml的Ficoll进行密度梯度离心,吸取单个核细胞层计数。
1.4 、流式细胞术检测细胞表面分子
提取脾脏、胸腺、浅表淋巴结和肠系膜淋巴结单个核细胞分别取1×106个单个核细胞于96孔细胞培养板中,将抗体用不同浓度混于含有2%FBS的PBS缓冲液中。用50?l/孔配制的抗体稀释液垂悬单个核细胞,冰上避光孵育30 min后用PBS缓冲液洗涤细胞2次,用200?l PBS缓冲液将细胞重悬后转移至流式管中,上机。使用Flow JoTMV10软件分析数据。
1.5 、流式细胞术检测细胞内分子
提取脾脏、胸腺、浅表淋巴结和肠系膜淋巴结单个核细胞,分别取2×106个细胞于96孔细胞培养板中,用200?l细胞固定剂固定30 min,打孔剂洗涤1次后用打孔剂打孔5 min。将抗体用不同稀释比例混于打孔剂。用50?l/孔配制的抗体稀释液垂悬单个核细胞,冰上避光孵育30 min后用PBS缓冲液洗涤细胞2次,用200?l PBS缓冲液将细胞重悬转移至流式管中,上机。使用Flow JoTMV10软件分析数据。
1.6 、体外检测Treg细胞抑制功能
提取WT及Abp1 KO小鼠脾脏单个核细胞,在无菌条件下使用鼠CD4/CD25阳性T细胞分选试剂盒(Miltenyibiotec,5190702555)分选出Treg细胞,使用小鼠初始CD4+T细胞分选试剂盒(Miltenyibiotec,5191209633)分选出初始T细胞。将使用Cell tracer(Technologies,1702579)标记后的初始T细胞后与不同浓度的Treg细胞共培养于96孔板中,用1640+10%FBS培养基补足200?l,每孔加入1?l CD3/CD28-Beads(Gibco,11456D)刺激,在37℃的5%CO2培养箱共培养72 h。72 h后收集细胞用流式细胞术检测初始T细胞的增殖情况。使用Flow JoTMV10软件分析数据。
1.7 、T细胞刺激后检测胞内细胞因子
配制刺激剂:1640培养基中加入胎牛血清(100?l/ml)、离子霉素(1?mol/L)、Golgi STOP(1∶1 000)、PMA(50 ng/ml)。提取脾脏、胸腺、浅表淋巴结和肠系膜淋巴结单个核细胞,分别取2×106个细胞于24孔板中,每孔加入1 ml配制好的刺激剂垂悬后置于37℃的5%CO2培养箱中培养5 h。5 h后收集细胞,将PB-CD4、BV510-CD8a、APC/CY7-TCRβ、Percp/CY5.5-CD444种抗体以不同稀释比例混于2%FBS的PBS缓冲液中,然后取50?l/孔的抗体稀释液重悬细胞进行染色。冰上避光孵育30 min后用PBS缓冲液洗涤细胞1次。然后,用200?l细胞固定剂固定30 min,打孔剂洗涤1次后用打孔剂打孔5 min。将APC-IL-4、PE/CY7-IFN-γ、BV421-IL-17 3种抗体用不同稀释比例混于打孔剂中,并取50?l/孔配制的抗体稀释液垂悬单个核细胞,冰上避光孵育30 min后用PBS缓冲液洗涤细胞2次,用200?l PBS缓冲液将细胞转移至流式管中,上机。使用Flow JoTMV10软件分析数据。
1.8、 统计学分析
实验数据均用Graph Pad Prism 5统计软件分析,组间差别采用两独立样本t检验,以P<0.05认为差异有统计学意义。
2 、结果
2.1、 Abp1敲除后对CD4+T细胞和CD8+T细胞数量的影响
为了研究Abp1敲除后对CD4+T细胞和CD8+T细胞数量的影响,我们使用流式细胞术对来自胸腺、脾脏、浅表淋巴结和肠系膜淋巴结的单个核细胞进行检测。我们发现Abp1 KO鼠与野生型小鼠(WT)相比,CD4+和CD8+T细胞在脾脏、胸腺、浅表淋巴结和肠系膜淋巴结中细胞比例和数量差异均不明显(图1),这与文献报道的Abp1缺失后对胸腺和脾脏中T细胞的影响结果一致[15]。由此我们可以推测,Abp1敲除后对T淋巴细胞中CD4+和CD8+的细胞比例和数量没有显着影响。
2.2、 Abp1敲除后对CD4+T淋巴细胞活化的影响
为了研究Abp1敲除后对CD4+T细胞中细胞活化的影响,我们使用多种抗体对来自脾脏、胸腺、浅表淋巴结和肠系膜淋巴结单个核细胞进行染色来区分CD4+T细胞的不同细胞亚群,并使用流式细胞术检测。我们发现Abp1 KO鼠与WT鼠相比,初始CD4+T细胞(CD44-CD62L+)与活化的CD4+T细胞(CD44+CD62L-)的比例和数量在脾脏、胸腺、浅表淋巴结和肠系膜淋巴结中均没有明显的差异(图2)。由此我们认为,Abp1敲除后对T淋巴细胞中CD4+细胞的活化影响不大。
2.3 、Abp1敲除后对CD8+T淋巴细胞活化的影响
为了进一步研究Abp1敲除后对CD8+T细胞中细胞活化的影响,我们使用多种抗体对来自脾脏、胸腺、浅表淋巴结和肠系膜淋巴结单个核细胞进行染色来区分CD8+T细胞的不同细胞亚群,并使用流式细胞术检测。我们发现Abp1 KO鼠与WT鼠相比,幼稚的CD8+T细胞(CD44-CD62L+)与活化的CD8+T细胞(CD44+CD62L-)在脾脏、胸腺、浅表淋巴结和肠系膜淋巴结中均无明显的差异(图3)。因此可以推测,Abp1敲除后对T淋巴细胞中CD8+细胞的活化影响同样较小。
2.4 、Abp1敲除后对Treg的影响
为了研究Abp1敲除后对Treg的影响,我们使用多种抗体对来自脾脏、胸腺、浅表淋巴结和肠系膜淋巴结单个核细胞进行染色,并用流式细胞术来检查Treg的变化。分别使用CD4+CD25+和CD4+FOXP3+抗体来标记Treg。我们发现在脾脏、胸腺、浅表淋巴结和肠系膜淋巴结中,无论是使用CD4+CD25+或使用CD4+FOXP3+标记的Abp1 KO小鼠的Treg比例及细胞数与WT鼠相比变化均不大(图4、图5)。由此可以推测出Abp1的缺失对小鼠T细胞外周稳态影响不大。
图1 小鼠缺失Abp1对CD4+T细胞和CD8+T细胞数量的的影响
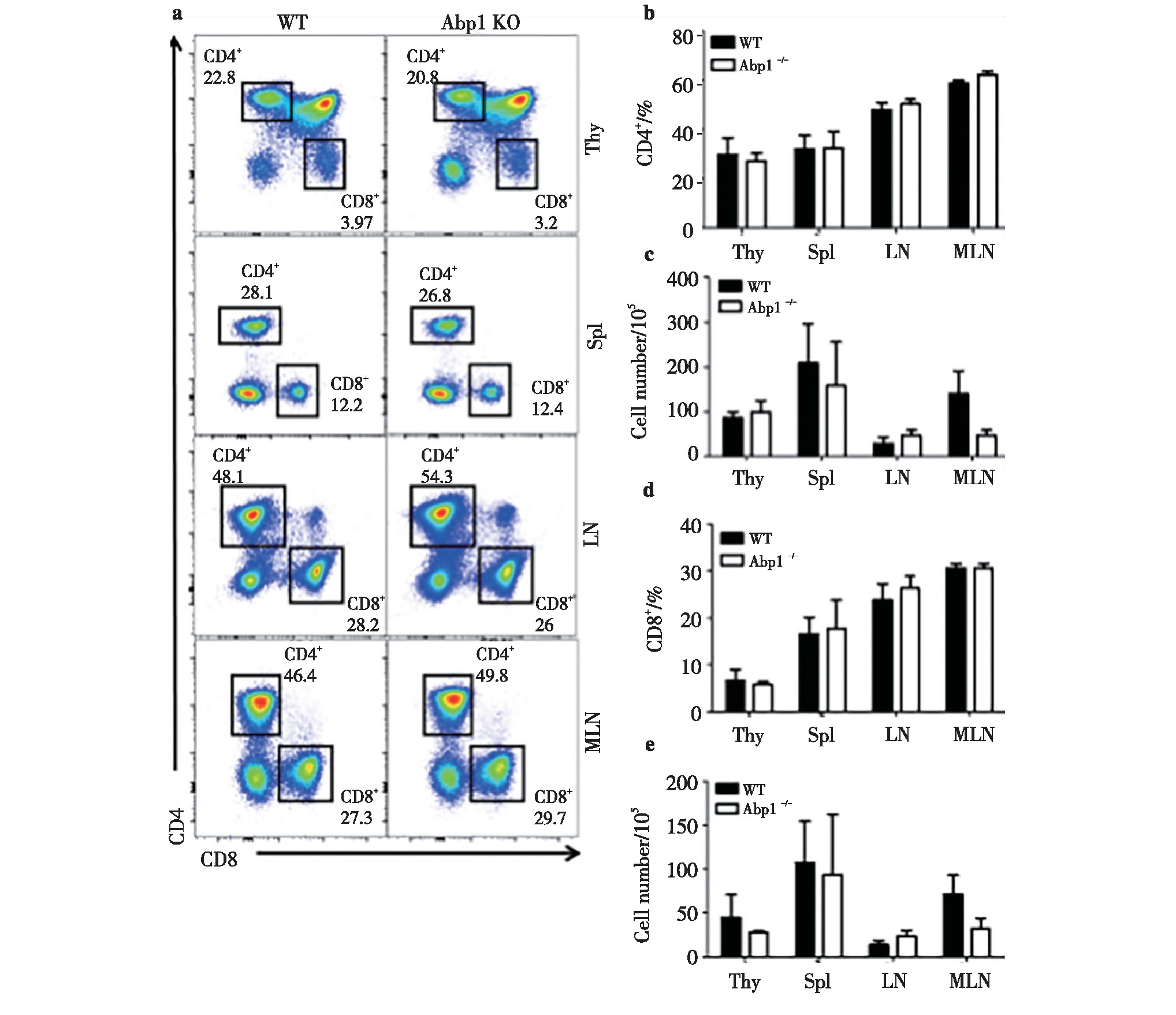
Fig 1 The effect of Abp1 deletion on the number of CD4+T cells and CD8+T cells in mice
a)Flow cytometry analysis of CD4+and CD8+T cells in thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes from wild type and Abp1 KO mice;b)the percentage of CD4+cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);c)the number of CD4+cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);d)the proportion of CD8+cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);e)the number of CD8+cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4). 1 Abp1CD4+TCD8+T
2.5、 Abp1缺失对Treg功能的影响
为了进一步确认Abp1缺失对小鼠Treg功能分子的影响,我们使用流式细胞术分别检测了Treg细胞中诱导共刺激分子(inducible costimulatory,ICOS)、细胞毒性T淋巴细胞相关抗原(cytotoxic T lymphocyte associated antigen4,CTLA4)、程序性死亡分子1(programmed death-1,PD-1)和神经纤维毛蛋白-1(neuropilin-1,NRP-1)的表达。其中,ICOS能够稳定表达在CD4+CD25+Treg细胞表面促进T细胞的增殖和分化,CTLA4是表达于活化的CD4+和CD8+T细胞的表面分子,能够下调或终止T细胞活化,PD-1表达于活化的T细胞并抑制T细胞的增殖和细胞因子的产生,NRP-1具有负向免疫调节作用。检测结果发现,ICOS、CTLA4、PD-1、NRP-1这4种功能分子在Abp1 KO小鼠的脾脏、胸腺、浅表淋巴结和肠系膜淋巴结中的表达均没有差异(图6a~6d)。为了进一步了解Abp1的缺失对Treg的抑制功能是否产生影响,我们将分选出的WT小鼠的初始T细胞同Abp1缺陷小鼠的Treg或野生型小鼠的Treg共培养,并加入CD3/CD28刺激初始T细胞增殖,共培养3 d后检测初始T细胞的增殖情况。结果显示WT小鼠组和KO小鼠组的初始T细胞增殖没有明显差异(图6e)。这些结果表明Abp1对Treg的功能没有明显的影响。
图2 小鼠缺失Abp1对CD4+T淋巴细胞的活化的影响
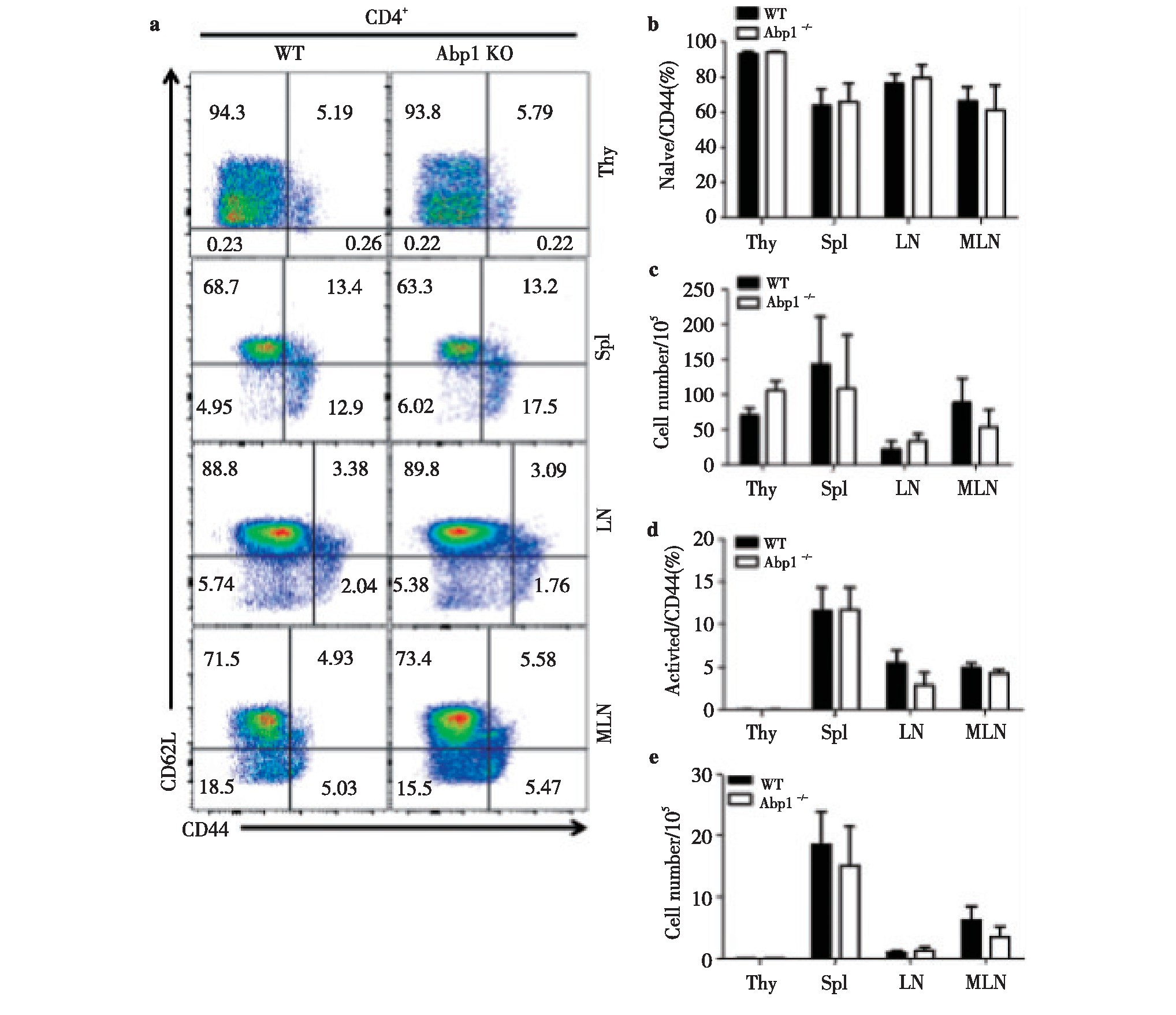
Fig 2 The effect of Abp1 deletion on the activation of CD4+T lymphocyte in mice
a)Flow cytometry analysis of naive CD4+T cells and activated CD4+T cells in thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes from wild type and Abp1 KO mice;b)the proportion of naive CD4+T cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);c)the number of naive CD4+T cells in thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);d)the proportion of activated CD4+T cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);e)the number of activated CD4+T cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4).
2.6 、缺失Abp1的Treg对活化的CD4+T以及CD8+T细胞产生的细胞因子能力的影响
为了进一步了解缺失Abp1的Treg的对活化的CD4+T以及CD8+T细胞产生的细胞因子的能力的影响。我们使用PMA和离子霉素对Abp1 KO小鼠和WT小鼠的脾脏、胸腺、浅表淋巴结和肠系膜淋巴结的单个核细胞进行刺激,并使用流式细胞术检测刺激后的细胞产生的细胞因子。我们分别检测了CD4+T细胞产生的γ-干扰素(IFN-γ)、白介素4(IL-4)和白介素17(IL-7)以及CD8+T细胞中的IFN-γ。IFN-γ参与介导细胞免疫应答,诱导T细胞活化,促进Ig G的生产;IL-4促进CD4+T细胞的分化,主要介导体液免疫;IL-17参与固有免疫和炎症的发生。结果显示,KO小鼠的脾脏、胸腺、浅表淋巴结和肠系膜淋巴结CD4+T细胞产生IFN-γ、IL-4和IL-17以及CD8+T细胞产生IFN-γ与WT鼠相比均没有差异。(图7)由此可知,缺失Abp1的Treg对活化的CD4+T以及CD8+T细胞产生细胞因子的能力没有显着影响。
图3 小鼠缺失Abp1对CD8+T淋巴细胞的活化的影响
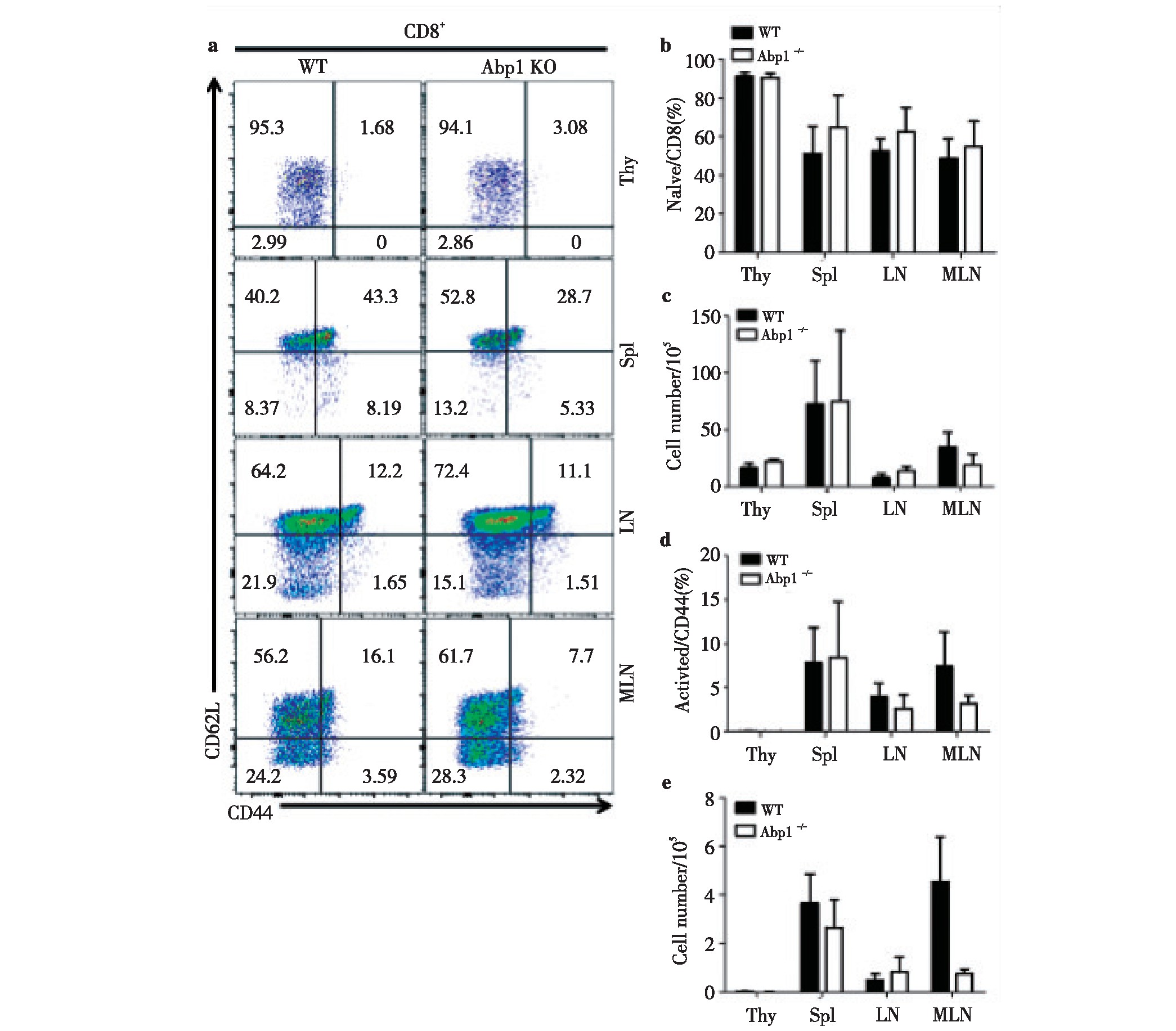
Fig 3 The effect of Abp1 deletion on the activation of CD8+T lymphocyte in Abp1 KO mice
a)Flow cytometry analysis of naive CD8+T and activated CD8+T cells in thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes from WT and Abp1 KO mice;b)the proportion of naive CD8+T cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);c)the number of naive CD8+T cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);d)the proportion of activated CD8+T cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);e)the number of activated CD8+T cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4).
3、 讨论
Abp1是一种能够直接结合F-actin的肌动蛋白效应蛋白,广泛分布于各类细胞中。由于与肌动蛋白密切相关,Abp1不仅参与调控细胞的内吞作用[6],同时参与调节多种细胞的伸展和迁移。有研究发现Abp1的缺失不仅影响小鼠白细胞的黏附,同时抑制白细胞向内皮细胞的扩散,进一步研究发现,在b2整合素的刺激下Abp1主要聚集在极化的中性粒细胞前缘,同时增加了与肌动蛋白的结合从而促进中性粒细胞的迁移[18]。同时,Abp1对神经元细胞和乳腺癌细胞的迁移均有调控作用[7,11]。虽然有报道Abp1的缺失会导致小鼠出现明显的体质量下降和较高的死亡率[15],但是我们的Abp1小鼠模型在饲养过程中并没有发现类似的现象。
图4 Abp1的缺失对CD4+CD25+Treg细胞的影响
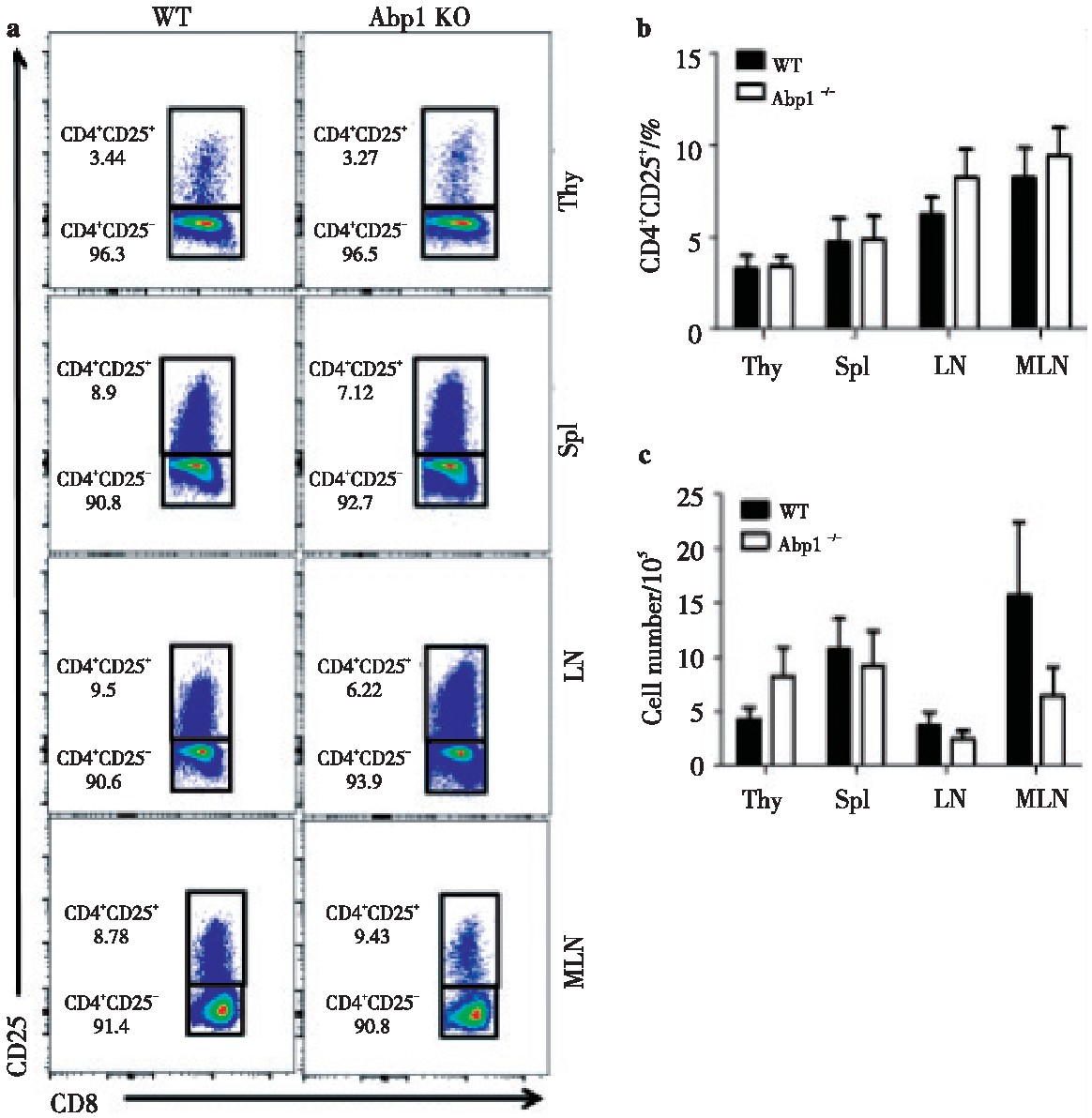
Fig 4 The effect of Abp1 deletion on CD4+CD25+Treg cells
a)CD25 expression in thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes CD4+T cells from WT and Abp1 KO mice;b)theproportion of CD4+CD25+Tregs in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);c)the number of CD4+CD25+Tregcells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4).
图5 Abp1的缺失对CD4+Foxp3+Treg细胞的影响
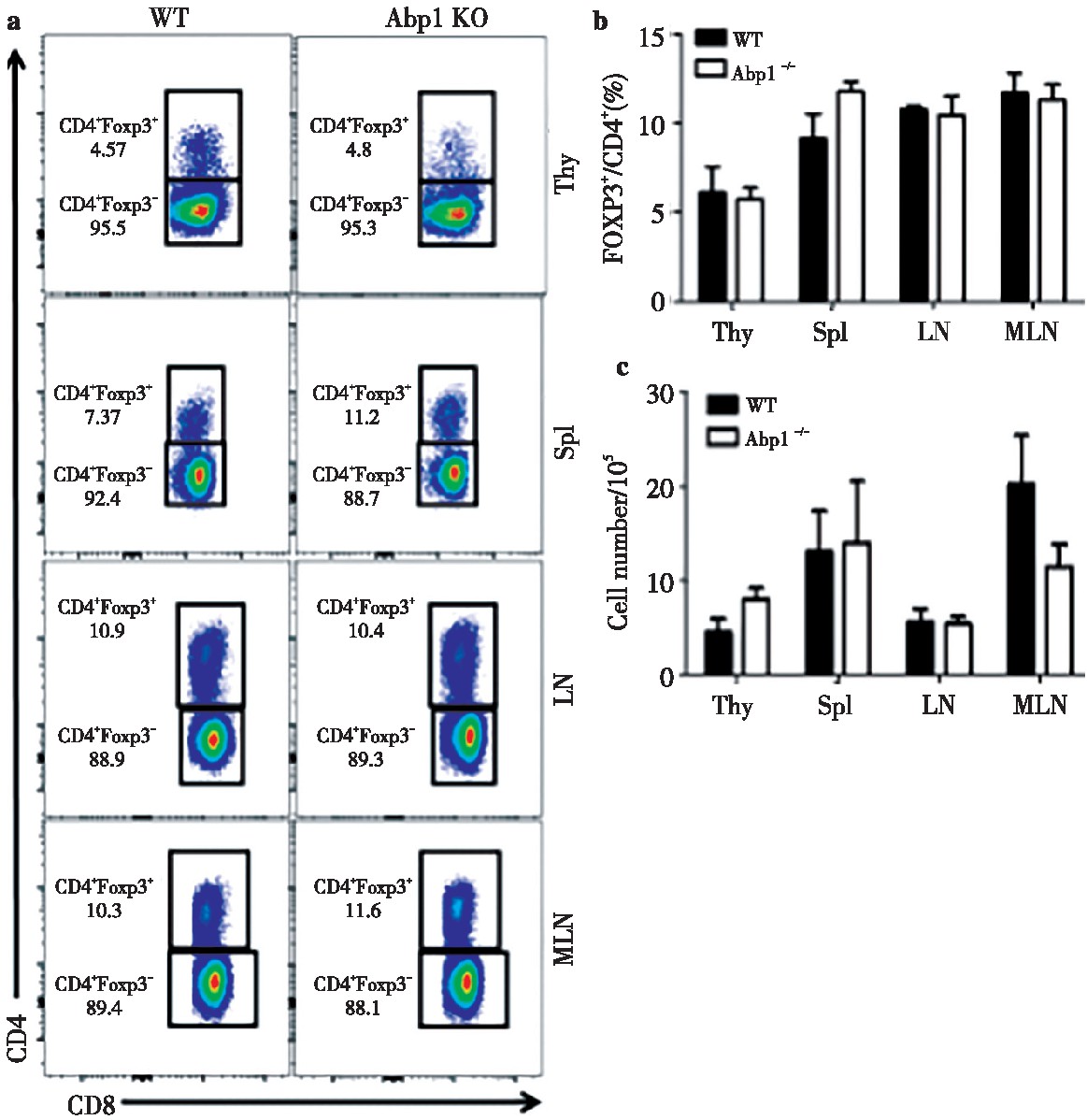
Fig 5 The effect of Abp1 deletion on CD4+Foxp3+Treg cells
a)Foxp3 expression in thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes CD4+T cells of WT and Abp1 KO mice;b)theproportion of CD4+Foxp3+Tregs in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);c)the number of CD4+Foxp3+Tregcells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4).
图6 Abp1缺失对Treg功能的影响
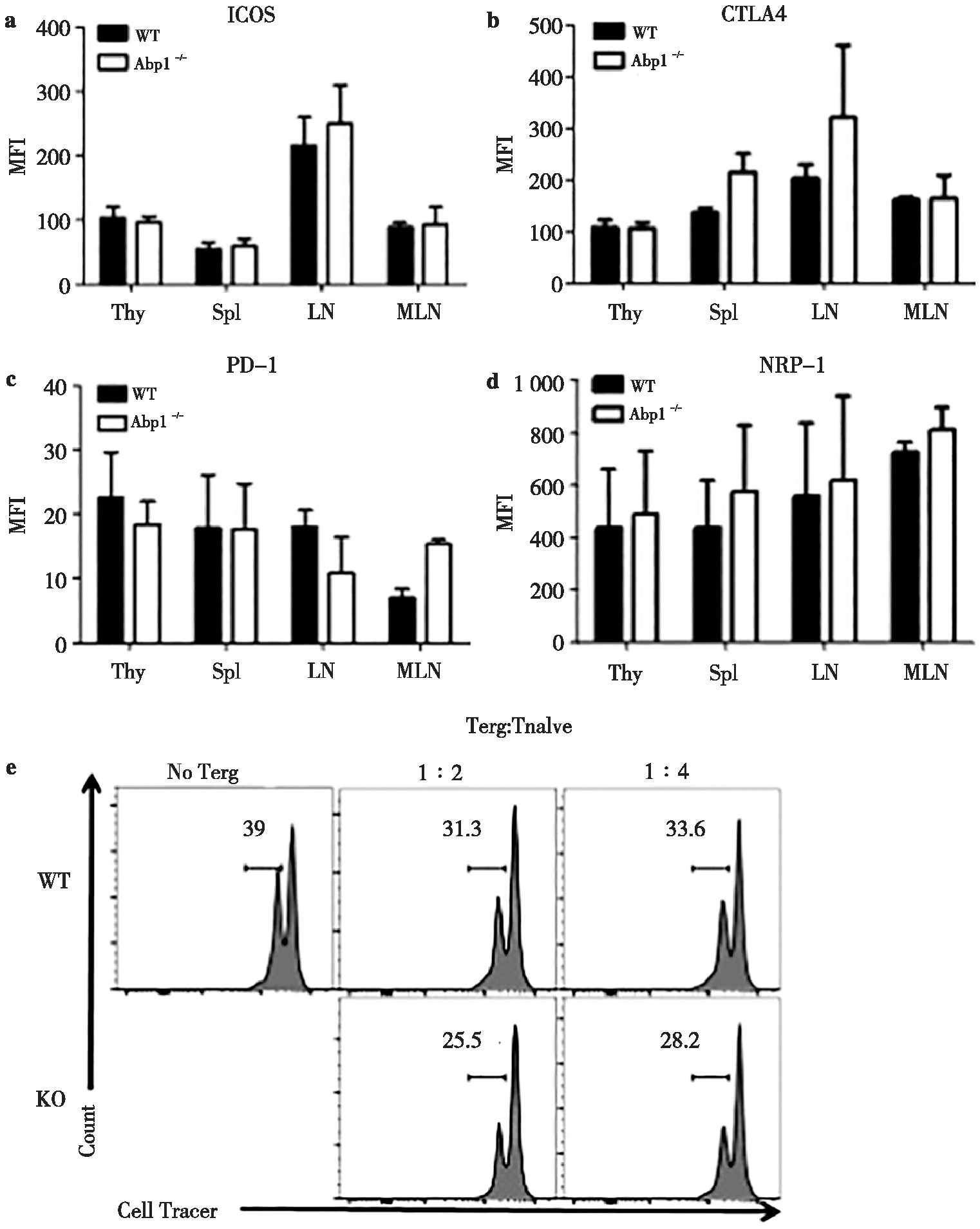
Fig 6 The effect of Abp1 deletion on the function of Treg
a) wild type and Abp1 KO mice (n=4);b)the mean fluorescence intensity of CTLA4 in CD4+Foxp3+Treg cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);c)the mean fluorescence intensity of PD-1 in CD4+Foxp3+Treg cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);d)the mean fluorescence intensity of NRP-1 in CD4+Foxp3+Treg cells in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes (n=4);e)naive T and Treg cells in spleen from WT and Abp1 KO mice were sorted separately, and the proliferation of naive T cells was detected by flow cytometry after co-cultivation in a certain proportion under CD3+CD28 stimulation for 3 days.
在T细胞的研究中发现,Abp1可通过抑制TCR信号对NFAT的激活以及下调TCR的表达对TCR信号进行负向调控[14]。同时,T细胞的增殖亦受到Abp1的影响[15]。在活化的T细胞中,Abp1聚集于T细胞与抗原递呈细胞接触的免疫突触中[14],亦有研究报道Abp1与F-actin在空间上的分离可抑制T细胞的运动和活性,从而降低了T细胞浸润以实现异源嵌合分子的免疫抑制活性[19]。这些研究说明Abp1对于T细胞的迁移有显着的影响。Treg细胞是一群主要在胸腺发育具有免疫抑制作用的T细胞亚群,其在胸腺发育成熟后迁移到外周各淋巴器官发挥其调节作用,因此,我们猜测Abp1有可能调控Treg从胸腺至外周的迁移。然而通过流式细胞术对胸腺、脾脏、皮下淋巴结以及肠系膜淋巴结的Treg进行分析后发现,Abp1缺失小鼠的Treg细胞在胸腺及外周淋巴器官内的Treg比例和数量与野生型小鼠相比没有明显差异,说明Abp1的缺失对于Treg的外周迁移并没有明显的影响,提示Abp1虽然是结合F-actin的效应分子,与肌动蛋白重组有密切关系,然而肌动蛋白重组对于Treg的迁移可能主要通过其他分子进行调控,Abp1通过肌动蛋白重组对Treg外周迁移的影响可能被其他肌动蛋白调节相关分子的调节所代偿。已有报道,在生长因子的刺激下,Abp1主要聚集在F-actin富集的迁移细胞的前缘,并且主要定位于Arp2/3复合物处[3],而Abp1又能够与WIP通过其SH3区域直接结合[1],在淋巴细胞中,WIP和另一重要肌动蛋白调控分子WASP亦可通过Arp2/3调控肌动蛋白重组,并且已报道WASP对于Treg的迁移和归巢具有显着影响[20],因此我们猜测,Abp1对于Treg的影响有可能受到WIP和WASP的补偿。
图7 缺失Abp1的小鼠Treg对活化的CD4+T以及CD8+T细胞产生的细胞因子的影响
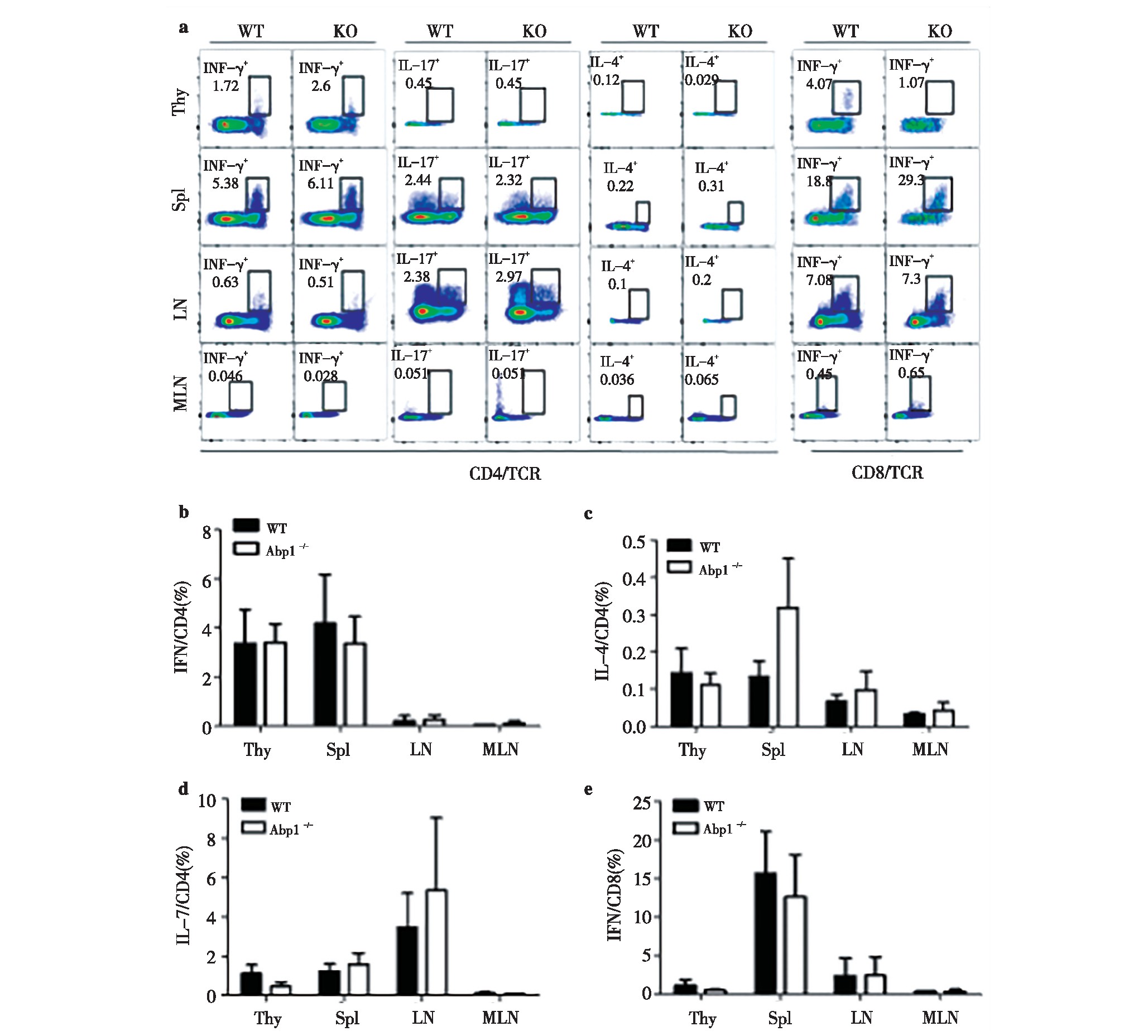
Fig 7 The effect of Treg from Abp1 KO mice on the ability of active CD4+T and CD8+T cells to produce cytokines
a)IFN-γ, IL-4 and IL-17 production in thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes CD4+T cells from WT and Abp1 KOmice. IFN-γin thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes CD8+T cells;b)the proportion of IFN-γin the thymus, spleen,peripheral lymph nodes and mesenteric lymph nodes CD4+T cells (n=4);c)the proportion of IL-4 in the thymus, spleen, peripheral lymph nodes andmesenteric lymph nodes CD4+T cells(n=4);d)the proportion of IL-17 in the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes CD4+Tcells (n=4);e)the proportion of IFN-γin the thymus, spleen, peripheral lymph nodes and mesenteric lymph nodes CD8+T cells (n=4).7 Abp1TregCD4+TCD8+T
另外,IL-2是调控Treg的分化和功能重要的细胞因子,IL-2能够促进Treg的发育、生存以及对T细胞的抑制功能[21]。有研究报道Abp1缺失的小鼠T细胞分泌的IL-2含量明显减少[15],因此我们使用体外抑制试验检测缺失Abp1的Treg的抑制功能是否受到影响,结果同样显示Treg的功能在缺失Abp1的情况下没有显着的变化,这与我们检测到胸腺及各外周淋巴器官中幼稚CD4与活化CD4的比例变化以及Treg表面功能分子的表达未有明显改变相一致。说明Abp1导致的IL2改变并不能影响Treg的抑制功能。
总之,虽然Abp1是调控肌动蛋白重要的效应分子,并且可调节多种细胞的迁移以及淋巴细胞的信号,然而Abp1对于Treg的迁移及功能的影响是有限的。
参考文献
[1]Cortesio CL,Perrin BJ,Bennin DA,et a1.Actin-binding protein-1 interacts with WASp-interacting protein to regulate growth factor-induced dorsal ruffle formation[J].Mol Biol Cell,2010,21(1):186-197.
[2]Larbolette O,Wollscheid B,Schweikert J,et a1.SH3P7 is a cytoskeleton adapter protein and is coupled to signal transduction from lymphocyte antigen receptors[J].Mol Cell Biol,1999,19(2):1539-1546.
[3]Kessels MM,Engqvist Goldstein AE,Drubin DG.Association of mouse actin-binding protein 1 (m Abp1/SH3P7),an Src kinase target,with dynamic regions of the cortical actin cytoskeleton in response to Rac1activation[J].Mol Biol Cell,2000,11(1):393-412.
[4]Ensenat D,Yao Z,Wang XS,et a1.A novel src homology 3domain-containing adaptor protein,HIP-55,that interacts with hematopoietic progenitor kinase 1[J].J Biol Chem,1999,274(48):33945-3350.
[5]Lila T,Drubin DG.Evidence for physical and functional interactions among two Saccharomyces cerevisiae SH3domain proteins,an adenylyl cyclase-associated protein and the actin cytoskeleton[J].Mol Biol Cell,1997,8(2):367-385.
[6]Kessels MM,Engqvist Goldstein AE,Drubin DG,et a1.Mammalian Abp1,a signal-responsive F-actin-binding protein,links the actin cytoskeleton to endocytosis via the GTPase dynamin[J].J Cell Biol,2001,153(2):351-366.
[7]Inoue S,Hayashi K,Fujita K,et a1.Drebrin-like (Dbnl)controls neuronal migration via regulating N-Cadherin expression in the developing cerebral cortex[J].J Neurosci,2019,39(4):678-691.
[8]Haeckel A,Ahuja R,Gundelfinger ED,et a1.The actinbinding protein Abp1 controls dendritic spine morphology and is important for spine head and synapse formation[J].JNeurosci,2008,28(40):10031-10044.
[9]Li Z,Park HR,Shi Z,et a1.Pro-oncogenic function of HIP-55/Drebrin-like (DBNL) through Ser269/Thr291-phospho-sensor motifs[J].Oncotarget,2014,5(10):3197-3209.
[10]Yang C,Li Z,Shi Z,et a1.Regulation of cell survival by the HIP-55 signaling network[J].Mol Biosyst,2014,10(6):1393-1399.
[11]Boateng LR,Bennin D,De Oliveira S,et a1.Mammalian actin-binding protein-1/Hip-55 interacts with FHL2 and negatively regulates cell invasion[J].J Biol Chem,2016,291(27):13987-13998.
[12]Onabajo OO,Seeley MK,Kale A,et a1.Actin-binding protein 1 regulates B cell receptor-mediated antigen processing and presentation in response to B cell receptor activation[J].J Immunol,2008,180(10):6685-695.
[13] Seeley Fallen MK,Liu LJ,Shapiro MR,et a1.Actinbinding protein 1 links B-cell antigen receptors to negative signaling pathways[J].Proc Natl Acad Sci U S A,2014,111(27):9881-9886.
[14]Le Bras S,Foucault I,Foussat A,et a1.Recruitment of the actin-binding protein HIP-55 to the immunological synapse regulates T cell receptor signaling and endocytosis[J].J Biol Chem,2004,279(15):15550-15560.
[15]Han J,Shui JW,Zhang X,et a1.HIP-55 is important for T-cell proliferation,cytokine production,and immune responses[J].Mol Cell Biol,2005,25(16):6869-6878.
[16]王宁,金敬一,陈丽华.免疫分子对CD4+Treg的调节作用[J].免疫学杂志,2018,34(1):73-79.
[17]Savage PA,Klawon DEJ,Miller CH.Regulatory T cell development[J].Ann Rev Immunol,2020,38:421-453.
[18]Hepper I,Schymeinsky J,Weckbach LT,et a1.The mammalian actin-binding protein 1 is critical for spreading and intraluminal crawling of neutrophils under flow conditions[J].J Immunol,2012,188(9):4590-4601.
[19]Skelton TS,Tejpal N,Gong Y,et a1.Downregulation of Rho A and changes in T cell cytoskeleton correlate with the abrogation of allograft rejection[J].Transpl Immunol,2010,23(4):185-193.
[20]Humblet Baron S,Sather B,Anover S,et a1.WiskottAldrich syndrome protein is required for regulatory T cell homeostasis[J].J Clin Invest,2007,117(2):407-418.
[21]Kond?lkováK,VokurkováD,Krejsek J,et a1.Regulatory T cells (TREG) and their roles in immune system with respect to immunopathological disorders[J].Acta Medica(Hradec Kralove),2010,53(2):73-77.





