口腔正畸论文第六篇:牙齿矫正中双膦酸盐的作用机制探究
摘要:双膦酸盐(Bisphosphonates, BPs)可高效抑制骨吸收,不仅影响骨骼新陈代谢,而且对正畸治疗中的牙齿移动具有一定作用。最新研究表明,BPs可通过不同机制干扰破骨细胞的骨吸收,具有限制支抗牙齿的移动,减少牙根吸收,保持腭部快速扩弓疗效,加速颅面部牵张成骨的骨重建过程,并防止骨钉感染与松动等诸多作用。本文就BPs作用机制、应用新进展和展望做归纳总结。
关键词:双膦酸盐; 正畸; 牙根吸收; 腭部快速扩弓; 下颌牵张成骨;
New progress and prospect of bisphosphonate in orthodontic treatment
TANG Zhongyuan JIANG Huan CHEN Yu HU Min
Department of Orthodontics, Hospital of Stomatology, Jilin University, Key Laboratory of Tooth Development and Jaw Bone Remodeling
Abstract:Bisphosphonates(BPs)can effectively inhibit bone resorption, which not only affects bone metabolism, but also has a certain effect on tooth movement in orthodontic treatment. Recent new studies have shown that BPs interfere with bone resorption of osteoclasts through different mechanisms, restrict the movement of anchorage teeth, reduce root resorption, and maintain the effect of rapid palatal expansion. Therefore, BPs can accelerate the process of bone reconstruction in craniofacial stretching, and prevent the infection induced by bone nail and the tooth loosening. This article summarizes new progress and prospect of BPs regarding to the mechanism and the assessment of benefits and risks for better and rational use in orthodontic treatment.
双膦酸盐(bisphosphonates, BPs) 主要用于治疗骨代谢疾病的药物,正畸治疗中,BPs可限制支抗牙齿移动、减少牙根吸收、防止骨钉的松动及感染、保持、巩固正畸后效果、加速术后骨性愈合过程产生一定影响。
1 BPs结构及种类
BPs为无机焦磷酸盐类似物。BPs化学结构可被修饰、改造。BPs分为含氮和不含氮两种类型。该两种类型BPs均能诱导破骨细胞(osteoclasts cell, OC)凋亡,从而抑制骨吸收。但是,它们作用途径迥异[1]。阿仑膦酸盐(Alendronate, Ad)片、依替膦酸钠(etidronate, Ed)片和帕米膦酸钠注射剂(pamidronate, Pd)、利塞膦酸钠(risedronate, Rd)片、和唑来膦酸(zoledronic acid, Zd)注射剂是常用的 BPs剂型[2] 。
2 BPs的作用机制
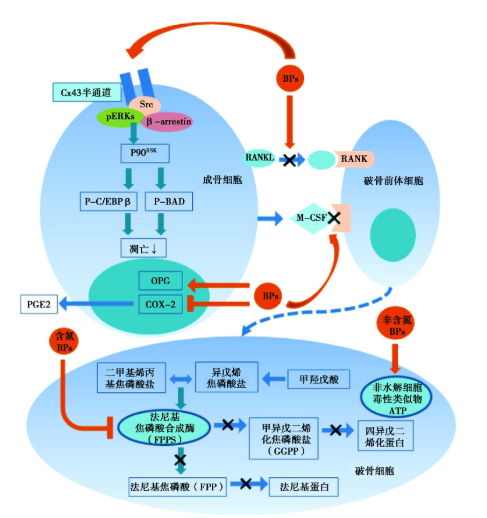
如图1 所示,BPs能下调成骨细胞(osteoblasts, OB)中的“NF-κB配体受体激活物”(receptor activator of NF-κB ligand, RANKL),上调OB中的骨保护素(osteoprotegerin, OPG),下调环氧化酶-2(cyclooxygenase-2, COX-2),最终影响前列腺素E2(prostaglandin E2, PGE2)表达,提示BPs对骨吸收有间接影响。BPs可通过Cx43半通道抑制OB和骨细胞的凋亡。Cx43半通道的开放导致激酶的激活,包括类固醇受体辅助激活因子(steroid receptor coactivator, Src)和“细胞外信号调节激酶”(extracellular signal-regulated kinases, ERKs),激活ERK,促进细胞质靶蛋白磷酸化、调节p90RSK激酶活性、最终促进靶底物BAD和C/EBPβ的序列磷酸化,从而抑制凋亡。同时,RANK/RANKL 信号通路是OC分化最重要的调节方式,BPs可分别抑制RANKL与破骨前体细胞膜上核激活因子受体(receptor activator of NF-κB, RANK)结合后,刺激破骨细胞前体细胞向成熟破骨细胞分化,也刺激了成熟破骨细胞发挥骨吸收功能。此外,BPs抑制巨噬细胞集落刺激因子(macrophage-colony stimulating factor, M-CSF)与破骨前体细胞膜上受体结合,减少细胞信号发生传递,减少OC的分化。
图1 BPs对OB和OC的影响
如图1所示,OC从骨基质释放BPs。含N-BPs能有效抑制法尼基焦磷酸合成酶 (farnesyl pyrophosphate synthase, FPPS),这是甲戊酸/胆固醇生物合成途径中的关键酶,抑制法尼基蛋白(farnesyl pyrophosphate, FPP)生成,另外,通过抑制四异戊二烯化焦磷酸盐(geranylgeranyl pyrophosphate, GGPP),而抑制四异戊二烯化蛋白(protein prenylation, PP)生成。非含N- BPs在代谢过程中,它们合并成为非水解的细胞毒性类似物ATP(AppCp),影响OC及前体细胞的蛋白合成过程,从而降低OC活性。
最新实验研究表明,BPs能够与ATP竞争,干扰3-羟基-3-甲基-戊二酰通路[3]。高浓度BPs可沉积骨组织中,抑制内皮增殖,减少毛细血管形成,有助于BPs抗血管生成[4,5]。
另外,BPs不仅可减少OC细胞数量,还会改变细胞形态和结构。使OC细胞外形变为波浪状,细胞质出现极性[6]。此外,在正畸牙移动期间,BPs显著减少亚细胞器中H+-ATPase和组织蛋白酶K(cathepsin K)表达[7]。进一步发现,BPs减少牙齿移动机制为减小牙周膜上应力,下调PGE2、COX2以及RANKL的mRNA表达,提示BPs可减慢骨吸收速度[8]。
Franzoni用不锈钢拉簧移动左侧上颌第一磨牙后进行观察,比较移动侧及对侧的正畸牙移动,结果显示,Ad和Zd明显减少正畸牙齿移动量(orthodontic tooth movement, OTM)、降低OC细胞和炎性细胞数量。Zd还可减少血管和成纤维细胞数量,并减少更多OTM。最新一项研究同样观察到Zd可减少OC细胞数量,提高HE染色后透明区域面积的百分比[9]。
Grimm等应用细胞压力加载实验发现,氯膦酸盐(chlorophosphate, Cp)可同时降低施加或未施加压缩力细胞的活力。在施加压缩力细胞中,Cp可显著降低OPG、RANKL蛋白合成以及RANKL/OPG比值。因此,Grimm等认为,正畸牙移动速度减慢的原因可能不仅因为Cp对OC细胞存在直接影响,还因为Cp所引起的OB与OC细胞相互作用而产生作用[10]。
3 BPs在正畸治疗的应用
3.1 BPs可减少支抗牙齿移动
牙齿移动是由机械力作用使牙周韧带和牙槽骨组织重建的过程。相关研究表明,BPs可减少OTM,从而增强正畸牙齿的支抗。有学者尝试在患者邻近磨牙区域的骨膜下注射(局部给药)或皮下注射(全身给药)BPs[6,11,12],再施加120~165 mN推力,可显著减少OTM。多项研究进一步发现,利塞膦酸钠(Rizonium, Rz)是BPs中最有效的能减少OTM的药物,其次是4-氨基-1-羟基亚丁基-1,1-BPs(4-amino-1-hydroxysubbutyl-1,1-BPs, AHBuBPs)和氯膦酸盐[13]。另一方面基础实验表明,使用Zd治疗去卵巢大鼠可减少OTM,同时减少牙根吸收量[14]。最新一项研究再次证实,当牙根部骨膜下区域应用高剂量Cp或者较短时间间隔内多次应用低剂量Cp时,同样会减少OTM[15]。
支抗控制是正畸治疗计划的重要组成部分,尤其是拔牙病例中支抗控制问题显得格外重要。Zd 可能是解决这一问题的有效选择,因为它是BPs家族中作用最有效的成员,通过抑制OC细胞功能增强骨吸收的抑制作用,达到增强牙齿支抗。因此, Zd可能是正畸支抗控制的最佳选择[16,17]。
3.2 减少术区骨吸收及炎症
Cuairan等的研究显示Zd可以增加微型种植体稳定性。局部小剂量的Zd能够使微型种植体周围的小梁骨高度堆积,从而增加微型种植体的牢固度,增强了微型种植体植入物在狗体内的稳定性[18]。
此外,还有一个关于炎症反应的实验。炎性因子和严重的破骨细胞活动会显著影响生物材料的疗效。Li等的研究证明IFN-γ和Zd的结合使用通过骨再生,而减少模型大鼠的骨吸收[19]。
3.3 减少牙根吸收
使用Zd治疗去卵巢大鼠还可以减少牙根吸收量[14],局部应用Cp、Rd或全身应用 AHBuBPs,牙根吸收量也可以减少[12]。在正畸加力后的第7天到第28天期间,每3天进行一次局部骨膜下注射,可观察到,随AHBuBPs剂量增加,牙根吸收量显著降低。从组织学上,可观察到处理侧的OB细胞的形态学改变,细胞失去极性,细胞核数量增加[16]。
3.4 维持上颌快速扩弓疗效
上颌快速扩弓是治疗上颌牙弓狭窄的方法之一。该正畸装置可使骨缝扩张并沉积新骨,符合组织正常生理活动。骨缝会逐渐重塑,发生沉积,进一步再吸收和纤维化[20,21]。常规正畸治疗过程中,为了确保治疗后疗效稳定,使用各种保持器保持牙齿位置,并在上颌扩弓治疗后就进行牙周重建。基于扩弓器上述作用原理,应用BPs可防止上颌扩张治疗后的骨性复发。并且,有学者提出,将局部 BPs 注射给药与扩弓装置结合,可更安全地保持腭部快速扩弓的治疗效果。该项研究中,共有44只Wistar大鼠进行快速腭部扩弓,实验组大鼠局部注射依替膦酸钠(etidronate, Ed),空白组注射生理盐水,在第7天时,注射Ed组扩弓后复发率较未注射组的复发率显著降低。此外,BPs对羟基磷灰石晶体具有高度亲和力,也可能减少骨吸收,减少复发可能性。组织学检查进一步观察发现,与生理盐水注射组相比,BPs注射组可减少多核巨细胞数量[22]。 最近的一项报道也支持上述研究结果,局部应用1-H-E-1、1-BPs或乙二醇-1,1-BPs不仅可以减少大鼠OTM,还可以减少OC细胞数量[23]。该研究还发现,随着OC细胞数量减少,而干骺端骨面积增加,但骨干的骨面积没有变化,提示OC细胞对BPs的生物学应答可能表现出特异性位点差异。另外,有项最新研究表明,通过双钙黄绿素标记(dicalcium yellow green marker, DYGM)观察发现,BPs处理可减少上颌扩弓小鼠的骨形成,还可观察到,在组织学水平,BPs处理的小鼠腭中缝结构出现新生结构紊乱,并且呈现软骨不规则形态。Micro-CT显示,用BPs治疗的小鼠上颌扩张总量显著降低,提示可能对增强正畸中牙支抗固定力起正向作用。最终得出,OC细胞介导的骨吸收是上颌腭中缝及其结构重建所必需,而BPs可能会影响OC细胞功能,进而影响新骨形成[24]。
3.5 加速下颌骨牵张成骨愈合过程
在牵张成骨治疗中,相邻的牵引骨钉骨可能会发生骨质疏松。被认为是该项治疗的主要缺陷之一,因为牵引稳定性可由于矿化骨密度降低而受到影响。相关文献综研究提及,在Zd对下颌骨牵张成骨作用影响的研究中发现,全身单次使用BPs有利于下颌骨缺隙处新骨形成,并且增加骨钉植入区域骨密度以及骨矿化含量。因此使用Zd可加速颅面部牵张成骨骨重建过程,减少骨钉周围的骨质疏松的同时,还可减少外源性骨钉周围感染风险,缩短其达到稳定期所需时间[25]。最近发表的另一项研究显示,在家兔下颌骨的骨钉和再生区中,Zd可以显著增加OB细胞数量,而显著减少OC细胞数量,加速组织早期愈合[26]。
4 不良反应及安全性评价
在Zd对下颌骨牵张成骨作用影响的研究中不仅发现,Zd可使颌骨功能改善、显著改善骨重塑,而且,还观察到,Zd的平均给药时间为21 d情况下,在此期间动物均保持健康状态[26]。
一项回顾性临床研究显示,收集观察20例使用BPs拔牙患者,以及93例未使用BPs的对照拔牙患者。前者除治疗时间有所延长,但从未出现颌骨坏死等症状[9]。而另一项研究中,也未发现不良反应或安全性问题,但研究者提出,未来试验应该进一步明确Cp在人体中的安全治疗总剂量、间隔应用剂量及其潜在的副作用[15]。
5 结论与展望
综上所述,BPs可通过影响破骨细胞作用,增加正畸牙支抗,可考虑局部个别牙齿应用BPs,使得正畸力学系统更加可控,另外,药物相比于口外或口内的支抗装置,没有任何异物感,并且可能减少口外弓、横腭杆或种植支抗的使用,最终总体可提高治疗效率,减少患者痛苦,充分实现治疗目标。现如今种植支抗是大多数正畸医生热衷的工具,但也会在一部分患者中出现种植支抗松动脱落等问题,而BPs可能是解决这一问题的最佳方案。
其次,在正畸治疗结束后,应用BPs可减少正畸后牙齿和腭中缝的复发,从而大幅减少保持时间,并且BPs具有加快牵张成骨或骨移植的骨愈合过程。此外,牙根吸收和牙周病骨吸收是正畸中难以控制的常见问题,BPs可减少实验动物牙根吸收量及骨吸收量,可一定程度解决正畸过程中的牙根吸收或骨吸收的问题。另外,通过全身或局部应用BPs,可辅助用于一些依赖骨增生的正畸治疗,如上颌骨性扩张或下颌牵张性成骨,并且可以用于减少骨钉周围的骨质疏松,减少外源性骨钉周围感染的风险,并且缩短达到稳定期所需时间。
对于骨、牙周以及牙体组织,BPs均可以产生诸多作用,医生需根据患者健康、治疗计划基础上,充分考虑到BPs可能发挥的作用从而恰当、正确使用BPs。另外,在该药物广泛应用于临床之前,仍需要进行更多的前瞻性随机临床观察,以便获得BPs对正畸牙齿移动影响更有说服力的科学依据。
参考文献
[1] Halasy-Nagy JM,Rodan GA,Reszka AA.Inhibition of bone resorption by alendronate and risedronate does not require osteoclast apoptosis[J].Bone,2001,29(6):553-559.
[2] Licata AA.Discovery,clinical development,and therapeutic uses of bisphosphonates[J].Ann Pharmacother,2005,39(4):668-677.
[3] Russell RGG,Rogers Michael J,Frith Julie C,et al.The pharmacology of bisphosphonates and new insights into their mechanisms of action[J].J Bone Miner Res,2011,14(S2):53-65.
[4] Fournier P,Boissier S,Filleur S,et al.Bisphosphonates inhibit angiogenesis and testosterone-stimulated vascular regrowth in the ventral prostate in castrated rats[J].Cancer Res,2002,62(22):6538.
[5] Wood J,Bonjean K,Ruetz S,et al.Novel antiangiogenic effects of the bisphosphonate compound zoledronic acid[J].J Pharmacol Exp Ther,2002,302(3):1055.
[6] Ruggiero SL,Dodson TB,Assael LA,et al.American association of oral and maxillofacial surgeons position paper on bisphosphonate-related osteonecrosis of the jaws-2009 update[J].J Oral Maxillofac Surg,2009,67(5):2-12.
[7] Sato YSH,Kobayashi Y.Bisphosphonate administration alters subcellular localization of vacuolar-type H+-ATPase and cathepsin K in osteoclasts during experimental movement of rat molars[J].Anat Rec,2000,260(1):72-80.
[8] Liu L,Igarashi K,Haruyama N,et al.Effects of local administration of clodronate on orthodontic tooth movement and root resorption in rats[J].Eur J Orthod,2004,26(5):469-473.
[9] Franzoni JS,Soares FMP,Zaniboni E,et al.Zoledronic acid and alendronate sodium and the implications in orthodontic movement[J].Orthod Craniofac Res,2017,20(3):164-169.
[10] Grimm S,Walter C,Pabst A,et al.Effect of compressive loading and incubation with clodronate on the RANKL/OPG system of human osteoblasts[J].J Orofac Orthop,2015,76(6):531-542.
[11] Adachi H,Igarashi K,Mitani H,et al.Effects of topical administration of a bisphosphonate (risedronate) on orthodontic tooth movements in rats[J].J Dent Res,1994,73(8):1478-1486.
[12] Liu L,Igarashi K,Haruyama N,et al.Effects of local administration of clodronate on orthodontic tooth movement and root resorption in rats[J].Eur J Orthod,2004,26(5):469-473.
[13] Keles A,Grunes B,Difuria C,et al.Inhibition of tooth movement by osteoprotegerin vs.pamidronate under conditions of constant orthodontic force[J].Eur J Oral Sci,2007,115(2):131-136.
[14] Sirisoontorn I,Hotokezaka H,Hashimoto M,et al.Orthodontic tooth movement and root resorption in ovariectomized rats treated by systemic administration of zoledronic acid[J].Am J Orthod Dentofacial Orthops,2012,141(5):563-573.
[15] Naka? E,Lauc T,Tiro A,et al.Dose- and time-dependent effects of clodronate on orthodontic tooth movement[J].Bosnian J Basic Med,2017,17(1):23-28.
[16] Seifi M,Asefi S,Hatamifard G,et al.Effect of local injection of Zolena,zoledronic acid made in Iran,on orthodontic tooth movement and root and bone resorption in rats[J].J Dent Res,2017,11(4):257-264.
[17] Brunet MD,Araujo CMD,Johann ACBR,et al.Effects of zoledronic acid on orthodontic tooth movement in rats[J].Braz Dent J,2016,27:515-523.
[18] Cuairan C,Campbell PM,Kontogiorgos E,et al.Local application of zoledronate enhances miniscrew implant stability in dogs[J].Am J Orthod Dentofacial Orthop,2014,145(6):737-749.
[19] Li P,Hashimoto Y,Honda Y,et al.The Effect of interferon-gamma and zoledronate treatment on alpha-tricalcium phosphate/collagen sponge-mediated bone-tissue engineering[J].Int J Mol Sci,2015,16(10):25678-25690.
[20] Miyawakl S,Forbes DP.The morphologic and biochemical effects of tensile force application to the interparietal suture of the Sprague-Dawley rat[J].Am J Orthod Dentofacial Orthop,1987,92(2):123-133.
[21] Vardimon AD,Brosh T,Spiegler A,et al.Rapid palatal expansion:Part 1.Mineralizationpattern of the midpalatal suture in cats[J].Am J Orthod Dentofacial Orthop,1998,113(4):371-378.
[22] Warita HKY,Kurihara S,Ohya K.Effects of local injection with bisphosphonate (HEBP) on experimental tooth movement[J].J Jpn Orthod Soc,1992,51:292-301.
[23] Lee K,Sugiyama H,Imoto S,et al.Effects of bisphosphonate on the remodeling of rat sagittal suture after rapid expansion[J].Angle Orthod,2001,71(4):265-273.
[24] Koehne T,Kahl-Nieke B,Amling M,et al.Inhibition of bone resorption by bisphosphonates interferes with orthodontically induced midpalatal suture expansion in mice[J].Clin Oral Invest,2018,22(6):2345-2351.
[25] Pampu AA,Dolanmaz D,Tüz HH,et al.Experimental evaluation of the effects of zoledronic acid on regenerate bone formation and osteoporosis in mandibular distraction osteogenesis[J].J Oral Maxillofac Surg,2006,64(8):1232-1236.
[26] Pampu AA,Dolanmaz D,Tüz HH,et al.Histomorphometric evaluation of the effects of zoledronic acid on mandibular distraction osteogenesis in rabbits[J].J Oral Maxillofac Surg,2008,66(5):905-910.
点击查看>>口腔正畸论文(专业推荐范文8篇)其他文章