
精子的冷冻保存是遗传育种和种质资源保护的有效保障,但冷冻过程中的渗透压变化和冰晶形成以及抗冻剂的毒性均会对精子产生不同程度的损伤,其中包括精子DNA损伤。精子DNA作为遗传物种的载体,其完整性是子代正常发育的必要保障。
因此,冷冻保存过程中精子DNA的损伤程度应作为其保存效果的一个重要评价指标。单细胞凝胶电泳(single cell gel electrophoresis,SCGE)又称彗星试验(comet assay),是一种检测DNA损伤的经典方法。细胞通过裂解、DNA解链等过程,经电泳使损伤的DNA从细胞核中溢出,朝阳极泳动,形成尾状带,即彗尾,未损伤的DNA部分保持球形,两者共同形成“彗星”。彗尾的长度代表DNA迁移距离,荧光染色后彗尾的荧光强度与DNA损伤度相关,由此可以检测单个细胞的DNA损伤。该方法可以在荧光显微镜下直接观察细胞DNA的损伤情况,且具有快速、简便及灵敏的特点,已被广泛应用于家蚕精子细胞、河蟹精子细胞、鱼类精子细胞及人类精子细胞的DNA损伤检测中。
南美白对虾(Litopenaeus vannamei)是我国对虾养殖的重要品种之一,开展南美白对虾精子超低温冷冻保存研究,建立优质精子的超低温冷冻保存库,对其种质资源的保护和养殖品种的改良具有重要意义。有关南美白对虾精子超低温冻存的研究已有报道,但迄今为止,南美白对虾冻存精子DNA损伤的研究尚未见报道。本研究以灭菌天然海水为基础液,以不同浓度的二甲基亚砜(dimethyl sulfox-ide,DMSO)为抗冻剂,采用程序降温法对南美白对虾精子进行超低温冷冻保存,对于冻存的南美白对虾精子,以鲜精作为对照,利用SCGE方法对其DNA的损伤状况进行研究,以期为南美白对虾精子超低温冷冻保存技术的改进及冻精质量的检测提供参考。
1、材料与方法
1.1材料
1.1.1 试验材料试验所需南美白对虾来自广西国家级南美白对虾育种中心培育的优良种虾,成熟雄虾体长12.49cm±0.42cm,体重39.57g±3.46g,培育亲虾池水温27℃~28 ℃,盐度28 ‰~30 ‰。带有成熟精荚的雄虾精囊发白、饱满,完整并成熟的精荚通过用拇指轻轻挤压获得,精荚平均重量46.41mg±7.43mg,挤压出的精荚放入灭菌的4 ℃天然海水中短暂保存。
1.1.2 主要试剂 Trypsin 1∶250(胰蛋白酶)、DMSO、Na2EDTA(乙二胺四乙酸二钠)、Triton X-100,Amresco公司产品;NMA(正常熔点琼脂糖),Biowest公司产品;LMA(低熔点琼脂糖)、Tris(三羟甲基氨基甲烷)、Sodium lauroyl sarcosine(十二烷基肌氨酸钠),Sigma公司产品;蛋白酶K,Merck公司产品;GelRed,Biotium公司产品;其他试剂均为国产分析纯。
1.1.3 试剂配制 Trypsin1∶250使用灭菌天然海水配置成1g/L的溶液;NMA和LMA用不含钙、镁离子的磷酸盐缓冲液(PBS,pH7.4)配制,浓度均为10g/L;细胞裂解液包含2.5mol/L NaCl,100mmol/L Na2EDTA,10 mmol/L Tris,10g/L肌氨酸钠,pH10,临用前加10mL/L Triton X-100,100mL/L DMSO;细胞消化液包含2.5mol/L NaCl,5mmol/L Tris,0.5g/L肌氨酸钠,pH7.4,临用前加入蛋白酶K,终浓度0.5mg/mL;电泳液包含300mmol/L乙酸钠,100mmol/L Tris,pH=10;中和液为0.4mol/L Tris,加HCl调至pH 7.0;GelRed染色液是用双蒸水将GelRed 10 000×储液稀释约3 300倍到0.1mol/L NaCl中配成稀释液。
1.1.4主要仪器。IBF-100程序降温仪,英国Planer公司产品;Nikon 80i荧光显微镜,日本NI-KON公司产品;DYY-8B型电泳仪,北京市六一仪器厂产品;JY-SPCT型电泳槽,北京君意东方电泳设备有限公司产品。
1.2方法
1.2.1试验材料准备
收集的南美白对虾精荚在37℃水浴条件下用1g/L的胰蛋白酶消化5min,150mL/L的胎牛血清终止消化反应,500r/min离心10min收集游离精子上清液,收集的上清再经2 000r/min离心5min,获得游离精子沉淀,加入0.5mL灭菌天然海水轻轻混匀成精液后置于4 ℃冰箱备用。
1.2.2 精液冷冻与复苏
南美白对虾精子的超低温保存是以灭菌天然海水(盐度28‰~30 ‰)为基础液,在收集的精液中加入终浓度为50、100、150、250mL/L的DMSO作为抗冻剂,使用程序降温仪进行进一步的降温,降温程序为:4 ℃平衡30min,以-5 ℃/min的速率降至-20 ℃;-20 ℃平衡5min,以-10℃/min的速率降至-80 ℃;-80 ℃平衡5min,然后置于液氮中保存。水浴法进行精液的复苏,具体操作方法是将冷冻管从液氮中取出后立即投入37 ℃水浴锅中快速摇荡至液体刚刚全部溶解为止。
1.2.3鲜精与冻精 DNA 的SCGE检测
按徐西长等方法略加改进,具体步骤如下:稀释:精液用4 ℃的PBS(pH7.4)离心洗涤2次 (4 ℃,2 000r/min),每次10min,鲜精及冻精均用PBS稀释至约8×106个/mL,取制备好的精液50μL与10g/L的LMA 350μL混匀于5mL离心管中,精液最终浓度为106个/mL,4 ℃放置10min。
裂解:加入细胞裂解液1mL/管,于4℃裂解1h;消化:吸弃裂解液,加入细胞消化液1mL/管,55℃水浴3h,将精子核蛋白及其他杂蛋白消化掉;铺片:吸弃消化液,PBS洗涤凝胶2次,70 ℃水浴加热3min,使含有精子的LMA融化成液态,制备双层凝胶:吸取100μL 10g/L NMA加在普通的载玻片上,加盖22mm×22mm盖玻片,4℃下放置10min,待第一层胶凝固后轻轻去除盖玻片,吸取100μL细胞凝胶混合物加在第一层凝胶上,加盖盖玻片于4 ℃下冷凝10min;解旋:轻轻去掉盖玻片将载玻片水平放入碱性电泳液中,4 ℃放置30min,使精核DNA双链解旋;电泳:在电压17V、电流100mA条件下电泳60 min;中 和:取出载玻片,吸净残液,用0.4mol/L Tris-HCl(pH=7.0)中和15min;染色:吸取残液,浸入GelRed稀释液中染色10min,然后于双蒸水浸泡15min脱色;观察:将染色后的标本加盖盖玻片置于Nikon 80i型荧光显微镜510nm~560nm绿光下,400倍下随机观察、拍照50个左右细胞。
1.2.4 数据分析
1.2.4.1彗星电泳图片的分析处理拍照所得彗星电泳图像用CASP分析软件分析测量DNA迁移的各种参数:彗星拖尾长度(L tail)、彗星尾部DNA的相对含量(Tail DNA)、尾距(TM,即L tail×TailDNA)、Olive尾距(OTM,即Tail DNA×迁移DNA中心密度)。
1.2.4.2彗星率与损伤系数计算彗星率=(彗星细胞数目/总细胞数目)×100%;损伤系数=[(0级损伤的细胞个数×0)+(Ⅰ级损伤的细胞个数×1)+(Ⅱ级损伤的细胞个数×2)+(Ⅲ级损伤的细胞个数×3)+(Ⅳ级损伤的细胞个数×4)]。采用SPSS 18.0分析所有试验数据和组间单因素方差分析,以P=0.05为检验标准,统计结果以平均数±标准差表示。
2、结果
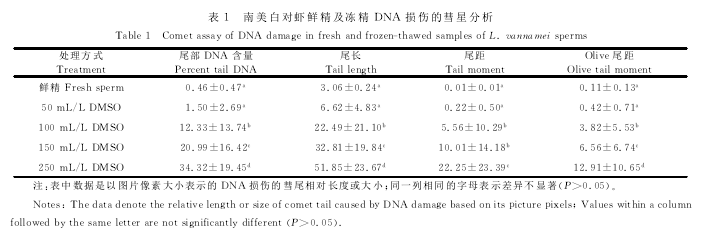
2.1南美白对虾鲜精及冻精的DNA损伤程度分级
根据彗星拖尾中DNA的量占细胞总DNA的比例,将南美白对虾鲜精及冻精核DNA损伤程度分5级:0级,<5%,无损伤,精子核完整、呈圆形(图1A-1);Ⅰ级,5% ~20%,轻度损伤,精子核缩小,可见少许彗尾(图1B-1);Ⅱ级,20%~40%,中度损伤,精子核进一步缩小,彗尾明显延长(图1C-1);Ⅲ级,40%~95%,重度损伤,精子核明显缩小,彗尾较长、荧光信号强而密(图1D-1);另外精子核损伤最严重的一级在本研究中没有出现(Ⅳ级),>95%,完全损伤,精子核模糊或基本消失,彗尾长、荧光信号强而密。图1A-2、B-2、C-2、D-2分别是对应损伤级别的CASP分析图。
2.2南美白对虾鲜精及冻精DNA损伤的彗星分析
鲜精和各冻精组的SCGE检测结果显示,彗星尾部DNA含量、尾长、尾距、Olive尾距随DMSO浓度的升高而增大。其中冻精的彗星尾部DNA含量、尾长、尾距、Olive尾 距 在DMSO浓 度 为50mL/L时与鲜精相比差异不显著(P>0.05),在DM-SO浓度为100、150、250mL/L时与鲜精相比差异显著(P<0.05);不同DMSO浓度之间,冻精的彗星尾部DNA含量、尾长、尾距、Olive尾距随DMSO浓度增大(P<0.05)。
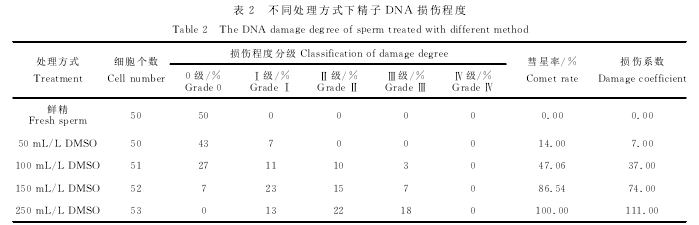
2.3南美白对虾鲜精及冻精的彗星率及核DNA损伤情况
根据上述精子核DNA损伤程度分级方法,通过CASP分析软件对南美白对虾鲜精及冻精的SCGE彗星图片数据进行分析处理,得出鲜精及冻精的彗星率及核DNA损伤情况(表2)。由表2可知,随着DMSO浓度增大,彗星率及损伤系数逐渐增大,鲜精基本无损伤,50mL/L DMSO组基本为轻度损伤,100mL/L和150mL/L DMSO组以轻度损伤和中度损伤为主,但150mL/L DMSO组与100mL/LDMSO组相比中度损伤和重度损伤的比例增大,250mL/L DMSO组中度损伤和重度损伤的比例进一步增大,但完全损伤在本研究中没有出现。
3、讨论
精子作为遗传物质的载体具有重要的研究意义,大量的文献报道了精子超低温保存的条件、方法及冷冻复苏等问题,但对精子超低温保存后DNA成分的变化研究却很少,而应用单细胞凝胶电泳技术检测精子DNA损伤报道则更少。Marty M S等用SCGE研究P53基因对细胞增殖作用时发现,P53基因缺陷小鼠的精子DNA断裂数目远低于野生型,推测可能是由于P53基因缺陷引起DNA交联。
Steele E K等对冰冻的精液标本进行了SCGE分析,结果证实冰冻并没有对精子遗传物质产生影响。
宋博等在国内最先报道了关于精子的单细胞凝胶电泳技术,他们根据精子细胞的特点在前人的基础上改进了试验条件,此后又对冰冻精子进行了电泳试验,结果也证实了冰冻不会引起精子DNA损伤。作为单倍体细胞的精子,其染色质结构与体细胞有所不同,其DNA与鱼精蛋白紧密结合成超螺旋四聚体,染色质高度凝聚在一起,细胞内水分含量很少。而冰冻对细胞的影响主要在于细胞内水分形成冰晶时而引起对细胞的机械性损伤,由于精细胞的特殊结构,特别是细胞内水分含量少,因此低温冷冻对精子DNA的影响应该是不明显的。
但是,也有人认为在冷冻精液的试验操作过程中,精液稀释、离心、抗冻剂的添加量等都可能使精子DNA受到损伤。徐西长等对超低温冷冻保存的真鲷精子DNA损伤进行SCGE检测,发现彗星率即DNA的损伤状况与DMSO浓度呈正相关,随着DMSO浓度的增大,真鲷精子DNA损伤的比例增加,并分析认为在相同的降温程序下冻存精子,冻精组彗星率结果的差异是不同的抗冻保护剂在低温冷冻保存过程中产生的,而与鲜精的差异应是超低温与抗冻保护剂共同作用的结果。叶霆等对超低温冷冻保存的黑鲷精子的DNA损伤检测也发现彗星全长和尾长随抗冻剂DMSO浓度的升高而增大。
分析认为较高浓度的抗冻剂DMSO是造成冻精核DNA损伤的主要原因。陈东华等对体外冷冻保存的河蟹精子研究发现,加入冷冻保护剂的精子与鲜精相比其DNA已出现不同程度的损伤,而冷冻后对河蟹精子DNA的损伤程度更大。因此,在评价甲壳动物精子冷冻保存效果时,不仅要关注其存活率,同时更应关注冷冻对精子DNA的损伤。魏平等对真鲷鲜精和各冻精组的SCGE检测结果显示,彗星尾矩随抗冻剂DMSO及乙二醇(EG)浓度的升高而增大。其中DMSO浓度在50mL/L~250mL/L及EG在50mL/L~200mL/L时,冻精的彗星尾矩与鲜精相比差异不显著(P>0.05);DMSO浓度为300mL/L、EG浓度为250mL/L及300mL/L时,冻精的彗星尾矩与鲜精相比差异显著(P<0.05)。
但是,也有人发现低浓度的抗冻剂对精子DNA损伤不明显,Zilli L等对超低温冻存的狼 鲈精子的DNA损伤的SCGE检测发现,以100mL/L DMSO为抗冻剂冷冻狼鲈精子,冻精与鲜精的DNA损伤状况无显著差异。
Labbe C等研究了超低温冻存对虹鳟精子DNA稳定性的影响,发现以100 mL/LDMSO为抗冻剂冷冻虹鳟精子,冻精的DNA损伤与鲜精差异不显著,冻精受精率达到93.5%。本试验结果表明,南美白对虾冻存精子的DNA损伤程度随着DMSO的浓度升高而增大,冻精的彗星尾部DNA含量、尾长、尾距、Olive尾距在DMSO浓度为50mL/L时与鲜精差异不显著(P>0.05),在DM-SO浓度为100、150、250mL/L时与鲜精差异显著(P<0.05);随着DMSO浓度增大,彗星率及损伤系数逐渐增大,并且精子DNA中度损伤和重度损伤的比例逐渐增大,但完全损伤在本研究中没有出现。
关于SCGE法检测细胞DNA损伤的试验条件,因研究者研究的物种不同而异。在本试验过程当中,针对精子细胞的特殊结构对传统的SCGE方法进行了改进,在细胞裂解后加入含有蛋白酶K的细胞消化液在55℃条件下水浴一个步骤,以消化除去精子核蛋白及其他杂蛋白,使精子DNA更易解聚、解螺旋;另外先将精子细胞预处理后再铺胶电泳,使试验相对容易操作,避免了铺胶后精子细胞预处理而造成的脱胶等问题,同时也减少了蛋白酶K的使用量;针对本试验过程中使用的仪器对电泳条件也进行了优化,发现在100mA、17V、60min条件下SCGE的灵敏性较高、彗星图谱清晰;在染色环节,探索用GelRed代替传统的溴化乙锭(Ethidium bro-mide,EB),也取得了很好的效果,且降低了试验者的毒性风险,减轻了对环境的污染;最后,本试验使用CASP软件对SCGE的试验结果进行分析,客观、精确地测定了彗星尾部DNA含量、彗星尾长、尾矩及Olive尾矩等参数,结合彗星率及损伤系数进行分析,保证了试验结果分析的准确性和可靠性。





