摘 要: 为探究虎斑乌贼(Sepia pharaonis)喷墨对其行为、生长、存活及酶活的影响,采用单因子试验法,进行了喷墨虎斑乌贼(喷墨组)和未喷墨虎斑乌贼(对照组)的养殖比较试验,试验时间30 d.研究结果表明,虎斑乌贼喷墨后会导致其体色泛白、活力下降,严重的会导致死亡;养殖30 d后,对照组虎斑乌贼的存活率、增重率和特定生长率均显着高于喷墨组(P<0.05);特定生长率和增重率在试验时间≤10 d时对照组显着高于喷墨组(P<0.05),随着养殖时间延长, 2组无显着差异(P>0.05);喷墨组的抗氧化能力包括超氧化物歧化酶(SOD)活性、丙二醛(MDA)和谷胱甘肽(GSH)含量均显着高于对照组(P<0.05),但过氧化氢酶(CAT)却显着低于对照组(P<0.05);喷墨组的代谢酶包括谷丙转氨酶(GPT)和乳酸脱氢酶(LDH)的活性均显着高于对照组(P<0.05),但酸性磷酸酶(ACP)的活性却显着低于对照组(P<0.05).试验表明,虎斑乌贼喷墨不仅会导致其生长缓慢、存活率下降,并且会影响其体内相关酶的活性.
关键词: 虎斑乌贼; 喷墨; 生长率; 存活率; 酶活性;
Abstract: In order to explore the effects of Sepia pharaonis ink release on its behavior, growth, survival and enzyme activities, a single factor test method was applied to test the differences between ink release Sepia pharaonis(ink release group) and normal Sepia pharaonis(control group) over a period of 30 days. Following a large amount of ink release, cuttlefish Sepia pharaonis became pale, and had a low vitality with even severe deaths. The survival rate, weight gain rate, and specific growth rate of the control group were significantly higher than those of ink release group after 30 days(P<0.05). The growth rates and weight gain rates of the control group were significantly higher than those of the ink release group(P<0.05) during the first 10 days.There was no significant difference between the groups after the breeding period continued(P>0.05). The antioxidant capacity of the ink release group, including the superoxide dismutase(SOD) enzyme activity, the content of malondialdehyde(MDA) and glutathione(GSH) of the ink release group were significantly higher than those of the control group(P<0.05). Catalase(CAT) of the ink release group was significantly lower than that of the control group(P<0.05). Metabolic enzymes including alanine aminotransferase(GPT) and lactate dehydrogenase(LDH) of the ink release group were significantly higher than those of the control group(P<0.05).Acid phosphatase(ACP) activity of the ink release group was significantly lower than that of the control group(P<0.05). In conclusion, the ink release of Sepia pharaonis shall not only lead to its slow growth and low survival rate, but also affects the enzyme activities.
Keyword: Sepia pharaonic; ink release; growth rate; survival rate; enzyme activities;
虎斑乌贼(Sepia pharaonis)隶属软体动物门(Mollusca)、头足纲(Cephalopoda)、乌贼目(Sepiida)、乌贼科(Sepiidae)、乌贼属(Sepia)[1],广泛分布于中国南海、苏伊士运河南部、马达加斯加、日本南部、印度尼西亚东部以及澳大利亚西北部,是印度洋北部和南亚墨鱼渔业的主要组成部分[2,3,4].虎斑乌贼具有生长快、抗病力强、养殖周期短、蛋白含量高、饵料转换率高以及适合高密度养殖等特点,是一种适合规模化人工养殖的渔业种类[5].但虎斑乌贼在捕食竞争和环境因子变化超出其适应范围,如温度、盐度、氨氮含量等急剧变化时会出现喷墨现象,而喷墨往往会导致虎斑乌贼死亡,这严重挫伤了养殖户的积极性,从而影响了虎斑乌贼规模化养殖的推广[6,7].目前,有关虎斑乌贼的研究主要集中在繁殖行为谱分析[8]、受精卵及胚胎发育[9,10,11]、生态环境因子[11,12]以及营养成分分析等[13,14,15,16],迄今为止鲜有关于虎斑乌贼喷墨的研究报道.喷墨是否会对虎斑乌贼造成损伤,这是虎斑乌贼养殖过程中亟待解决的一个问题.
为了探究喷墨对虎斑乌贼自身的影响,本研究采用单因子试验法,通过对虎斑乌贼养殖过程中相关生化指标的对比分析,从生理代谢角度探讨喷墨对虎斑乌贼生长及存活的影响.

1 、材料与方法
1.1、 试验材料
本试验于2019年4月至7月在浙江省宁波市象山来发水产育苗场进行,所用乌贼个体均为宁波大学蒋霞敏课题组人工孵化所得,孵化用的虎斑乌贼亲体捕自广东湛江海域(19°~20°N,111°~112°E),在当地育苗场产卵,分批用尼龙袋充氧运输至象山来发水产育苗场水泥池(4 m×8 m×1.5 m)进行孵化.孵化培育条件为:水温24~26℃,盐度24~27,pH 7.5~8.5,溶氧量≥6.00 mg·L-1.虎斑乌贼孵化后5 d内投喂卤虫(Artemia salina)幼体,5 d后投喂活体糠虾(Acanthomysis sp.).试验选同一批卵、同一时间孵化、规格整齐、活力好、健康的虎斑乌贼(胴长(2.67±0.01)cm,体质量(2.87±0.05)g).试验采用自然海水,经暗沉淀和沙滤,海水温度24~24.5℃,盐度23.8~24.5,pH 7.5~7.8.
1.2、 试验方法
试验设置对照组与喷墨组,对照组为正常养殖的虎斑乌贼,喷墨组为喷墨后的虎斑乌贼.喷墨组处理方法为:用网兜(直径9 cm)捞起虎斑乌贼放入盛有自然海水的泡沫箱中,同时用网兜置于虎斑乌贼正前方(距离虎斑乌贼10~15 cm)驱赶,以此模拟其受到敌害攻击或竞争者,在此过程中虎斑乌贼会通过压缩内腔喷水/喷墨提供动力,这一过程伴有大量墨汁喷出,会持续30~60 s,直至虎斑乌贼不再喷墨.喷墨处理后,将对照组与喷墨组虎斑乌贼同时放入蓝色塑料圆桶(内径0.88 m,高0.77 m)养殖.对照组与喷墨组各设3组平行,每平行为一个蓝色塑料圆桶,放置20只虎斑乌贼.对照组与喷墨组的养殖条件相同:用水为沙滤的天然海水,水深0.6 m,水温24~24.5℃,盐度23.8~24.5,pH 7.5~7.8,24 h持续充气.投饵种类为活体糠虾,每日投喂2次,投喂量为体质量的15%,隔天换水1次,换水量为总水量的80%,添加等盐、等温的沙滤海水,试验周期30 d.养殖试验开始时,每隔10 d测量虎斑乌贼的体质量和胴长,并检查、记录死亡个体数量.
1.3、 测定指标及方法
1.3.1、 生长指标的计算公式
式中:WWGR为增重率;W0为试验开始时虎斑乌贼的初始体质量,g;Wt为试验结束时虎斑乌贼体质量,g;SSGR为特定生长率;T为养殖周期,d;SSR为存活率;Nt为试验结束时虎斑乌贼存活数量;N0为试验开始时虎斑乌贼数量.
1.3.2、 代谢及抗氧化酶活性的测定
喷墨处理1 h后,对照组和试验组在每平行组中各取5只乌贼进行肝脏取样,取样后迅速置于液氮中保存,放于-80℃冰箱中待测酶活力.测试酶活力的试剂盒购自南京建成生物工程研究所.测定的抗氧化指标有:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽(GSH)和丙二醛(MDA);代谢酶有酸性磷酸酶(ACP)、谷丙转氨酶(GPT)和乳酸脱氢酶(LDH).
对肝脏样本进行处理.制备10%的匀浆液:称取0.1 g的虎斑乌贼肝脏,按照肝脏(g):生理盐水(mL)=1:9混合,在冰水浴下离心匀浆,取上清液按照试剂盒说明书配置试剂,然后按说明书步骤进行混合反应,最后使用光度计或酶标仪选定波长后测定反应溶液的吸光度.
1.4、 数据处理
数据采用SPSS 19.0软件进行统计分析,采用单因素方差分析法进行比较,用Turkey’s检验法进行多重差异性分析,P<0.05认为组间有显着性差异.统计数据采用平均数±标准误差表示.
2、 结果与分析
2.1、 虎斑乌贼喷墨组与对照组行为比较
虎斑乌贼喷墨前后其行为表现呈现较大差异(图1),喷墨组的虎斑乌贼在喷墨后体色泛白,腕目向外屈张,部分浮于水面无法下沉,活力明显下降,反应迟钝,严重的直接死亡;而对照组的虎斑乌贼反应正常,鳍摆动频率幅度较快,体色呈红褐色或变为环境的颜色,腕目聚拢,四处游动后均静息于水底.
图1 虎斑乌贼喷墨前后行为比较

2.2 、虎斑乌贼喷墨组与对照组生长和存活比较
对喷墨后的虎斑乌贼和对照组虎斑乌贼进行为期30 d的养殖试验,其生长和存活结果见表1从表1可知,虎斑乌贼喷墨后对其生长和存活影响显着(P<0.05),对照组虎斑乌贼的存活率、增重率和特定生长率均显着高于喷墨组(P<0.05),分别高出23.33%、13.80%和0.45%·d-1.
表1 虎斑乌贼喷墨后对其生长及存活的影响
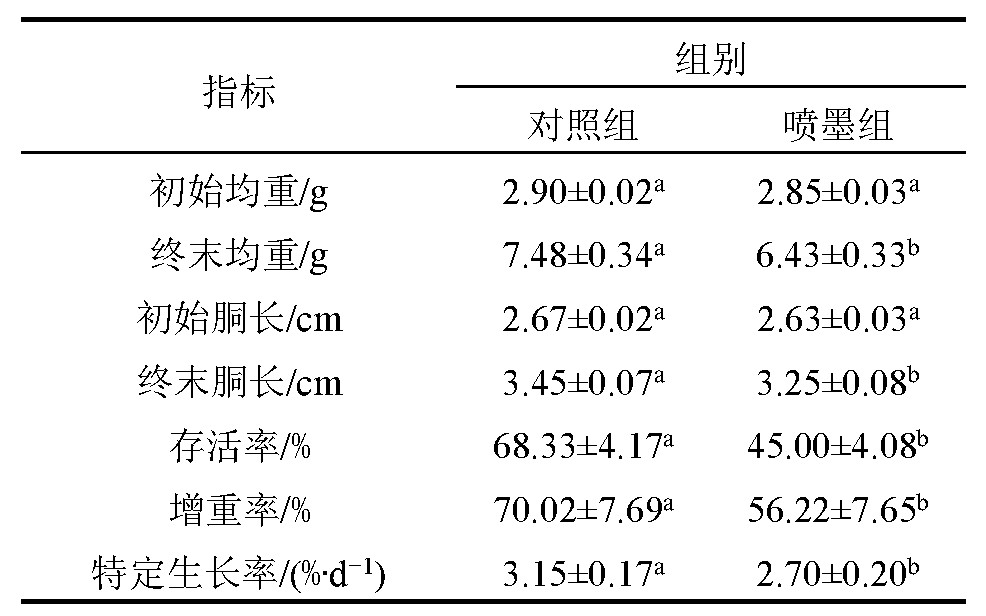
注:同行数据中上标字母不同表示差异显着(P<0.05),下同.
虎斑乌贼存活率随养殖时间的变化结果如图2所示.从图2可知,对照组和喷墨组的虎斑乌贼存活率虽随养殖时间延长而逐渐缩小,但喷墨组的虎斑乌贼存活率始终低于对照组(P<0.05),尤其在养殖时间≤5 d,喷墨组虎斑乌贼的存活率下降迅速,养殖5 d时存活率为71.67%,而对照组的存活率为95%.试验结束时(30 d)喷墨组虎斑乌贼的存活率为46.67%,对照组为68.33%.
图2 2组虎斑乌贼存活率随养殖时间的变化
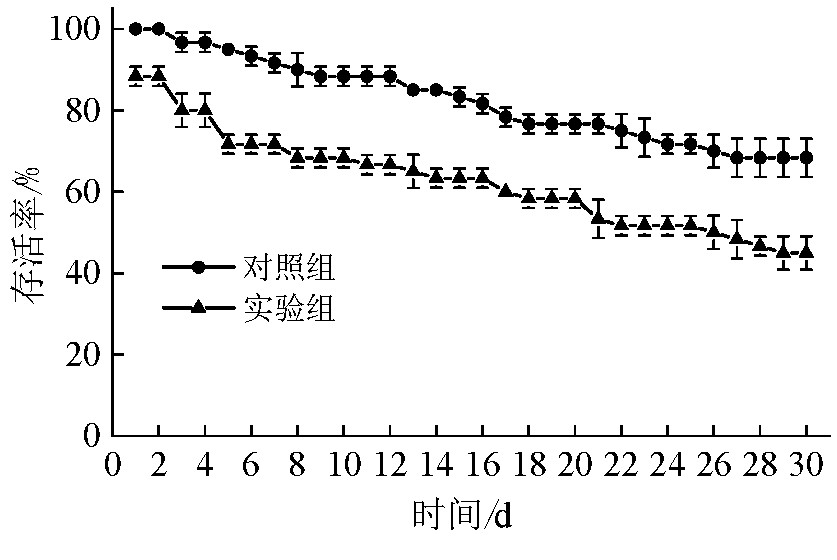
图3为以10 d作为一个阶段,在试验期间2组虎斑乌贼的增重率随时间的变化结果.从图3可发现,对照组和喷墨组虎斑乌贼的增重率随养殖时间的延长而逐渐减小.在开始养殖10 d里,对照组和喷墨组虎斑乌贼的增重率有显着差异(P<0.05),对照组比喷墨组高出13.80%;但在养殖11~20 d及21~30 d阶段,2组虎斑乌贼的增重率无显着差异(P<0.05).
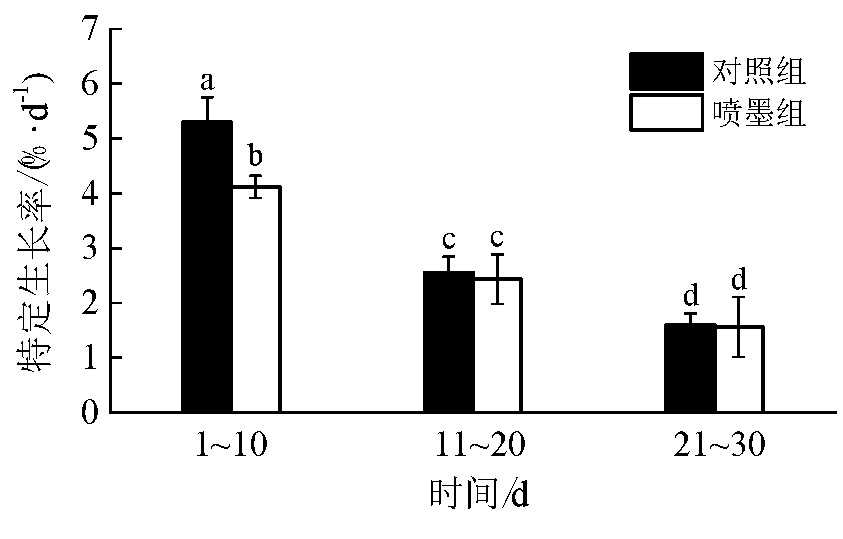
图4为以10 d作为一个阶段,在试验期间2组虎斑乌贼的特定生长率随时间的变化结果.从图4可发现,对照组和喷墨组虎斑乌贼的特定生长率同样随养殖时间的延长而逐渐减小.在开始养殖10 d里,对照组和喷墨组虎斑乌贼的特定生长率有显着差异(P<0.05),对照组比喷墨组高出1.18%·d-1但在养殖11~20 d及21~30 d阶段,2组的特定生长率无显着差异(P>0.05).
图3 2组虎斑乌贼的增重率随养殖时间的变化
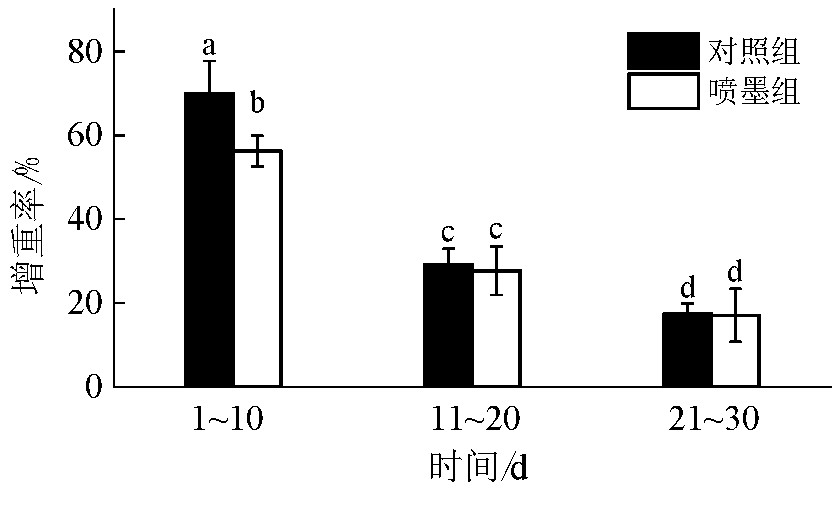
图4 2组虎斑乌贼特定生长率随养殖时间的变化
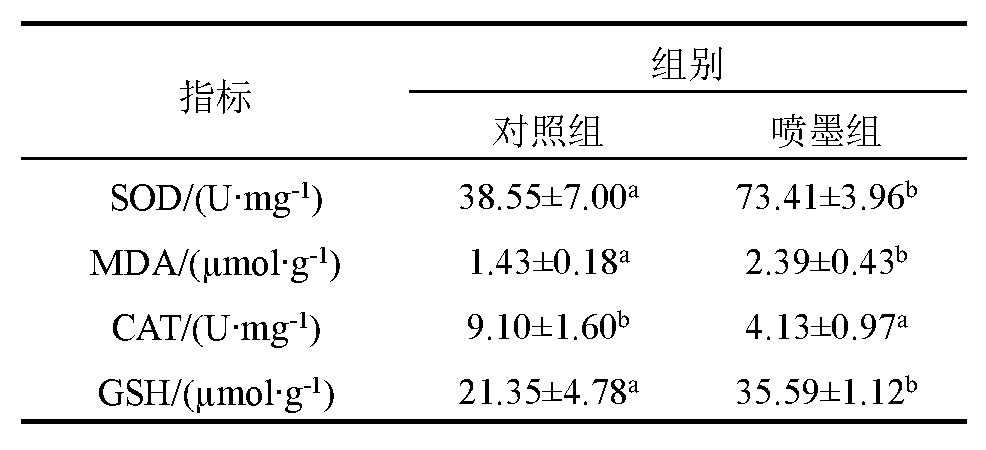
2.3、虎斑乌贼喷墨组与对照组抗氧化酶活性比较
虎斑乌贼喷墨对其抗氧化酶活性的影响结果见表2.从表2可看出,喷墨组肝脏中SOD、MDA和GSH含量均显着高于对照组(P<0.05),尤其是SOD含量,喷墨组为73.41%,对照组为38.55%,前者是后者的1.9倍;但喷墨组CAT却显着低于对照组(P<0.05).
表2 虎斑乌贼喷墨后对其抗氧化酶活性的影响
2.4、 虎斑乌贼喷墨组与对照组代谢酶活性比较
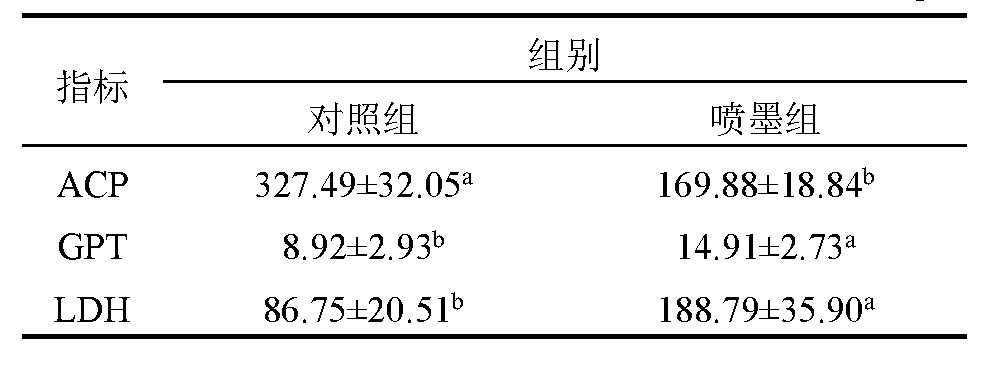
虎斑乌贼喷墨对其肝脏中的代谢酶活性的影响见表3.从表3可知,喷墨组的虎斑乌贼代谢酶GPT和LDH活性均显着高于对照组(P<0.05),但ACP活性却显着低于对照组(P<0.05).
表3 虎斑乌贼喷墨后对其代谢酶活的影响
3 、讨论
3.1、 虎斑乌贼喷墨对其行为、生长和存活的影响
虎斑乌贼在自然条件下受到刺激或为躲避敌害会喷墨,从而起到混乱视野,躲避敌害的作用.也有报道[17],虎斑乌贼喷墨可用于捕食或警醒同类.同样,虎斑乌贼在受到外界刺激时,因具有墨囊也会喷射墨汁[18].造成虎斑乌贼喷墨的外界原因众多,例如当虎斑乌贼突然暴露在强光照环境(≥4 000 lx)下,表现出强烈的应激反应,背部体色变深,甚至出现喷墨现象[19];而将虎斑乌贼放置到低温(≤18℃)和高温(≥34℃)环境下,虎斑乌贼会表现出体色变白,极度躁动不安,进而大量喷墨后死亡[20].在实际养殖过程中,虎斑乌贼会因降雨量大而发生喷墨,并出现死亡现象.同时,在长时间的运输过程中虎斑乌贼也容易发生喷墨,导致整个包装袋内虎斑乌贼的死亡.综上可知,虎斑乌贼往往会因为环境的不适而出现大量喷墨.为了探究喷墨是否会对虎斑乌贼自身产生影响,本试验对比了虎斑乌贼喷墨前后发生的变化,发现虎斑乌贼喷墨导致其体色明显泛白,活力下降,反应迟钝,试验中对照组的存活率比喷墨组高出23.33%,表明虎斑乌贼喷墨后会造成其养殖存活率下降,因此在养殖或运输过程中应尽可能避免虎斑乌贼发生喷墨.试验同时发现,即使虎斑乌贼在喷墨后能够存活,其生长也会受到影响,对照组的特定生长率和增重率均明显高于喷墨组(P<0.05).对照组特定生长率为3.15%·d-1,喷墨组为2.70%·d-1;对照组增重率为70.02%,喷墨组为56.22%;表明虎斑乌贼喷墨后会阻碍其自身的生长.
通过阶段性的养殖研究发现,在虎斑乌贼喷墨后的前10 d,其特定生长率和增重率均明显低于对照组(P<0.05),但随着养殖时间的延长,对照组和喷墨组的特定生长率和增重率均无显着差异(P>0.05).因此,推测虎斑乌贼在喷墨后,可能优先把大部分的营养用于墨的合成,致使自身的生长受到抑制,而在合成一定量墨后,才逐渐将摄入的营养用于生长,导致虎斑乌贼在喷墨后的一段时间内其生长速率远落后于未喷墨虎斑乌贼,但具体影响生长过程的机制尚需进一步研究.
3.2、 虎斑乌贼喷墨对其抗氧化酶活性的影响
在生物体内抗氧化系统与自由基之间的动态平衡是保证生物体自身稳定的重要因素之一[21].生物体内主要的抗氧化酶包括SOD、CAT、谷胱甘肽-S-转移酶(GST)以及谷胱甘肽过氧化物酶(GPX)等[22],这些酶活性的高低直接反映机体的抗氧化能力.部分非酶抗氧化物也会参与生物的抗氧化体系,例如GSH可作为GST与GPX的底物间接反映机体的抗氧化能力.但过多的自由基会损伤机体,其会与生物大分子反应,从而破坏生物大分子的结构和功能[23].MDA作为脂质过氧化的应激产物,能与含氮生物大分子结合,破坏细胞膜结构,使动物组织硬化[24],其含量的高低则可以反映机体的受损程度.试验结果表明,喷墨后虎斑乌贼肝脏中的MDA含量显着升高(P<0.05),同时喷墨组虎斑乌贼肝脏中的SOD酶活性和GSH含量也显着高于对照组(P<0.05),但CAT酶活性却受到抑制.因此,推测这可能是虎斑乌贼在喷墨后导致体内产生大量的MDA,同时引起体内的抗氧化酶活化.虽然肝脏中的MDA可通过抗氧化系统被代谢,但这些代谢作用较有限,过量的MDA会危害机体,从而导致部分酶受到抑制[25].已有报道表明[26],乌贼墨中含有的多肽、黑色素、多糖等都具有一定的抗氧化活性.因此,虎斑乌贼在喷墨后其抗氧化能力会随之减弱,体内的自由基与抗氧化系统的平衡可能会被打破,其自由基的暂时失衡是否会导致虎斑乌贼存活率的下降还有待进一步研究.
3.3、 虎斑乌贼喷墨对其代谢酶活性的影响
ACP不仅参与生物体内的解毒过程,而且是生物体内重要的营养代谢酶,在磷化物和一些营养物质的消化、吸收和转运过程中起着重要作用[27]本试验结果发现,对照组的ACP酶活性要显着高于喷墨组(P<0.05),表明虎斑乌贼喷墨后会抑制ACP活性,从而可能会暂时影响机体对营养物质的消化吸收.GPT广泛存在于动物组织细胞线粒体内,是一种重要的氨基转移酶,在机体蛋白质代谢中起着重要作用,其活性高低可以在一定程度上反映机体氨基的蛋白代谢能力[28].在本试验中,喷墨组的GPT显着高于对照组(P<0.05),表明虎斑乌贼在喷墨后对其蛋白质代谢有一定的增强作用推测这可能是因为虎斑乌贼墨主要由蛋白质和黑色素组成[29],当虎斑乌贼喷墨后,机体需要合成损失的墨,导致机体对蛋白的需求量增加,从而激活了GPT酶活性.LDH是丙酮酸在无氧条件下进行无氧代谢生成乳酸的关键酶[30],当生物受环境胁迫时其体内需要大量能量,有氧代谢已无法满足机体能量需求,因而需要通过无氧代谢来满足.所以,机体内LDH活性能够反映机体的能量代谢情况.在本试验中,喷墨组LDH活性显着高于对照组(P<0.05),说明虎斑乌贼喷墨需要消耗大量能量其无氧代谢旺盛,体内聚集了大量乳酸,从而影响机体内的酸碱平衡,对组织产生一定损伤.
4、 结论
虎斑乌贼喷墨会导致其体色泛白、活力下降并暂时打破肝脏中自由基与抗氧化系统的平衡,同时会消耗大量能量以及影响相关代谢酶的活性在养殖10 d里,喷墨组虎斑乌贼的存活率、增重率和特定生长率较对照组均出现显着下降(P<0.05).
参考文献
[1]张玺,齐钟彦,董正之,等.中国沿岸的十腕目(头足纲)[J].海洋与湖沼, 1960(3):188-204; 230.
[2] Sasaki J I, Ishita K, Takaya Y, et al. Anti-tumor activity of squid ink[J]. Journal of Nutritional Science and Vitaminology, 1997, 43(4):455-461.
[3]陈新军,刘必林,王尧耕.世界头足类[M].北京:海洋出版社, 2009:450-451.
[4] Gabr H R, Hanlon R T, Hanafy M H, et al. Maturation,fecundity and seasonality of reproduction of two commercially valuable cuttlefish, Sepia pharaonis and S.dollfusi, in the Suez Canal[J]. Fisheries Research, 1998,36(2/3):99-115.
[5]李建平,蒋霞敏,赵晨曦,等.虎斑乌贼室内规模化养殖技术研究[J].生物学杂志, 2019, 36(2):68-72.
[6] Wen J, Zhong H, Xiao J, et al. A transcriptome resource for pharaoh cuttlefish(Sepia pharaonis)after ink ejection by brief pressing[J]. Marine Genomics, 2016, 28:53-56.
[7] Barord G J, Keister K N, Lee P G. Determining the effects of stocking density and temperature on growth and food consumption in the pharaoh cuttlefish, Sepia pharaonis, Ehrenberg 1890[J]. Aquaculture International,2010, 18(3):271-283.
[8]陈道海,郑亚龙.虎斑乌贼(Sepia pharaonis)繁殖行为谱分析[J].海洋与湖沼, 2013, 44(4):931-936.
[9]陈道海,王雁,梁汉青,等.虎斑乌贼(Sepia pharaonis)胚胎发育及孵化历期观察[J].海洋与湖沼, 2012, 43(2):394-400.
[10]全成,莫金凤,周萌,等. 3种环境因子对虎斑乌贼受精卵孵化的影响[J].仲恺农业工程学院学报, 2019,32(3):6-9.
[11]全成.环境因子对虎斑乌贼胚胎发育影响及海螵蛸止血效果研究[D].广州:仲恺农业工程学院, 2018.
[12] Nabhitabhata J. Double eggs of pharaoh cuttlefish, Sepia pharaonis Ehrenberg, 1831[J]. Veliger Berkeley, 2003,46(1):97-98.
[13]文菁,曹观蓉,李施颖,等.环境因子对虎斑乌贼幼体存活率及行为的影响[J].水产科学, 2011, 30(6):321-324.
[14]高晓兰,蒋霞敏,乐可鑫,等.野生虎斑乌贼不同组织营养成分分析及评价[J].动物营养学报, 2014, 26(12):3858-3867.
[15]彭瑞冰,乐可鑫,蒋霞敏,等.虎斑乌贼受精卵卵黄营养成分分析[J].水产学报, 2015, 39(7):1034-1042.
[16]江茂旺,蒋霞敏,梁晶晶,等.不同生长时期虎斑乌贼内壳营养成分含量分析比较[J].动物营养学报, 2016,28(7):2300-2308.
[17] Sato N, Takeshita F, Fujiwara E, et al. Japanese pygmy squid(Idiosepius paradoxus)use ink for predation as well as for defence[J]. Marine Biology, 2016, 163(3):56.
[18] Anil M, Andrews J, Unnikrishnan C. Growth, behavior,and mating of Pharaoh cuttlefish(Sepia pharaonis Ehrenberg)in captivity[J]. Israeli Journal of AquacultureBamidgeh, 2005, 57(1):25-31.
[19]刘建勇,许光林,简润超,等.温度对虎斑乌贼受精卵孵化及幼体存活的影响[J].广东海洋大学学报, 2010,30(6):87-90.
[20]周爽男,陈奇成,江茂旺,等.光照强度对虎斑乌贼生长、存活、代谢及相关酶活性的影响[J].应用生态学报, 2019, 30(6):2072-2078.
[21] Rangasamy T, Cho C Y, Thimmulappa R K, et al. Genetic ablation of Nrf2 enhances susceptibility to cigarette smoke-induced emphysema in mice[J]. Journal of Clinical Investigation, 2004, 114(9):1248-1259.
[22]景奕文,杨最素,丁国芳,等.乌贼墨多肽体外抗氧化活性研究[J].安徽农业科学, 2013, 41(27):10971-10973; 11025.
[23]李慧,杨林. Nrf2抗氧化的分子调控机制[J].生物信息学, 2018, 16(1):1-6.
[24] Esterbauer H, Schaur R J, Zollner H. Chemistry and biochemistry of 4-hydroxynonenal, malonaldehyde and related aldehydes[J]. Free Radical Biology and Medicine,1991, 11(1):81-128.
[25]李莉,陈菁菁,李方序,等.氧应激毒性产物丙二醛(MDA)对小鼠体能的影响及其体内代谢[J].湖南师范大学自然科学学报, 2006, 29(2):97-101.
[26] Le X Y, Luo P, Gu Y P, et al. Squid ink polysaccharide reduces cyclophosphamide-induced testicular damage via Nrf2/ARE activation pathway in mice[J]. Iranian Journal of Basic Medical Sciences, 2015, 18(8):827-831.
[27] Egnatchik R A, Leamy A K, Sacco S A, et al. Glutamateoxaloacetate transaminase activity promotes palmitate lipotoxicity in rat hepatocytes by enhancing anaplerosis and citric acid cycle flux[J]. Journal of Biological Chemistry, 2019, 294(9):3081-3090.
[28]何海琪,孙凤.中国对虾酸性和碱性磷酸酶的特性研究[J].海洋与湖沼, 1992, 23(5):555-560.
[29]江茂旺,蒋霞敏,高晓兰,等.野生与人工养殖虎斑乌贼墨的生化组分分析与比较[J].生物学杂志, 2016,33(4):29-33.
[30] Markert C L. Lactate dehydrogenase. Biochemistry and function of lactate dehydrogenase[J]. Cell Biochemistry and Function, 1984, 2(3):131-134.





