摘要:目的 探讨超声造影 (CEUS) 在肝硬化结节恶变筛查中的价值。方法 回顾性分析2012年1月至2016年12月中山大学附属第三医院行超声检查随访的25例患者临床资料。患者均签署知情同意书, 符合医学伦理学规定。患者均为男性;年龄3382岁, 中位年龄55岁;共29个肝硬化结节。所有患者均接受规律的超声检查随访, 均接受常规超声和CEUS检查, 记录结节的直径、内部血流信号、超声造影增强模式等。结节直径比较采用t检验, 超声造影模式比较采用Fisher确切概率法, 诊断试验采用受试者工作特征 (ROC) 曲线。结果 随访过程中, 14个肝硬化结节恶变为肝细胞癌 (肝癌) 。发生恶变的结节直径 (19±8) mm较恶变前 (16±7) mm明显增大 (t=2.682, P<0.05) 。随着结节恶变, 结节CEUS动脉期逐渐由等增强 (12/14) 转变为高增强 (13/14) , 门静脉期/延迟期由等增强 (13/14) 转变为低增强 (13/14) , 差异有统计学意义 (P<0.05) 。AFP、常规超声、CEUS诊断肝硬化结节恶变的曲线下面积分别为0.607、0.679、1, 差异有统计学意义 (Z=4.837, 6.904;P<0.05) 。结论 在肝硬化结节的连续随访过程中, CEUS能早期发现恶变结节内部血流动力学变化, 较常规超声具有更好的诊断价值。
关键词:癌, 肝细胞; 肝硬化结节; 随访研究; 超声检查; 血流动力学;
Abstract:Objective To explore the value of contrast-enhanced ultrasonography (CEUS) in the screening of malignant transformation from cirrhotic nodules. Methods Clinical data of 25 patients who were followed up by ultrasonography in the Third Affiliated Hospital of Sun Yat-sen University from January 2012 to December 2016 were analyzed retrospectively. The informed consents of all patients were obtained and the local ethical committee approval was received. All patients were males, aged 33-82 years old, with the median age of 55 years old, and with a total of 29 cirrhotic nodules. All patients were followed up regularly by ultrasonography which included conventional ultrasound and CEUS. The diameter, internal blood flow signal and CEUS features of the nodules were recorded. The diameter was compared by t test, and the CEUS features by Fisher's exact probability test. ROC curve was used for diagnostic test. Results During the follow-up, 14 cirrhotic nodules turned into hepatocellular carcinoma (HCC) . The diameter of malignant nodule (19± 8) mm was significantly higher than (16±7) mm before malignant change (t=2.682, P<0.05) . As the nodules transformed to malignancy, in the arterial phase of CEUS, signals changed gradually from equal enhancement (12/14) to hyper enhancement (13/14) , and in the portal venous phase or delayed phase, it changed from equal enhancement (13/14) to low enhancement (13/14) , where significant difference was observed (P<0.05) . The area under the curve of AFP, conventional ultrasound and CEUS in diagnosing malignancy of cirrhotic nodules was 0.607, 0.679 and 1, respectively, where significant differences were observed (Z=4.837, 6.904, P<0.05) . Conclusion In the continuous follow-up of cirrhotic nodules, CEUS can detect the hemodynamic changes in malignant nodules early, which has better diagnostic value than conventional ultrasound.
Keyword:Carcinoma, hepatocellular; Cirrhotic nodule; Follow-up studies; Ultrasonography; Hemodynamic;
早期肝细胞癌 (肝癌) 可获得根治性治疗机会, 如局部消融治疗5年生存率达76%, 手术切除5年生存率可高达81%[1-2]。因此, 早期发现肝癌尤为重要。超声检查随访监测能早期发现肝癌, 提高肝癌患者根治性治疗机会[3-4]。然而, 常规超声检查 (conventional ultrasound, CUS) 易受诸多因素的影响, 敏感度有限[5]。超声造影 (contrast enhanced ultrasound, CEUS) 是近年来发展兴起的超声新技术, 可以实时显示组织的血流灌注, 赋予超声类似CT/MRI的增强显像功能[6]。连续动态观察肝硬化结节改变的CEUS表现, 总结其声像图变化特征有助于早期发现、早期诊断肝癌, 从而增加肝癌患者根治性治疗的机会, 提高患者生存率。
资料与方法
一、一般资料
回顾性分析2012年1月至2016年12月中山大学附属第三医院行超声检查随访的25例患者临床资料。所有患者均签署由医院伦理委员会批准的患者知情同意书, 符合医学伦理学规定。患者均为男性;年龄33~82岁, 中位年龄55岁;共29个肝硬化结节, 4例患者肝内分别可探及2个肝硬化结节。入选标准:所有患者在入组时均进行增强CT/MRI排除肝癌。
肝癌的诊断标准参照美国肝病研究学会 (American Association for Study of Liver Disease, AASLD) 2011版, 符合以下2项中的1项即可: (1) 病理结果提示为肝癌; (2) 如果肝脏肿块直径≥1 cm, 增强CT或增强MRI中有1项显示肝脏占位具有肝癌典型影像学特征。
二、仪器与方法
超声检查采用美国GE E9、德国Siemens S3000等超声仪器, 腹部凸阵探头, 频率为3.5~5.0 MHz。超声造影剂为Sonovue (意大利Bracco公司) , 每次注射1.5~2.4 ml, 经肘静脉团注。CUS确认肝硬化结节后, 进入超声造影模式观察。
CUS图像主要分析结节的直径、回声、血流信号等二维超声特征。CEUS图像主要分析结节的增强模式, 注射超声造影剂后0~30 s为动脉期, 31~120 s为门静脉期, 120 s以后为延迟期。在随访过程中, 结节动脉灌注增加定义为后一个随访时间点相对于上一个随访时间点, CEUS动脉期由等/低增强转变为高增强;门静脉灌注减退则定义为门静脉期/延迟期由上一个随访时间点的等增强转变为下一个随访时间点的低增强。
三、随访方案
每3~6个月随访一次, 随访时进行血生化、CUS和CEUS检查。怀疑结节发生恶变的标准:结节最大径增大≥5 mm、结节的回声发生变化、结节内探及动脉血流信号以及AFP升高。CEUS检查怀疑结节发生恶变的标准:结节动脉灌注增加, 门静脉灌注减退。一旦出现以上某一项可疑征象或研究结束时, 则进行增强CT/MRI检查确认结节的状态。
四、统计学方法
采用SPSS 20.0统计软件进行数据分析。结节直径等正态分布数据以±s表示。两组比较采用t检验。结节回声分类、CEUS模式比较采用Fisher确切概率法。诊断试验采用受试者工作特征 (ROC) 曲线, 分别以AFP、CUS及CEUS检查诊断结节恶变, 绘制ROC曲线, 比较ROC曲线下面积。以P<0.05为差异有统计学意义。
结果
一、肝硬化结节随访情况
根据AASLD 2011肝癌诊断标准, 在随访过程中有14个结节发生恶变 (恶变组) 。恶变结节临床确诊7个, 病理学检查确诊7个;其余15个结节经CT/MRI证实未发生恶变 (非恶变组) 。恶变组平均年龄 (57±11) 岁;随访时间2~40个月, 中位时间13个月;4例患者AFP>20μg/L。非恶变组年龄为 (54±13) 岁;随访时间4~21个月, 中位时间10个月;AFP正常。
二、CUS征象动态演变过程
发生恶变的结节恶变后直径较恶变前增大 (P<0.05) , 而在随访过程中未发生恶变的结节, 直径无明显改变 (P>0.05) 。随访过程中, 结节的回声与结节是否发生恶变无关 (P>0.05) , 大部分结节内部难以探测到动脉血流信号 (表1) 。
三、CEUS征象动态演变
29个结节在随访过程中均进行CEUS检查, 随着结节发生恶变, 结节的动脉期由等增强逐渐转变为高增强, 门静脉期/延迟期由等增强逐渐转变为低增强 (图1) , 前后比较差异有统计学意义 (P<0.05) 。而对于未发生恶变的结节, CEUS增强模式无明显改变, 前后比较差异无统计学意义 (P>0.05, 表2) 。
四、临床、超声诊断肝硬化结节恶变的敏感度
绘制ROC曲线, AFP、CUS、CEUS怀疑肝硬化结节恶变的曲线下面积分别为0.607、0.679、1。曲线下面积进行两两比较, CUS与AFP比较差异无统计学意义 (Z=0.806, P>0.05) , CEUS与CUS比较差异有统计学意义 (Z=4.837, P<0.05) , CEUS与AFP比较差异有统计学意义 (Z=6.904, P<0.05;图2) 。
表1 恶变组和非恶变组肝硬化结节常规超声检查征象动态演变
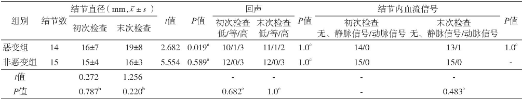
表2 恶变组和非恶变组肝硬化结节超声造影检查征象动态演变

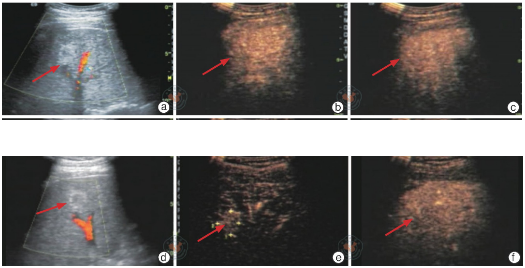
图1 肝硬化结节常规超声及超声造影图
注:a~c为肝硬化结节, 高回声结节最大径为17 mm, a为常规超声未见明显血流信号, b为超声造影动脉期呈等增强, c为延迟期呈等增强;d~f为恶变结节, 最大径为20 mm, d为常规超声未见明显血流信号, e为超声造影动脉期呈高增强, f为延迟期呈稍低增强
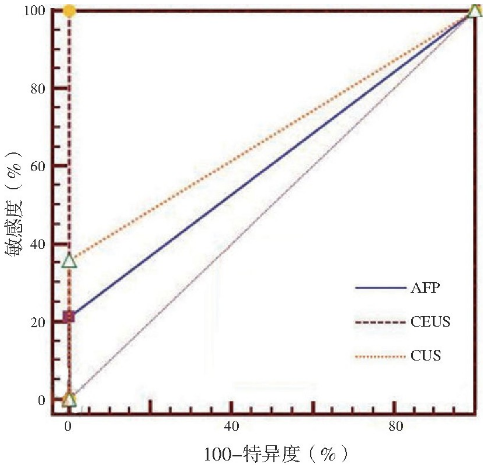
图2 AFP、CUS、CEUS诊断肝硬化结节恶变的ROC曲线
注:CUS为常规超声, CEUS为超声造影, ROC为受试者工作特征
讨论
肝癌的形成是一个多步骤、连续的过程, 从肝硬化再生结节、不典型增生结节, 最后发展成为肝癌[7-8]。在肝硬化结节癌变过程中, 影像学检查是随访监测的重要手段, 能直观、方便地监测结节的生长变化情况, 从而早期发现结节恶变[9-11]。
结节的直径变化是随访过程中提示结节恶变的重要征象。最新的肝脏影像报告和数据管理系统 (liver imaging reporting and data system, LI-RADS) 指出, 结节最大径增大超过5 mm提示结节可能发生恶变[12-13]。在本研究中, 虽然发生恶变的结节较恶变前有增大, 但有9个结节最大径的增大幅度并未超过5 mm。既往文献报道, 肝硬化结节先恶变为早期肝癌, 再恶变为侵袭性肝癌[14-15]。在恶变早期即早期肝癌阶段, 此时结节直径较恶变前尚未有明显的增大。因此对于连续随访的肝硬化结节, 特别在其恶变早期, 不能单纯通过结节的直径变化来判断结节是否恶变。
随访过程中, 本研究结果显示结节回声与结节是否发生恶变之间并无联系, 而且大部分发生恶变的结节回声并无改变。另外, 彩色多普勒超声显像诊断敏感度有限, 所以大部分结节内部未探及动脉血流信号。因此, CUS判断结节发生恶变存在一定的局限性[16]。临床血生化指标AFP是判断肝硬化结节发生恶变常用的标记物。然而, 在本研究中, 仅有4例患者AFP水平在结节发生恶变后升高超过20μg/L。这可能是因为研究中大部分肝癌发现时仍处于较早期的阶段, 此时AFP仍未有明显的升高, 或部分肝癌不导致AFP升高[17]。
通过静脉注射造影剂, CEUS检查可以更加敏感地观察结节内部血流动力学情况[18-20]。本研究中, 伴随结节恶变, 结节的动脉期增强模式由等增强转变为高增强, 门静脉期/延迟期则由等增强转变为低增强。已有研究认为, 结节恶变, 其正常动脉血供会减少, 异常肿瘤动脉血供会增加, 门静脉血供也会相应减少, 整体表现为动脉血供增加, 静脉血供减少[21]。因此随访过程中, 结节发生恶变后, 其动脉期增强水平会增加, 门静脉期/延迟期增强水平则会减退。
在本研究中, CEUS检查相对于CUS及AFP, 在结节恶变后且尚未有明显增大前能早期发现结节内部血流动力学变化, 从而提高肝硬化结节恶变的早期检出率。相对于CT/MRI, CEUS具有实时、方便、便宜等优势, 且造影剂无肝肾毒性, 更适合作为临床随访观察的手段, 特别是对于结节轻度增大, 即结节增大幅度不超过5 mm者, 不伴随回声改变或内部出现动脉血流信号者。
总之, 在肝硬化结节连续动态随访过程中, CEUS能早期发现恶变过程中结节内部血流动力学变化, 较CUS具有更好的诊断价值, 从而早期发现肝癌, 提高根治性治疗机会。
参考文献
[1]Mc Guire S.World Cancer Report 2014.Geneva, Switzerland:World Health Organization, International Agency for Research on Cancer, WHO Press, 2015[J].Adv Nutr, 2016, 7 (2) :418-419.
[2]Liu P, Hsu CY, Hsia CY, etal.Surgical resection versus radiofrequency ablation for single hepatocellular carcinoma≤2 cm in a propensity score model[J].Ann Surg, 2016, 263 (3) :538-545.
[3]Sato T, Tateishi R, Yoshida H, et al.Ultrasound surveillance for early detection of hepatocellular carcinoma among patients with chronic hepatitis C[J].Hepatol Int, 2009, 3 (4) :544-550.
[4]Zhang BH, Yang BH, Tang ZY.Randomized controlled trial of screening for hepatocellular carcinoma[J].J Cancer Res Clin Oncol, 2004, 130 (7) :417-422.
[5]Del Poggio P, Olmi S, Ciccarese F, et al.Factors that affect efficacy of ultrasound surveillance for early stage hepatocellular carcinoma in patients with cirrhosis[J].Clin Gastroenterol Hepatol, 2014, 12 (11) :1927-1933.
[6]Van Beers BE, Daire JL, Garteiser P.New imaging techniques for liver diseases[J].J Hepatol, 2015, 62 (3) :690-700.
[7]Kobayashi M, Ikeda K, Hosaka T, et al.Dysplastic nodules frequently develop into hepatocellular carcinoma in patients with chronic viral hepatitis and cirrhosis[J].Cancer, 2006, 106 (3) :636-647.
[8]Sato T, Kondo F, Ebara M, et al.Natural history of large regenerative nodules and dysplastic nodules in liver cirrhosis:28-year follow-up study[J].Hepatol Int, 2015, 9 (2) :330-336.
[9]Wu S, Tu R, Liu G, et al.Dynamic changes in ultrasound characteristics of nodules in cirrhotic liver and their implications in surveillance for malignancy[J].J Med Ultrason, 2014, 41 (2) :165-171.
[10]Bruix J, Sherman M, American Association for the Study of Liver Diseases.Management of hepatocellular carcinoma:an update[J].Hepatology, 2011, 53 (3) :1020-1022.
[11]European Association For the Study of the Liver, European Organisation for Research and Treatment of Cancer.EASL-EORTCclinical practice guidelines:management of hepatocellular carcinoma[J].J Hepatol, 2012, 56 (4) :908-943.
[12]An C, Rakhmonova G, Choi JY, et al.Liver imaging reporting and data system (LI-RADS) version 2014:understanding and application of the diagnostic algorithm[J].Clin Mol Hepatol, 2016, 22 (2) :296-307.
[13]Fraum TJ, Tsai R, Rohe E, et al.Differentiation of hepatocellular carcinoma from other hepatic malignancies in patients at risk:diagnostic performance of the liver imaging reporting and data system version 2014[J].Radiology, 2018, 286 (1) :158-172.
[14]International Consensus Group for Hepatocellular Neoplasia.Pathologic diagnosis of early hepatocellular carcinoma:a report of the international consensus group for hepatocellular neoplasia[J].Hepatology, 2009, 49 (2) :658-664.
[15]Ojima H, Masugi Y, Tsujikawa H, et al.Early hepatocellular carcinoma with high-grade atypia in small vaguely nodular lesions[J].Cancer Sci, 2016, 107 (4) :543-550.
[16]Boas FE, Do B, Louie JD, et al.Optimal imaging surveillance schedules after liver-directed therapy for hepatocellular carcinoma[J].J Vasc Interv Radiol, 2015, 26 (1) :69-73.
[17]Lin XJ, Chong Y, Guo ZW, et al.A serum micro RNA classifier for early detection of hepatocellular carcinoma:a multicentre, retrospective, longitudinal biomarker identification study with a nested case-control study[J].Lancet Oncol, 2015, 16 (7) :804-815.
[18]Shin SK, Kim YS, Choi SJ, et al.Contrast-enhanced ultrasound for the differentiation of small atypical hepatocellular carcinomas from dysplastic nodules in cirrhosis[J].Dig Liver Dis, 2015, 47 (9) :775-782.
[19]Terzi E, Iavarone M, Pompili M, et al.Contrast ultrasound LI-RADSLR-5 identifies hepatocellular carcinoma in cirrhosis in a multicenter restropective study of 1, 006 nodules[J].J Hepatol, 2018, 68 (3) :485-492.
[20]Claudon M, Dietrich CF, Choi BI, et al.Guidelines and good clinical practice recommendations for Contrast Enhanced Ultrasound (CEUS) in the liver-update 2012:a WFUMB-EFSUMB initiative in cooperation with representatives of AFSUMB, AIUM, ASUM, FLAUS and ICUS[J].Ultrasound Med Biol, 2013, 39 (2) :187-210.
[21]Wang YC, Chou CT, Lin CP, et al.The value of Gd-EOB-DTPA-enhanced MR imaging in characterizing cirrhotic nodules with atypical enhancement on Gd-DTPA-enhanced MR images[J].PLo SOne, 2017, 12 (3) :e0174594.





