前言由于大鼠肝脏各叶彼此分开,各叶肝蒂游离于肝外,肝叶比重相对固定,方便进行各种比例的肝部分切除。肝部分切除模型主要应用于肝脏肿瘤、肝再生、急慢性肝衰竭以及肝移植等模型的研究。理想的急性肝衰竭动物应具有①可逆性:肝衰竭有潜在的可逆性,适当的方法可以治疗并能长期存活;②可重复性:肝损伤模型的制备可以重复,并应具有相同的病死率和较相似的指标;③死于肝衰竭:肝损伤动物模型最终应死于肝衰竭;④治疗窗口期:由发生肝衰竭到死亡应具有足够的时间,以进行适当的治疗;⑤大型动物;⑥对环境和实验人员危害最小。随着干细胞治疗肝损伤及护肝药物研究的发展,对大鼠肝损伤模型也提出了很多新的要求。本实验拟在肝部分切除术的基础上对模型鼠进行改进,并行细胞移植实验,对比分析新模型的优劣。
1 材料与方法
1.1 材料
1.1.1 实验动物 F344 大鼠 由上海 Slack 实验动物中心提供,由第四军医大学动物中心实验动物房饲养。
1.1.2 材料 动物手术台、手术显微镜(OPMI,德国)、高频电刀、无损伤血管夹、小儿硬膜外导管(内径约 0 .7 mm),止血钳等常规手术器械、肝素钠、盐水、全自动生化分析仪(日立 7170型,日本)。第三代构建 GFP 示踪的胎肝干细胞(本课题组三步分离法制备),20 % 胎牛血清(Hyclone,USA),胰蛋白酶(Gib-co 公司,USA),Williams’E 培养基(Sigma 公司 USA)。
1.2 方法
1.2.1 模型制备 ⑴一次性硬膜外导管制备测孔,并用 50 U/ml肝素钠注射液肝素化。大鼠术前禁食 12 小时、禁水 4 小时。10%水合氯醛(3 ml/kg)腹腔内注射麻醉,将麻醉后固定于实验台上,备皮、消毒, ⑵60 只大鼠分为三组,A 组:对照组;B 组:经门静脉途径注射治疗组;C 组:经肝断面门静脉分支残端置管治疗组。取上腹部剑突下正中切口, 长约 5 cm,进入腹腔,A、B组大鼠依次行 85 %肝切除术(切除肝左外叶、肝中叶、右上叶,保留右下叶、尾叶)。C 组大鼠找到进入肝左外叶 Glisson 鞘系统的门静脉,用无损伤血管夹分别夹闭其近心端和远心端,3-0 丝线结扎肝叶静脉后,向肝左外叶方向完全游离长约 1 cm左右的血管,血管下穿过两根 3-0 丝线。静脉全层剪一“V”形小口,将硬膜外导管沿切口缓慢送入静脉;轻轻放开近心端血管夹,将导管方向向下置入 2 cm,回抽有血后固定,结扎 Glisson鞘,切断肝左外叶,切除肝中叶、右上叶。导管固定腹壁沿皮下自颈后部穿出,连接接头、肝素帽。
1.2.2 干细胞植入及肝功能检查 术中 B 组即经门静脉穿刺注入 4×105个表达 GFP 的胎肝干细胞(FLSPCs)。C 组经留置管注射入同等量的 FLSPCs,A 组经门静脉注射同等剂量的培养液。72 小时取血测定肝功能 ALT、AST,统计死亡率;取肝脏组织切片观察其修复情况。荧光显微镜下观察胎肝干细胞定植情况。
1.2.3 术后维护 术后三组大鼠饲养于 18-22 ℃环境中,饮水使用 5 %葡萄糖溶液,以普通条状块料喂养,腹腔注射青霉素 4万单位,2 次 / 日。C 组大鼠放入单笼喂养,保温至其苏醒。每日推注 0.5 mL 肝素盐水(25 U /ml)封管,可保持管道通畅。
1.3 统计学方法
应用 SPSS 17.0 统计软件进行分析,数据以(x±s)表示。组间均数比较采用方差分析和 LSD-t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠一般情况以及肝功能的影响
三组大鼠均于造模后 12 小时开始出现精神萎靡、拒食,少动,嗜睡、小便失禁、共济失调。12 小时开始出现死亡,48 小时到达高峰。死亡率分别为:A 组 70 %(14/20)、B 组 40 %(8/20)、C 组 45 %(9/20)。术后 C 组 2 只大鼠因导管脱出导致出血死亡。移植干细胞 72 小时后组间肝功能 A 组与 B、C 组 ALT、AST 出现统计学差异,B、C 组肝功恢复较 A 组明显。B、C 组间无明显统计学差异。
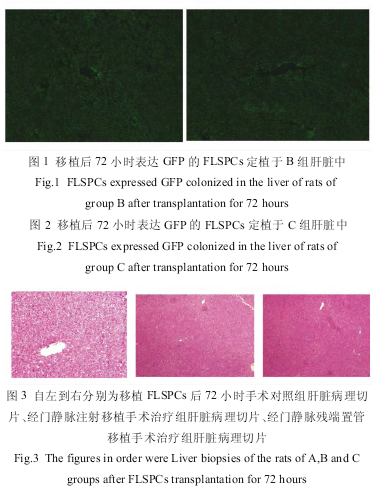
2.2 胚胎肝干细胞移植对肝脏病理的影响
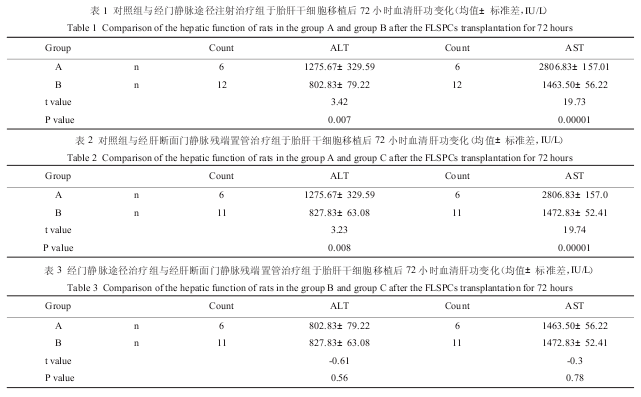
胎肝干细胞移植 72 小时后,取出大鼠肝脏,肉眼观 A 组剩余肝叶代偿性肿大。镜下可见肝窦及中央静脉扩张,伴有炎细胞浸润,肝细胞增生不明显;B、C 组见肝脏体积较对照组有所增大,肝叶代偿,镜下见肝细胞增生明显,肝索结构较完整,肝小叶结构较 A 组有较明显恢复。荧光显微镜下可见 B 组、C组表达 GFP 的胎肝干细胞大量定植于肝叶组织中的密度大致相同(图 1、2)。
3 讨论
大鼠为常用的实验动物,随着肝脏药物及细胞治疗急性肝损伤研究的发展,以其为实验动物时许多研究均需通过静脉持续、反复、不同时间点的给药、测定检验指标。鼠尾静脉便于穿刺,但是易摆动,穿刺针不易固定,且仅适于单次操作。并且在手术制备急性肝损伤模型过程中常常失血量较大,其中仅切除肝叶内储存的血量丢失就足以使循环血量锐减,加之术后动物不能立即恢复饮水进食,常导致其休克、脱水、低血糖引起非肝功能因素死亡。因此术中、术后输液尤为重要。基于以上原因,静脉置管成为首选的方法。传统的静脉置管方法均在原有肝脏切除的基础上另取部位进行手术置管,如颈内静脉、腹股沟静脉甚至门静脉属支置管,需在已制备急性肝损伤大鼠手术基础上另附加不同部位的手术创伤、耗时、费力。本实验采用价廉、易得的材料,在大鼠已切除肝叶的肝断面门静脉分支残端置管、固定,建立一可靠、相对经济的实验大鼠静脉通路。
大鼠肝叶分为 6 叶,各叶均有相对独立的 Glisson 鞘系统及肝静脉回流系统,易于绕线阻断血流,Glisson 鞘中均有较粗的门静脉分支,容易分离进行静脉置管等操作。在置管操作过程中应注意一下几点:①保持静脉充盈,血管应先阻断近端,再阻断远端;②用 2 %利多卡因滴于静脉表面浸润,防止因剥离或放线等操作引起血管痉挛;③阻断血流后应往备切除的肝叶方向尽可能的多分离血管,方便插管操作,保证插管深度,不致术后脱出;④插管后不宜过深,防止管道进入门静脉主干或其他肝叶的门脉属支,引起血流障碍或门静脉高压;⑤导管需潜行皮下,自颈背部引出,术后单笼饲养,防止撕咬致导管脱出。
移植部位的不同直接影响到移植细胞的归巢和治疗效果。腹腔移植细胞存活率低下,外周静脉注射药物或细胞,最终到达肝脏均有不同程度的剂量减少。门静脉提供 70%以上的肝脏血液供应,到达干细胞血窦后留置时间较长,选择性分布良好,在不改变器官微结构的情况下与肝实质融合。经门静脉移植细胞途径已被认同在细胞移植的途径中具有高浓度、少不良反应、利于细胞迁移定植的优点,其更符合生理学和组织学的特点,且门脉系统内含有高浓度的嗜肝细胞因子,肝脏本身的微环境及门静脉血中的营养成份均对植入的细胞也有益。肝脏的靶向性用药也可提高疗效,减少用药剂量,降低治疗成本以及药物的不良反应。本实验中应用相同量的胎肝干细胞对不同模型的急性肝衰竭大鼠的治疗过程中发现对肝功能、凝血功能的纠正以及对肝脏修复能力,经肝断面门静脉分支残端置管途径效果等同于经门静脉穿刺给药,同时相对于门静脉穿刺给药途径,本模型还具有可反复、多次、选时以及补液治疗等优点,并避免了门脉穿刺过程中出血、血栓形成,同时易于控制给药速度,防止门静脉高压的产生阻碍受体肝脏血流等缺点。
参 考 文 献(References)
[1] Aalbers AGJ, Kate M, Grevenstein WMU, et al. A small mammalmodel of tumour implantation, dissemination and growth factorexpression after partial hepatectomy [J]. Eur J Surg Oncol, 2008, 34(4): 469-475
[2] Li CX, Shao Y, Ng KT, et al. FTY720 suppresses liver tumormetastasis by reducing the population of circulating endothelialprogenitor cells[J]. PLoS One, 2012, 7(2): 32380
[3] Piscaglia AC, Shupe TD, Pani G, et al. Establishment of cancer celllines from rat hepatocholangiocarcinoma and assessment of the roleof granulocyte-colony stimulating factor and hepatocyte growth factorin their growth, motility and survival[J]. J Hepatol, 2009, 51(1): 77-92
[4] de Graaf W, Bennink RJ, Heger M, et al. Quantitative assessment ofhepatic function during liver regeneration in a standardized rat model[J]. J Nucl Med, 2011, 52(2): 294-302
[5] Ren YS, Qian NS, Tang Y, et al. Beneficial effects of splenectomy onliver regeneration in a rat model of massive hepatectomy [J].Hepatobiliary Pancreat Dis Int, 2012, 11(1): 60-65
[6] Sanchez-Hidalgo JM, Naranjo A, Ciria R, et al. Impact of age on liverregeneration response to indury after partial hepatectomy in a ratmodel[J]. J Surg Res, 2012, 175(1): el-e9
[7] Sun CK, Chen CH, Kao YH, et al. Bone marrow cells reducefibrogenesis and enhance regeneration in fibrotic rat liver [J]. J SurgRes, 2011,169(1): 15-26
[8] Ishibe A, Togo S, Kumamoto T, et al. Prostaglandin E1 prevents liverfailure after excessive hepatectomy in the rat by up-regulating CyclinC, Cyclin D1, and Bclxl[J]. Wound Repair Regen, 2009, 17(1): 62-70
[9] Ninomiya M, Shirabe K, Terashi T, et al. Deceleration of regenerativeresponse improves the outcome of rat with massive hepatectomy[J].Am J Transplant, 2010, 10(7): 1580-1587
[10] 刘文渊, 张玉君, 徐土炳, 等. 离体肝切除联合自体肝移植大鼠模型的建立[J]. 山西医科大学学报, 2011, 42(9): 703-705Liu Wen-yuan, Zhang Yu-jun, Xu Tu-bing, et al. Establishment of anextracorporeal liver resection and partial liver autotransplantationmodel in rats[J]. J Shanxi Med Univ, 2011, 42(9): 703-705
[11] Benjamin M, Stutchfield, Stuart J, et al. Prospects for stem celltransplantation in the treatment of hepatic disease [J]. Liver Transpl,2010, 16(7): 827-836
[12] Lazarevich NL, Shavochkina DA, Fleishman DI, et al. Deregulationof hepatocyte nuclear factor 4(HNF4) as a marker of epithelial tumorsprogression[J]. Exp Oncol, 2010, 32(3): 167-171
[13] 史冀华, 朱盛兴, 张水军. 大鼠肝部分切除术的应用解剖及实施[J].世界华人消化杂志, 2008, 16(22): 2516-2520Shi Ji-hua, Zhu Sheng-xing, Zhang Shui-jun. Applied Anatomy ofliver and partial hepatectomy in rats[J]. World Chin J Digestol, 2008,16(22): 2516-2520
[14] Aller MA, Lorente L, Prieto I, et al. Hepatectomies in the rat: A lookat the caudate process through microsurgery [J]. Dig Liver Dis, 2009,41(10): 695-699
[15] Palmes D, Dietal KH, Derw G, et al. Auxiliary Partial orthotopic livertransplantation treatment of acute liver failure in an new rat model[J].Langenbecks Arch Surg, 2002, 386(7): 534-541
[16] Madrahimov N, Dirsch O, Broelsch C, et al. Marginal hepatectomy inthe rat:from anatomy to surgery[J]. Ann Surg, 2006, 244(1): 89-98
[17] Petersen BE, Bowen WC, Patrene KD, et a1. Bone l11ar.FOW as apotential source of hepatic oval cells [J]. Science, 1999, 284 (14):1168-1170
[18] 马军, 段芳龄, 李文晰, 等. 大鼠移植骨髓细胞向肝细胞转化的实验研究[J]. 胃肠病学和肝病学杂志, 2003, 12(2): 138-143Ma Jun, Duan Fang-ling, Li Wen-xi, et al. Study on differentiation ofbone marrow cells into hepatic lineages in rat[J]. Chin J Gastro Hepa,2003, 12(2): 138-143
[19] 向国安, 张刚庆, 方驰华, 等. 同种异体骨髓间质干细胞移植在大鼠肝内定居能力初步研究 [J]. 第一军医大学学报, 2005, 25(8):994-997Xiang Guo-an, Zhang Gang-qing, Fang Chi-hua, et al. A preliminarystudy of the homing capacity of allograft mesenchymal stem cells torat liver[J]. J First Mil Med Univ, 2005, 25(8): 994-997
[20] 刘彦, 谭道玉, 李昌平, 等. 细胞移植对肝纤维化大鼠肝脏组织结构的影响[J]. 检验医学与临床, 2009,12(6): 933-935Liu Yan, Tan Dao-yu, Li Chang-ping, et al. Effect of transplantinghepatocyte-like cells on rat's hepatic histologic structure r [J]. LabMed Clin, 2009,12(6): 933-935[21] Eguchi S, Lilja H, Hewitt WR, et a1. Loss and recovery of liveregeneration in rats with fulminant hepatic failure [J]. J Stag Res,1997, 72(2): 112-122