
酒在人类社交活动中起着至关重要的作用,但过量饮酒可导致全身各脏器受损,如脑、心血管系统、胃肠道等,尤以肝脏受损最为突出,过度饮酒导致的死亡人数占全球人口死亡的3.8%。在中国,肝脏疾病以肝炎病毒感染多见,其次,酒精性肝病(alcoholi cliver disease)的发生率有增加趋势,已成为仅次于病毒性肝炎的第二肝病病因,饮酒与肝脏的关系也日益受到重视,而追求一种对身体健康损害较小的酒类是当前人们最为关心的话题。2012年3—10月,本研究选用市面上常见的某品牌53度酱香型白酒为实验用白酒,并选择高、中、低3种不同的剂量,通过对3种不同饮用剂量之间的比较以及与530g/L乙醇的对照,观察饮用该白酒在机体的代谢过程是否与单纯乙醇存在异同,初步探讨饮酒与健康的关系。
1、材料与方法
1.1材料
1.1.1白酒和乙醇实验用酱香型白酒[(53±2)g/L,V/V],由贵州粮油进出口公司4部提供;无水乙醇(分析纯,上海振兴化工一厂出品,批号201208302)。
1.1.2动物雄性Wistar大鼠75只,清洁级,体质量(180±20)g,购自第三军医大学实验动物中心[SCXK(渝)2007-0003]。普通饲料喂养,自由饮水,自然采光,室温15~25℃,实验前适应环境1周。
1.1.3试剂超氧化物歧化酶(super oxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、乙醇脱氢酶(alcohol dehydrogenase,ADH)、乙醛脱氢酶(acetalde-hy dedehydrogenase,ALDH)试剂盒(南京建成生物工程研究所,批号:20110229,20110228,20110228,20110317,20110307),SYBRGreen试剂盒(北京天根生化科技有限公司,批号:K9929),逆转录试剂盒(加拿大FermentasMBI公司,批号:00087036),Trizol试剂(美国Invitrogen公司,批号:28216),EnVision试剂盒[基因科技(上海)有限公司,批号:25F1777A],电化学发光(ECL)试剂盒(美国Millipore公司,批号1219101),全蛋白提取试剂盒(南京凯基生物科技发展有限公司,批号KGP250),BCA蛋白定量试剂盒(美国ThermoSCIENTIFIC公司,批号:23227),ADH1、AL-DH2、β-actin一抗分别购自英国Abcam、美国Sigma公司。ADH1上、下游引物序列分别为5'-CTGTGG-TAGATGACATAGCGGT-3'和5'-GGTTTGGTG-TAGTCTTGAGGGT-3',1804bp;ALDH2上、下游引物序列分别为5'-TGTCTCCGCTATTATGCTGGCT-3'和5'-ATGATGATATTGGGGCTCTTTC-3',1889bp;β-actin上、下游引物序列分别为5'-TCCTCCTGAGCG-CAAGTACTCT-3'和5'-GCTCAGTAACAGTCCGC-CTAGAA-3',1536bp。均由上海生工生物工程有限公司合成。
1.1.4主要仪器气相色谱柱20%PEG20M(100~120目),2m×2mm(南京伽诺仪器仪表有限公司),SP-1000气相色谱仪(北京北分瑞利仪器有限公司),核酸定量仪(美国Amersham Biosciences公司),核酸扩增实时荧光检测系统(DA7600型)(中山大学达安基因股份有限公司),GelDocEQ凝胶成像仪(美国Bio-Rad公司),显微图像采集系统(日本Olympus公司)。
1.2方法
1.2.1动物分组及处理大鼠随机分为空白对照组(A组),乙醇组(B组),白酒高(C组)、中(D组)、低剂量组(E组),每组15只。A组以生理盐水5mL/kg灌胃,B~E组分别以乙醇5mL/kg(用蒸馏水稀释至530g/L体积分数),酱香型白酒10、5、2.5mL/kg(用蒸馏水稀释1倍)灌胃,1次/d,共7d。全部大鼠于末次灌胃1、12h后眼眶采血,然后股动脉放血处死,常规留取血清,先测定末次灌胃1h后血清乙醇浓度,再测定末次灌胃12h后血清丙氨酰氨基转移酶(ALT)、草氨酰氨基转移酶(AST)活性和乙醇、乙醛浓度;留取全部肝脏,测定各组大鼠肝组织匀浆SOD、MDA、GSH-PX、ADH、ALDH含量,测定肝组织中ADH1、ALDH2mRNA和蛋白质的表达水平。
1.2.2主要检测指标及方法1.2.2.1ALT、AST活性及乙醇、乙醛浓度的检测Siemens Advia1650全自动生物化学分析仪测定ALT、AST活性,顶空气相色谱法检测血中乙醇、乙醛浓度。
1.2.2.2SOD、MDA、GSH-PX、ADH、ALDH的检测按试剂盒方法测定肝组织匀浆SOD、MDA、GSH-PX,根据文献[9-10]测定肝组织匀浆ADH、ALDH含量。
1.2.2.3RT-PCR检测ADH1、ALDH2mRNA的表达采用Trizol-酚-氯仿一步法提取总RNA并纯化,测定RNA浓度,逆转录合成cDNA后行RT-PCR。实验过程中以β-actin作内对照,进行标准化转换得到各样本的拷贝数(Ct值),以Ct值的均数来反映目的基因的表达。
1.2.2.4免疫组织化学法检测ADH1、ALDH2的表达采用EnVision二步法,切片常规脱蜡,抗原热修复,分别用ADH1抗体(1∶300)、ALDH2抗体(1∶300)4℃过夜,二抗37℃50min,DAB显色,苏木素复染。结果判定:肝细胞胞浆染成棕黄色为阳性。每张切片随机选取5个高倍视野(×400),计数100个细胞中的阳性细胞百分比。
1.2.2.5Western blot检测ADH1、ALDH2蛋白质的表达提取蛋白并测定蛋白含量。取蛋白质样品40μg,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,封闭,分别用ADH1抗体(1∶1000)、ALDH2抗体(1∶1000)4℃孵育过夜,二抗(1∶3000)室温1h,ECL曝光显影,GelDocEQ凝胶成像仪扫描,Quantity One软件分析结果。以β-actin表达水平作为内参照。
1.3统计学方法。采用SPSS16.0统计软件,计量资料多组间比较采用单因素方差分析,分析前行方差齐性检验,方差齐时两两比较采用LSD法,方差不齐时两两比较采用Tamhane法。
2、结果
2.1大鼠一般情况A组大鼠皮毛光亮整洁,灵活好动,饮食正常及大小便正常,体重逐渐增加,无死亡现象。B、C组大鼠在灌胃后,轻者步态不稳,动作呆板,重者醉倒嗜睡,翻正反射消失,约2h后逐渐恢复正常;随着灌胃时间增加,出现不同程度的精神萎靡,活动及饮食减少,皮毛凌乱,光泽度差,大便溏泻等表现,且症状缓解所需时间较长。D、E组大鼠上述表现不明显,偶见步态不稳,动作呆板现象,但缓解时间较B组均提前。B、C组大鼠由于酒精中毒出现部分死亡现象,B组死亡5只,C组死亡3只;D组由于灌胃不当致食管穿孔死亡1只。
2.2各组大鼠血清ALT、AST活性的比较与A组比较,B、C、D组血清ALT、AST活性明显升高(P<0.01),E组升高,但差异无统计学意义(P>0.05);与B组比较,D、E组明显降低(P<0.01),C组升高,但差异无统计学意义(P>0.05);C组高于D组,D组高于E组,差异有统计学意义(P<0.01)。见表1。
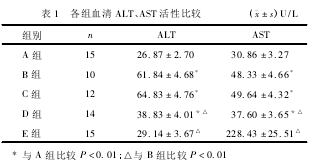
2.3各组大鼠血清乙醇、乙醛浓度的比较末次灌胃1h后,与B组比较,C组血清乙醇浓度明显升高(P<0.01),D组降低,但差异无统计学意义(P>0.05),组明显降低(P<0.01),C组高于D组,D组高于E组,差异有统计学意义(P<0.01);末次灌胃12h后,与B组比较,C组血清乙醇、乙醛浓度明显升高(P<0.05,P<0.01),D、E组均明显降低(P<0.01),C组高于D组,D组高于E组,差异有统计学意义(P<0.01)。见表2。
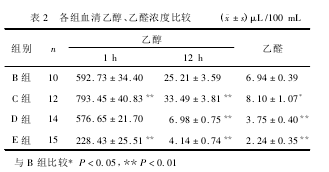
2.4各组大鼠肝组织匀浆SOD、GSH-PX含量的比较与A组比较,B组肝组织匀浆SOD、GSH-PX含量明显降低(P<0.01),C组降低,但差异无统计学意义(P>0.05),D、E组明显升高(P<0.05,P<0.01);与B组比较,C、D、E组均明显升高(P<0.01);E组高于D组,D组高于C组,差异有统计学意义(P<0.01)。见表3。
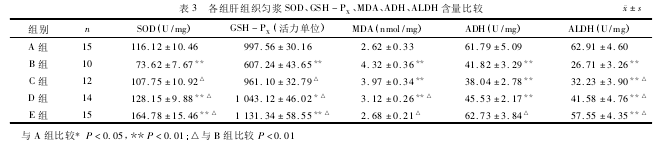
2.5各组大鼠肝组织匀浆MDA含量的比较与A组比较,B、C、D组肝组织匀浆MDA含量明显升高(P<0.01),E组升高,但差异无统计学意义(P>0.05),与B组比较,D、E组明显降低(P<0.01),C组降低,但差异无统计学意义(P>0.05),C组高于D组,D组高于E组,差异有统计学意义(P<0.01)。见表3。
2.6各组大鼠肝组织匀浆ADH含量的比较与A组比较,B、C、D组肝组织匀浆ADH含量明显降低(P<0.01),E组升高,但差异无统计学意义(P>0.05),与B组比较,C组降低,D组升高,但差异均无统计学意义(P>0.05),E组明显升高(P<0.01),E组高于D组,D组高于C组,差异有统计学意义(P<0.01)。见表3。
2.7各组大鼠肝组织匀浆ALDH含量的比较与A组比较,B、C、D、E组肝组织匀浆ALDH含量均明显降低(P<0.01),与B组比较,C、D、E组明显升高(P<0.01),E组高于D组,D组高于C组,差异有统计学意义(P<0.01),见表3。
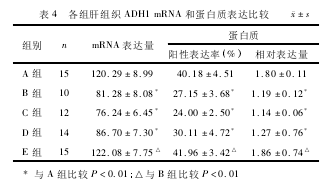
2.8各组大鼠肝组织ADH1mRNA和蛋白质表达的比较与A组比较,B、C、D组肝组织ADH1mRNA和蛋白质表达明显降低(P<0.01),E组升高,但差异无统计学意义(P>0.05);与B组比较,C组降低,D组升高,但差异无统计学意义(P>0.05),E组明显升高(P<0.01),E组高于D组,D组高于C组,差异有统计学意义(P<0.01)。见表4和图1、2。
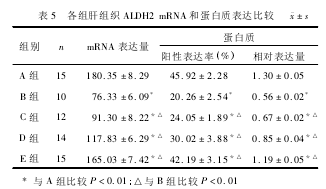
2.9各组大鼠肝组织ALDH2mRNA和蛋白质表达的比较与A组比较,B、C、D、E组肝组织ALDH2mRNA和蛋白质表达明显降低(P<0.01);与B组比较,C、D、E组均明显升高(P<0.01),E组高于D组,D组高于C组,差异有统计学意义(P<0.01),见表5和图3、4。
3、讨论
酒是人们日常生活及社交活动中常见饮品,但人体在大量饮酒后通常易出现口干舌燥、头昏脑涨、心跳加速、血压上升等症状,所表现出的症状及轻重程度在饮用不同酒质后不尽相同,部分品牌白酒造成的不适感相对较少。而造成上述症状的主要原因,是酒中所含的乙醇在体内代谢过程中生成的乙醛所致。
乙醇进入体内后通过胃肠道吸收,经胃肠消化器官后的乙醇约有90%在肝脏中被代谢,乙醇在肝脏中的代谢有3条途径,其中以位于线粒体中的ADH系统较为常见,此途径中乙醇经ADH氧化为乙醛,乙醛经线粒体中的ALDH氧化为乙酸,乙酸再经三羧酸循环,最终氧化成二氧化碳和水。但因乙醛转化为乙酸的速度较慢,易导致乙醛在体内蓄积。乙醛可与肝细胞中的蛋白质、DNA发生整合,形成乙醛加合物,如MDA-乙醛加合物、α-羟乙基蛋白-乙醛加合物等,诸多乙醛加合物可导致受其影响的蛋白质发生变构,失去应有的功能,从而引起肝细胞功能受损,甚至削弱DNA自身修复,诱导姐妹染色体单体互换,导致DNA突变或畸形,进而使肝细胞异常增殖,最终引起肝硬化甚至肝癌。同时,乙醛加合物还能使机体活性氧增多,氧化应激水平升高,导致脂质过氧化,MDA升高,某些抗氧化物质如SOD、GSH-PX大量消耗,削弱机体多个器官特别是肝脏的抗氧化能力,其诱导的氧化应激作用在酒精性肝病发生发展过程中扮演着重要角色。
乙醛对肝细胞的毒性作用取决于肝细胞暴露于乙醛的程度,同时取决于乙醇是否由ADH迅速转化为乙醛,并由ALDH迅速转化为无毒的乙酸。可见,在乙醇代谢解毒过程中,ADH和ALDH发挥着至关重要的作用,是乙醇代谢的关键限速酶。ADH及ALDH均具有基因多态性,人体ADH有8种同工酶,其中主要是ADH1参与乙醇转化为乙醛的过程,尤其以ADH1B*2催化效率最高。ALDH有4种同工酶,主要是AL-DH2参与乙醛转化为乙酸的过程,尤其以ALDH2*1催化效率最高。因此,本实验选择检测大鼠肝组织ADH1及ALDH2的表达。
本研究发现,实验用白酒对大鼠肝功能的损伤较乙醇低,主要表现为中、低剂量白酒对血清ALT、AST影响较小,且3种不同剂量的白酒对大鼠SOD、GSH-PX的诱导表达均明显高于乙醇,而对MDA的诱导低于乙醇,说明实验用白酒对提高肝脏对抗氧化应激及脂质过氧化的能力具有一定功效。
高、中剂量白酒对大鼠ADH的表达影响与乙醇差异不明显,仅低剂量组大鼠ADH较乙醇组明显升高,表明实验用白酒与乙醇对大鼠ADH的影响不存在明显差异。而其对ALDH的影响与乙醇存在着明显差异,白酒高、中、低剂量组大鼠ALDH的表达均明显高于乙醇组,同时,白酒中、低剂量组末次灌胃12h后的血乙醇、乙醛浓度明显低于乙醇组,说明该白酒能增加ALDH活性,从而加速乙醛的生物学转化过程,能更迅速使乙醛转化为对机体无害的乙酸、二氧化碳及水,从而减轻乙醛蓄积对机体造成的伤害。
某些酱香型白酒的酿造工艺独具特色,经过多年的贮藏以及勾兑后再贮存一段时间,在自然老熟过程中极大地降低了醛类、苯、硫化物等各种对人体有害的物质,兼之实行敞开酿造,空气中有大量在独特地理环境下形成的有益微生物可供吸纳,故其风格独树一帜,除乙醇外,其内还含有多种氨基酸、维生素、SOD及多种人体必需微量元素,不能等同于乙醇,因而其对肝脏的作用与乙醇单独对肝脏的作用可能有所不同。以往的研究曾对99名贵州茅台酒厂长期大量饮用茅台酒的职工进行流行病学调查,发现长期饮用茅台酒可致脂肪肝,不引起明显肝纤维化及肝硬化,其后的基础研究表明,茅台酒能诱导肝脏金属硫蛋白及血色素加氧酶-1的基因表达增加及肝脏金属硫蛋白含量增加,从而抑制与肝纤维化密切相关的星状细胞的活化及胶原蛋白生成;经处理去掉乙醇后的茅台液可减轻酒精所致的氧化应激反应,增加肝脏的脂质抗氧化作用。因此,其有异于乙醇的独特品质决定了其对肝脏ADH、ALDH的影响可能有所不同。
本实验同时也发现,无论是对大鼠血清ALT、AST、乙醇、乙醛,还是对肝组织匀浆SOD、GSH-PX、MDA、ADH、ALDH及肝组织ADH1、ALDH2mRNA和蛋白质表达的影响,白酒高、中、低剂量组之间差异均有统计学意义,表明随着饮酒量增加,其对机体造成的不良影响也会增加,与文献报道一致。因此,饮酒应适度,切忌过量。
参考文献:
[1] REHM J,MATHERS C,POPOVA S,et al. Global burden of di-sease and injury and economic cost attributable to alcohol use and alcohol - use disorders[J]. Lancet,2009,373 ( 9682) : 2223 -2233.
[2] BODE C,BODE J C. Alcohol's role in gastrointestinal tract disor-ders[J]. Alcohol Health Res World,1997,21( 1) : 76 - 83.
[3] GAO B,SEKI E,BRENNER D A,et al. Innate immunity in al-coholic liver disease[J]. Am J Physiol Gastrointest Liver Physiol,2011,300( 4) : 516 - 525.
[4] GEORGE A,FIGUEREDO V M. Alcohol and arrhythmias: a comprehensive review[J]. J Cardiovasc Med ( Hagerstown ) ,2010,11( 4) : 221 - 228.
[5] FRAZIER T H,STOCKER A M,KERSHNER N A,et al. Treat-ment of alcoholic liver disease[J]. Therap Adv Gastroenterol,2011,4( 1) : 63 - 81.
[6] 曾祖训. 白酒醉酒度低的产品是消费者的新追求[J]. 酿酒科技,2008( 10) : 115 -116.
[7] 吴诚,吕著海,沈存思,等. 养元饮对酒精性肝损伤大鼠解酒及保肝作用[J]. 中国实验方剂学杂志,2010,16( 14) : 150 -153.
[8] SOTNIKOV E E,MOSKOVKIN A S. Determination of chloropic-rin in drinking water using static headspace gas - chromatographicanalysis[J]. J Anal Chem,2005,60( 2) : 171 - 173.
[9] 施韵,盛亮,钱之玉,等. 西红花酸对大鼠酒精性脂肪肝的改善作用及机制探讨[J]. 中国新药杂志,2008,24( 17) : 2115 -2118.
[10] KOIVISTO T,ERIKSSON C J. Hepatic aldehyde and alcohol de-hydrogenases in alcohol - preferring and alcohol - avoiding rat lines[J]. Biochem Pharmacol,1994,48( 8) : 1551 -1558.
[11] 杨波. 走近国酒茅台[M]. 贵阳: 贵州人民出版社,2001:323.
[12] ZAKHARI S. Overview: how is alcohol metabolized by the body?[J]. Alcohol Res Health,2006,29( 4) : 245 -254.
[13] SETSHEDI M,WANDS J R,MONTE S M. Acetaldehyde adductsin alcoholic liver disease[J]. Oxid Med Cell Longev,2010,3( 3) : 178 -185.
[14] BALBO S,HASHIBE M,GUNDY S,et al. N2 - ethyldeoxy-guanosine as a potential biomarker for assessing effects of alcohol consumption on DNA[J]. Cancer Epidemiol Biomarkers Prev,2008,17( 11) : 3026 - 3032.
[15] BROOKS P J,THERUVATHU J A. DNA adducts from acetalde-hyde: implications for alcohol - related carcinogenesis[J]. Alco-hol,2005,35( 3) : 187 - 193.
[16] CEDERBAUM A I,LU Y,WU D. Role of oxidative stress in al-cohol - induced liver injury[J]. Arch Toxicol,2009,83 ( 6 ) :519 - 548.
[17] ZIMA T,KALOUSOV? M. Oxidative stress and signal transduc-tion pathways in alcoholic liver disease[J]. Alcohol Clin ExpRes,2005,29( 11 Suppl) : 110S - 115S.
[18] SEITZ H K,BECKER P. Alcohol metabolism and cancer risk[J]. Alcohol Res Health,2007,30( 1) : 38 -41,44 -47.
[19] SEITZ H K,STICKEL F. Risk factors and mechanisms of hepato-carcinogenesis with special emphasis on alcohol and oxidative stress[J]. Biol Chem,2006,387( 4) : 349 -360.
[20] WU J,CHENG M L,ZHANG G H,et al. Epidemiological and histopathological study of relevance of Guizhou Maotai liquor and liver diseases[J]. World J Gastroenterol,2002,8 ( 3 ) : 571 -574.
[21] LIU J,CHENG M L,SHI J Z,et al. Differential effects between maotai and ethanol on hepatic gene expression in mice: possible role of metallothionein and heme oxygenase - 1 induction by maotai[J]. Exp Biol Med ( Maywood) ,2006,231( 9) : 1535 -1541.
[22] CHENG M L,WU J,WANG H Q,et al. Effect of Maotai liquor in inducing metallothioneins and on hepatic stellate cells[J].World J Gastroenterol,2002,8( 3) : 520 - 523.
[23] CHENG M L,WU J,ZHANG W S,et al. Effect of Maotai liquor on the liver: an experimental study[J]. Hepatobiliary Pancreat Dis Int,2004,3( 1) : 93 - 98.
[24] ZHANG D,LU H,LI J,et al. Essential roles of ERKs and p38K in up - regulation of GST A1 expression by Maotai content in hu-man hepatoma cell line Hep3B[J]. Mol Cell Biochem,2006,293( 1/2) : 161 -171.
[25] BRUHA R,DVORAK K,PETRTYL J. Alcoholic liver disease[J]. World J Hepatol,2012,4( 3) : 81 -90.





