
脆性X综合征(fragileXsyndrome,FXS)是常见的X连锁先天性智力低下疾病,FMR1(fragileXmentalretardation1,FMR1)基因的突变或缺失可导致FXS。FMR1基因敲除小鼠(KO鼠)与FXS患者有很多相似的症状,包括不同程度的智力低下、巨睾症等,是研究FXS成熟的动物模型。
神经肽Y(neuropeptideY,NPY)是一种含36个氨基酸的单链肽,与下丘脑神经内分泌功能密切相关,在生殖功能起重要调节作用。γ-氨基丁酸(γ-aminobutyricacid,GABA)是中枢神经系统中一种重要的抑制性神经递质,对下丘脑-垂体-卵巢轴有深刻的影响,参与生殖活动的调节。
研究发现FXS女性20%会出现卵巢早衰,而在KO鼠的繁殖过程中亦发现其繁殖能力有改变。
因此,我们旨在研究FMR1基因敲除雌鼠生殖功能的变化,并对其可能的机制进行探究。
1、材料与方法
1.1材料
FMR1基因敲除小鼠(FVBKO)是以正常野生型FVB(FVBWT)小鼠为背景,利用基因敲除技术将FMR1基因定点灭活制备成人类脆性X综合征的代表性实验动物模型。该基因敲除模型鼠于2002年由广州医学院神经科学研究所从荷兰Erasmus大学实验动物科学中心引进,经广州医学院实验动物中心繁育饲养建立了该品系的清洁级种群。所有实验动物的操作及饲养均符合国家标准,遵循人道原则。实验小鼠均饲养在清洁级环境中,自由进水和饮食,室内温度为20~26℃,相对湿度为50%~70%,光照明暗交替12h∶12h。出生后5~7周为小鼠性成熟期,8~12周为小鼠繁殖适龄期,本研究选择10周雌性小鼠为研究对象。
1.2主要试剂与设备
PCR试剂盒(上海生工生物工程技术服务有限公司),兔抗鼠NPY多克隆抗体(Abcam),豚鼠抗鼠GABA多克隆抗体(Abcam)、辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗及羊抗豚鼠IgG二抗(福州迈新生物技术开发有限公司),小鼠血清NPYELISA试剂盒(广州市鲁诚生物科技有限公司),光学显微镜(日本Olympus-BH22),酶标仪(芬兰Thermo)。
1.3实验动物基因型鉴定
按文献的方法。
1.4繁殖力试验
选取成年的KO纯合子、KO杂合子及WT雌鼠分别与成年的WT雄鼠合笼,合笼比例为雌鼠:雄鼠=2∶1,每天早上八点和下午两点观察雌鼠是否有孕栓形成,记录合笼时间和产仔数。
1.5卵巢形态学观察
HE染色观察卵巢形态及卵泡计数,卵泡计数方法参照文献。
1.6免疫组化法测定下丘脑NPY、GABA的表达
免疫组织化学染色方法按试剂盒操作说明书进行,DAB显色,以PBS代替一抗作为阴性对照,相同条件下已知阳性片作阳性对照,高倍光镜下观察切片(×400),用ImageProPlus6.0图像分析软件分析其平均光密度值。平均光密度值越大,阳性表达越强。
1.7ELISA法测定血清NPY水平
按ELISA试剂盒说明书步骤进行。
1.8统计学处理
所有的数据采用SPSS16.0软件进行分析,正态分布的计量资料以(x±s)表示,组间均数采用单因素方差分析。P<0.05为差异有显著性。
2、结果
2.1实验动物基因型鉴定结果
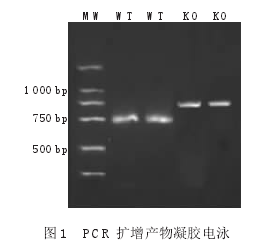
KO鼠和WT鼠分别扩增出约800bp和468bp的DNA片段,见图1。
2.2繁殖力试验结果
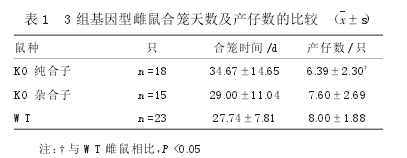
3组小鼠合笼天数及产仔数比较,KO纯合子雌鼠产仔数少于WT雌鼠(P<0.05),见表1。
2.3卵巢组织形态比较
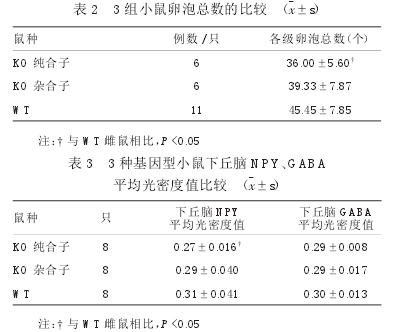
KO纯合子、KO杂合子、WT雌鼠卵巢形态未见明显不同,见图2;KO纯合子雌鼠卵泡总数少于WT雌鼠(P<0.05),见表2。
2.4下丘脑NPY的表达及其平均光密度值比较
NPY在下丘脑的表达结果,见图3;KO纯合子雌鼠下丘脑NPY的表达弱于WT雌鼠,差异有显著性(P<0.05),见表3。
2.5下丘脑GABA的表达及其平均光密度比较
GABA在下丘脑的表达结果,见图3;三种基因型小鼠下丘脑GABA的表达差异无显著性(P>0.05),见表3。2.6血清NPY表达的比较3组小鼠血清NPY的表达量差异无显著性(P>0.05),见表4。

3、讨论
FXS是X连锁不完全显性遗传病,发病率男性为1/1250,女性为1/2500,在X连锁智力低下中占40%,99%的FXS是由于脆性X智力低下基因1(FMR1)的动态突变引起,1%是由于FMR1基因的错义突变或缺失突变引起。FMR1基因位于X染色体的长臂远端Xq27.3区的脆性部位,含17个外显子,在该基因的5‘非翻译区存在一段数目可变的(CGG)n重复序列,其上游250bp处存在一CpG岛。(CGG)n结构的重复扩增会造成CpG岛的异常甲基化,从而关闭FMR1基因的转录,导致其编码的脆性x智力低下蛋白(FMRP)的表达减少或缺失,进而引起一系列的临床表现,主要表现为智力低下、自闭症、认知障碍、女性成年期卵巢早衰及男性青春期后大睾丸。FMR1基因敲除小鼠是在FMR1基因的第5个外显子中插入了一个新霉素表达片断,从而阻断了500bpDNA片断的扩增,导致FM-RP表达的缺失而制备成FXS的动物模型,其活动过度,学习记忆力减退,易激惹,青春期后睾丸增大,是研究FXS成熟的动物模型。
近年来已有文献报告FMR1基因的缺失对小鼠的生殖功能有影响,祝亚桥等研究发现KO雄鼠的生育能力和WT小鼠相比是降低的,但两者的精子生成量、精子存活率、精子畸形率及血清性激素水平无差别,考虑为KO雄鼠的脑部病变,或与勃起相关的因素改变而引起。在对雌性FMR1基因敲除小鼠生殖功能的研究中戴丽军等应用10u孕马血清促性腺激素(PMSG)和10u人绒毛膜促性腺激素(HCG)对10周的FVB.KO和FVB.WT雌鼠超排卵处理后,血清性激素水平和超排卵数差异均无显著性(P>0.05),提示超排不影响FMR1基因敲除小鼠的繁殖性能。同时该研究发现FVB.KO的产仔数较FVB.WT是降低。以上的研究均提示FMR1基因的缺失降低了小鼠的生育率,但对其影响机制未作进一步的研究,本实验除了应用产仔数这一传统指标对FMR1基因敲除小鼠的繁殖性能进行评估外,更运用了卵泡计数这一更直观的证据加以说明,在他们研究的基础上本实验着重探讨FMR1基因是通过何种机制来影响小鼠的生殖功能的。
本研究显示成年的KO纯合子、KO杂合子、WT雌鼠与成年的WT雄鼠合笼,KO纯合子雌鼠的产仔数少于WT雌鼠,P<0.05,这与前人的研究结果相同。HE染色观察3种基因型雌鼠的卵巢形态发现:
卵巢皮质、髓质层次分明,原始卵泡、初级卵泡、次级卵泡、成熟卵泡及黄体均可见,原始卵泡、次级卵泡较多,另可见少量闭锁卵泡及间质腺,3组间其卵巢形态未见明显不同。3组间卵泡总数比较发现:KO纯合子雌鼠的卵泡总数少于WT雌鼠,P<0.05。卵泡数目是反映卵巢储备的重要的指标,卵泡数目的减少标志着生殖功能的下降。这一结果同样支持KO纯合子雌鼠的生育功能是下降的,而实验未发现KO杂合子雌鼠的生殖功能有下降,这说明FMR1基因的完全缺失可能才会影响其生殖功能,其具体机制有待于进一步研究。
KO纯合子雌鼠的生育功能是下降的,那么FMR1基因是通过何种途径来调节其生殖功能的呢?NPY是一种含36个氨基酸的单链肽,与下丘脑神经内分泌功能等生理过程的调节密切相关,NPY可影响下丘脑-垂体-卵巢轴的活动,对排卵前LH峰的形成有促进作用,NPY表达的下降可引起LH峰形成不良,从而影响排卵。NPY还可影响Ca2+的浓度而调节卵巢的血流,从而影响卵泡的发育。本研究发现在KO鼠的中枢神经系统中,下丘脑室周核、正中隆起、下丘脑外侧区、弓状核、背侧区及腹内侧核均可见NPY阳性细胞的表达,正中隆起、下丘脑弓状核及背侧区这些与生殖调节密切相关的区域,其NPY表达更强烈,3种基因型雌鼠其NPY表达部位无明显不同,经统计,KO纯合子雌鼠下丘脑NPY的表达弱于WT雌鼠,这提示FMR1基因可能是通过下调NPY的表达来调节雌鼠生殖功能的。
GABA是中枢神经系统重要的抑制性神经递质,通过下丘脑-垂体-性腺轴影响垂体和性腺的生理机能,也可以通过多巴胺系统抑制LH和PRL的分泌,对生殖功能有重要的调节作用。本研究发现GABA阳性细胞在下丘脑弓状核、室周核、腹内侧核背部和腹部以及下丘脑背侧区均有表达。在下丘脑弓状核和室周核GABA表达更强烈,3种基因型雌鼠其GABA表达部位未见明显不同。经统计,3种基因型雌鼠其下丘脑GABA的表达量差异亦无显著性,提示FMR1基因可能不是直接调节GABA来影响其生殖功能的,而可能是通过GABA受体信号通路。
NPY和GABA在下丘脑均有表达,且在弓状核两者表达均更强烈,NPY和GABA均可调节生殖功能,但NPY和GABA是否可以相互调节从而影响生殖功能,还有待于进一步的研究。本实验初步探讨了FMR1基因的缺失对雌鼠生育功能的影响,下一步将研究FMR1基因是如何调控NPY的表达及GA-BA受体信号通路在KO鼠中的作用。
参 考 文 献:
[1] GANTOIS I, BAKKER CE, REYNIERS E, et al. Restoring thephenotype of fragile X syndrome: insight from the mouse model[J]. Curr Mol Med, 2001, 1(4): 447-455.
[2] BAKKER CE, VERHEIJ C, REYNIERS E, et al. Fmrl knockoutmice: a model to study fragile X mental retardation[J]. Cell, 1994,78(1): 23-33.
[3] XU J, KIRIGITI MA, COWLEY MA, et al. Suppression of basalspontaneous gonadotropin-releasing hormone neuronal activityduring lactation: role of inhibitory effects of neuropeptide Y[J].
Endocrinology, 2009, 150(1): 333-340.
[4] HRABOVSZKY E, MOLNAR CS, NAGY R, et al. Glutamatergicand GABAergic innervation of human gonadotropin-releasing hor-mone-I neurons[J]. Endocrinology, 2012, 153(6): 2766-2776.
[5] MACHADO-FERREIRA MC, COSTA-LIMA MA, BOY RT, eta1. Premature ovarian failure and FRAXA permutation :Positivecorrelation in a Brazilian survey [J]. Am J Med Genet, 2004,126A(3): 237-240.
[6] 邢 州,孙卫文,黄月玲,等.使用 PCR 方法检测 Fmr1 基因敲除小鼠基因型[J].现代医院,2009,9(5):12.
[6] XING Z, SUN WW, HUANG YL, et al . Detection of genotypeof Fmr1 gene Knocked out mice by using PCR[J]. J ModernHosp, 2009, 9(5): 12. Chinese[7] MYERS M, BRITT KL, WREFORD NG, et al. Methods forquantifying follicular numbers within the mouse ovary[J]. Repro-duction, 2004, 127(5): 569-580.
[8] ACOG Committee Opinion. No. 338: Screening for fragile X syn-drome[J]. Obstet Gynecol, 2006, 107(6): 1483-1485.
[9] COFFEE RL JR, TESSIER CR, WOODRUFF EA, et al. FragileX mental retardation protein has a unique, evolutionarily con-served neuronal function not shared with FXR1P or FXR2P[J].Dis Model Mech, 2010, 3(7-8): 471-485.
[10] 祝亚桥,周 兴,陈盛强.FMR1 基因敲除对雄性小鼠生殖功能的影响[J].实用医学杂志,2012,28(4):564-567.
[10] ZHU YQ, ZHOU X, CHEN SQ. The influence of FMR1 geneknockout on the reproduction of male mice[J]. Journal of Prac-tical Medicine, 2012, 28(4): 564-567. Chinese[11] 戴丽军,廖 军,黄月玲,等.Fmr1 基因敲除小鼠血清雌性激素含量的比较研究[J].中国比较医学杂志,2006,16(8):459-462.
[11] DAI LJ, LIAO J, HUANG YL, et al . FSH, LH, E2 and P inblood serum of Fmr1 knockout mouse and FVB mouse[J]. Chi-nese Journal of Comparative Medicine, 2006, 16(8): 459-462.
Chinese[12] CHAMBERS AP, WOODS SC. The role of neuropeptide Y inenergy homeostasis[J]. Handb Exp Pharmacol, 2012(209): 23-45.
[13] KLENKE U, CONSTANTIN S, WRAY S, et al. Neuropeptide Ydirectly inhibits neuronal activity in a subpopulation of go-nadotropin-releasing hormone-1 neurons via Y1 receptors [J].Endocrinology, 2010, 151(6): 2736-2746.
[14] KEATOR CS, CUSTER EE, HOAGLAND TA, et al. Evidencefor a potential role of neuropeptide Y in ovine corpus luteumfunction[J]. Domest Anim Endocrinol, 2010, 38(2): 103-114.
[15] ROA J, HERBISON AE. Direct regulation of GnRH neuron ex-citability by arcuate nucleus POMC and NPY neuron neuropep-tides in female mice[J]. Endocrinology, 2012, 153(11): 5587-5599.
[16] NAKAYAMA Y, HATTORI N, OTANI H, et al. Gam-ma-aminobutyric acid (GABA)-C receptor stimulation increasesprolactin(PRL) secretion in cultured rat anterior pituitary cells[J].Biochem Pharmacol, 2006, 71(12): 1705-1710.
[17] HEMOND PJ, O'BOYLE MP, ROBERTS CB, et al. SimulatedGABA synaptic input and L-type calcium channels form func-tional microdomains in hypothalamic gonadotropin-releasing hor-mone neurons[J]. J Neurosci, 2012, 32(26): 8756-8766.





