摘 要: 还原型谷胱甘肽(glutathione, GSH)是细胞抗氧化防御系统的主要成分,具有维持细胞正常代谢、调节机体免疫应答等重要生理功能。GSH在调节肺上皮细胞功能和控制炎症过程中发挥着关键作用。本文对GSH的抗氧化、控制炎症等生理功能,抗细菌感染、抗病毒等临床应用,以及其在肺部炎症和损伤中的潜在作用作一综述。
关键词: 谷胱甘肽; 氧化应激; 肺部炎症;
Abstract: As a major component of the cellular antioxidant defense system, glutathione(GSH) has important physiological functions such as maintaining normal cellular metabolism and regulating immune response. GSH plays a key role in regulating lung epithelial cell function and controlling inflammatory processes. This review describes the physiological functions of GSH such as antioxidation and inflammation control, clinical applications including antimicrobial and antiviral effects, as well as its potential role in lung inflammation and injury.
Keyword: glutathione; oxidative stress; lung inflammation;
由诺贝尔奖获得者、英国皇家学会会长Hopkins在1921年发现的谷胱甘肽(glutathione),是一种由谷氨酸、半胱氨酸和甘氨酸组成的三肽,所有器官均可合成。谷胱甘肽有还原性谷胱甘肽(γ-glutamylcysteinylglycine,GSH)和氧化型谷胱甘肽(GSSG)两种存在形式,还原型和氧化型谷胱甘肽的比例(GSH/GSSG)常被用作细胞毒性或细胞抗氧化能力的评估因子。

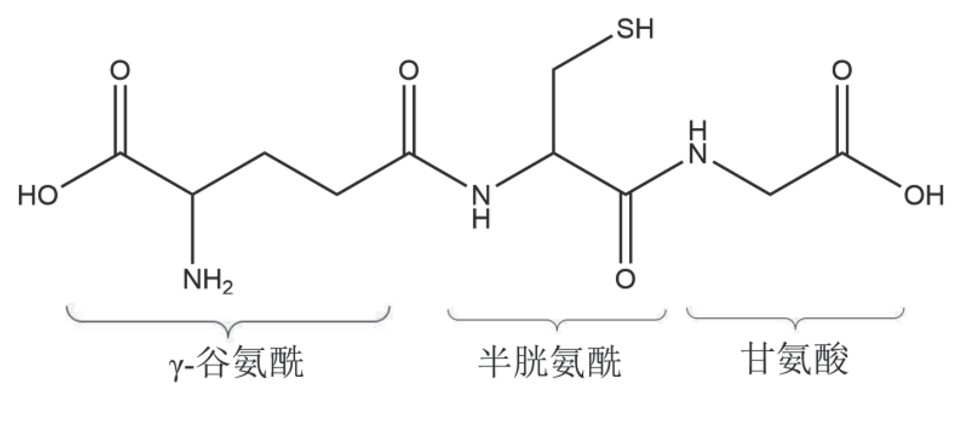
还原型谷胱甘肽,即γ-谷酰半胱氨酰甘氨酸,分子式为C10H17O6SN3,相对分子质量为307.33,等电点为5.93,作为一种非蛋白巯基分子,有很强的供电子或质子氢的能力。GSH作为特定酶的辅酶,具有清除自由基、修饰蛋白质、保护细胞膜中含巯基的蛋白质和酶不被氧化、二硫键交换反应催化剂、信号转导等功能[1]。性别、年龄和生理条件等许多因素都可能影响GSH水平,谷胱甘肽-血红蛋白也被用作氧化应激的标志物[2]。GSH的这些特点决定了其在生物体内发挥重要的生理作用,如抗氧化应激、解毒排毒、消除炎症、抗辐射损伤、参与氨基酸的转运吸收抗衰老作用等,因此,GSH被广泛应用于医药等领域[3,4,5,6]。
1 、谷胱甘肽:一种内源性活性肽
还原型谷胱甘肽在人体中起到重要的代谢调节作用。GSH在肝脏内合成最多,广泛分布于人体各组织内,胞内浓度相对较高(>0.5 mmol)[1],在包括红细胞在内的许多细胞中其浓度可高达10 mmol[5]。谷胱甘肽具有两个主要结构:巯基(SH)基团和y-谷氨酰键。作为活细胞抗氧化防御系统的主要非蛋白硫醇成分,谷胱甘肽不仅是细胞内含量最高的非蛋白硫醇,也是含量最高的γ-谷氨酰化合物。
谷胱甘肽(图1)的生物合成由连续两步的酶催化反应组成,其原料为谷氨酸、半胱氨酸和甘氨酸(三种人体内均可合成的氨基酸),由腺苷三磷酸(adenosine triphosphate,ATP)供能,并需要Mg2+作激活剂[7,8]。谷氨酰胺首先被跨膜氨基酸转运蛋白ASCT2转运至胞内,由谷氨酰胺酶GLS1/2水解形成谷氨酸。半胱氨酸可以直接被氨基酸转运体ASC转运至胞内,胱氨酸进入胞内后经过还原反应也能够生成半胱氨酸。甘氨酸则由甘氨酸转运体GlyT吸收进入细胞内。谷胱甘肽的合成受多种因素影响,其中包括γ-GCS水平、γ-GCS催化亚基和调节亚基的比例、半胱氨酸和谷胱甘肽水平对γ-GCS的负反馈抑制作用[7,8]。
谷胱甘肽生物合成的第一步是由γ-谷氨酸-半胱氨酸合成酶γ-GCS催化半胱氨酸与谷氨酸反应生成γ-谷氨酰半胱氨酸,该步骤是谷胱甘肽生物合成的限速步骤,γ-GCS亚基的表达具有组织特异性,肾脏中表达水平最高,其表达还受到氧化剂、炎症反应和抗炎因子等因素的调节[1,9],生理条件下胞质中约有80%的γ-GCS会与GSH结合,呈无活性状态[8];第二步则在谷胱甘肽合成酶GS的催化下,γ-谷氨酰半胱氨酸与甘氨酸结合生成谷胱甘肽。肾脏是血浆GSH在人体中的主要代谢器官,GSH降解的两个重要水解酶——γ-谷氨酰转移酶GGT和双肽酶DP都位于肾小管刷状缘膜上。γ-谷氨酰转移酶GGT是唯一能水解这一特定基团的水解酶。胞外的GSH与GGT活性位点结合后会被降解为L-谷氨酰胺和胱甘氨酸或半胱甘氨酸,然后在双肽酶DP的催化下进一步水解为谷氨酸、半胱氨酸、胱氨酸和甘氨酸。这些氨基酸或二肽则会被细胞吸收来合成新的GSH,该循环能够防止细胞内GSH耗竭[10]。
图1 谷胱甘肽化学结构
2、 GSH的生理功能
2.1、 抗氧化
GSH的抗氧化功能主要依赖于参与细胞抵抗活性氧(reactive oxygen species,ROS)的酶催化途径。ROS是由氧诱发的,具有一个不配对电子的原子和原子团,包括含氧的高活性分子,如超氧阴离子自由基、羟自由基、单线激发态氧、过氧化氢和过氧化物,化学性质十分活泼。ROS是细胞正常氧化代谢的产物,线粒体是细胞氧化呼吸的部位,同时也是ROS产生的主要部位。ROS是许多生理生化过程的重要参与者,其生成和消除之间的动态平衡对于保持良好的生理环境意义重大。当正常氧化还原平衡状态被破坏时,会引起氧化应激反应。虽然在正常情况下细胞能够应承受轻微的氧化应激反应,但严重的氧化应激会对碳水化合物、脂质、蛋白质和DNA进行破坏,引起生物膜损伤、酶活性丧失、DNA断裂、DNA复制错误等氧化性损伤,甚至导致细胞死亡,所以维持细胞氧化还原的平衡对细胞命运至关重要。
GSH系统就是ROS的重要抗氧化屏障之一。两分子GSH可在谷胱甘肽过氧化物酶GPX的作用下氧化为一分子的GSSG,同时将有毒的有氧代谢产物过氧化物还原为无毒的羟基化合物,从而保护细胞膜的结构和功能免受过氧化物的干扰和损伤。GSSG在谷胱甘肽还原酶的作用下还原成GSH,同时将递氢体NADPH氧化为NADP+,从而形成一个氧化还原循环,避免氧化损伤[9,11]。这种相互转化的循环可以使细胞中的自由基能持续被消除。另外,酵母细胞还能够调配更多的NADPH促进ROS和O2与成对的GSH发生化学反应,GSH被氧化成GSSG的同时,ROS和O2被还原,从而更好地应对氧化应激[12]。
细胞内GSH含量还能够调控谷胱甘肽S-转移酶(glutathione S-transferase,GST)基因的表达。当胞内GSH水平较低时,ROS会激活调控元件ARE,诱导GST家族表达水平的上调[13]。GST不仅可以抑制微粒体过氧化反应,还是一种重要的抗氧化酶,该家族中的GST-α能够催化过氧化脂肪酸的还原,GST-σ能够将前列腺素H2转化为有抗氧化作用的前列腺素E2[14]。GST的表达受细胞氧化还原状态的影响,同时GST也是一个通过调节压力激酶通路将细胞氧化还原状态传输给细胞凋亡机制的传感器[15]。
2.2、 解毒排毒
谷胱甘肽是谷胱甘肽过氧化物酶和谷胱甘肽S-转移酶GST的特有底物,是一个复杂的多方面解毒酶系统的核心,它的解毒功能主要是通过这两种酶来完成的。GSH为多种反应提供还原能力,在过氧化氢、超氧化物和单分子氧等自由基的解毒反应中起着关键作用,通过其巯基与自由基结合转化成容易代谢的酸类物质,而加速自由基的代谢[4]。谷胱甘肽不仅能够清除ROS,而且对有毒性的下游产物也具有防御功能。另外,GSH还能够帮助代谢外源毒性物质。在多种与三肽相互作用的外源性物质(包括药物)的解毒过程中,外源毒性物质先经肝脏细胞色素P-450代谢酶系氧化,随后GST催化GSH巯基与亲电化合物共价结合,使其失活并增加其可溶性,最终以硫醚氨酸的形式随尿液和粪便排出体外[5]。
2.3、 调节免疫反应和控制炎症
GSH在固有免疫和获得性免疫中都扮演着重要角色,不仅能够调节中性粒细胞和树突细胞的活性,还能调控T细胞增殖和活性。Th细胞即辅助性T细胞(helper T cell),在与抗原呈递细胞(antigenpresenting cells,APC)提供的抗原肽的刺激和不同细胞因子的诱导下分化为Th1和Th2细胞。Th1细胞主要介导细胞毒性和局部炎症有关的免疫应答,辅助抗体生成,参与细胞免疫及迟发型超敏性炎症的发生,而Th2可辅助B淋巴细胞分化为抗体分泌细胞,参与体液免疫应答。GSH水平通过调节细胞因子模式以及抗原呈递细胞的细胞环境[16],从而控制Th1/Th2平衡。GSH耗竭会导致Th2反应占优势,抑制淋巴细胞CD8+和细胞毒性淋巴细胞功能,并激活CD4+T淋巴细胞,导致炎症/免疫介导性疾病[17]。多种炎性病变和免疫失调症均与GSH胞内水平变化、Th1/Th2平衡发生漂移有关,包括类风湿性关节炎、自身免疫性甲状腺炎、肌萎缩侧索硬化症、艾滋病、阿尔茨海默病、酒精性肝病、白内障和急性呼吸窘迫综合征等。
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是临床上常见的危重症,据国内外报道死亡率高达38.5%~70%[18,19,20]。ARDS的主要病理特征为弥散性肺泡上皮以及肺部毛细血管严重损伤,从而严重影响患者的呼吸功能,引发呼吸衰竭,临床表现为顽固性低氧血症,晚期多并发器官损害、心功能衰竭,最终导致死亡[21]。根据致病因素ARDS可分为肺源性和肺外源性两种,肺内因素包括严重肺部炎症、肺挫伤、误吸等,其中肺炎是引起直接肺损伤的最常见原因,而肺外因素则有脓毒血症、手术创伤等导致的间接性肺部损伤。两份对重症监护房患ARDS致病因素及致死率的分析均表明[22,23],所有病例中肺外源性ARDS的发病率及死亡率均更高,但是严重炎症感染患者更容易发生肺源性ARDS。同时临床研究表明,SARS-CoV-2病毒感染诱导的低氧血症会导致心肌细胞酸中毒和氧化应激,是引起心肌细胞变性坏死的重要原因[24],COVID-19患者中有16.7%出现心律失常[25],7.2%的病人出现急性心肌损伤,而10.5%的患者最终死于心脏疾病[26]。ARDS病理生理学机制与炎症反应的失控密切相关。研究表明,ARDS的发生发展是由肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、白介素1(interleukin-1,IL-1)、IL-2、IL-6和IL-8等促炎因子与抗炎因子的失衡导致的[27],当患者的血浆和肺泡灌洗液中炎症因子浓度相对较高时,ARDS患者的病死率也相应增高[21,28]。ARDS患者肺泡上皮细胞和血管内皮细胞损伤,当肺泡上皮细胞凋亡、血管内皮细胞功能失调时,血管通透性增加,炎性细胞及蛋白液渗出,最终导致肺泡腔内巨噬细胞NF-κB激活[29],释放IL-1、IL-6、TNF-α等炎症因子[29],肺泡腔内中性粒细胞聚集并活化被激活,活化的中性粒细胞分泌ROS等因子进一步攻击肺泡细胞及血管内皮细胞,形成一个恶性循环。
G S H作为还原剂能够消除胞内的R O S,将NF-κB留在细胞质当中,阻止其入核诱导IL-1,IL-6和TNF-α等促炎症细胞因子的转录表达[9,30,31]。GSH在体内外实验中均展现出了消除炎症的效果,包括了减少炎症因子表达、减轻炎症细胞的产生、聚集等。楮先秋等[32]在化脓性心包炎中发现,心肌组织氧自由基增多,GSH与维生素E能够有效减少心肌损害。盛鹰等[33]在探讨GSH对严重创伤患者全身炎症反应综合征治疗作用的研究中证实,GSH可明显降低患者血清中炎症介质如TNF-α、IL-6、IL-8、C-反应蛋白水平,改善严重创伤全身炎症反应综合征患者的预后。
2.4、 调节蛋白质功能
除了为细胞提供一个还原环境和维持蛋白质处于还原状态外,越来越多的证据显示,GSH也能够起到修饰蛋白质和调节蛋白质的功能。GSH可将S-亚硝基化半胱氨酸残基和硫酸盐转化为相对稳定的混合二硫化物。高效液相色谱法(high performance liquid chromatography,HPLC)分析表明,超过85%的蛋白质S-硫醇化反应是与GSH结合的[4],这种S-硫醇化被特别地称为S-谷氨酰化或S-谷胱甘肽化修饰。S-谷胱甘肽化修饰一般发生在蛋白质中的半胱氨酸残基,这些残基通常位于酶催化中心或蛋白质与蛋白质的连接部位[34],可逆地与GSH结合形成混合二硫化物。蛋白质S-谷氨酰化能够缓冲氧化应激的影响、稳定胞外蛋白,防止蛋白质关键半胱氨酸残基被不可逆氧化以及控制酶活性与转录[35,36,37]。
尽管S-谷胱甘肽化的蛋白质在蛋白质组中占比不高,但目前动物细胞中发现的许多种S-谷胱甘肽化的蛋白质都承担着不同的重要作用,主要是参与碳水化合物/能源物质的多种代谢途径的酶和某些一类细胞骨架蛋白,还包括转录翻译、蛋白质折叠、自由基清除的相关蛋白。如葡萄糖-6-磷酸脱氢酶和丙酮酸激酶是糖代谢的重要催化酶,核仁磷酸蛋白参与核糖体蛋白质的组装,参与信号转导的鸟苷酸环化酶,作为伴侣蛋白参与蛋白酶体降解的亲环素,参与蛋白质分解代谢的胰蛋白酶以及热休克蛋白60(heat shock protein 60,HSP60)和HSP70。另外,GSH也广泛存在于人血浆中,与血清蛋白形成混合二硫化物[36]。一些蛋白质会在细胞内氧化还原电位的变化以及ROS和活性氮的压力下被GSH化[36]。比如,单核细胞进行吞噬作用呼吸爆发产生过氧化氢,或内皮细胞被暴露在双酰胺等水溶性刺激物当中时,其中的甘油醛-3-磷酸脱氢酶会发生S-谷胱甘肽化修饰并抑制该酶的活性[38,39]。高糖血症、高胰岛素血症造成的氧化应激均会大大增加患者血红蛋白的GSH修饰水平[40]。肌细胞和心脏组织中的肌酸激酶和磷酸化酶b在循环氧化应激过程中也是S-谷氨酰化的目标。
2.5、 氨基酸跨膜转运
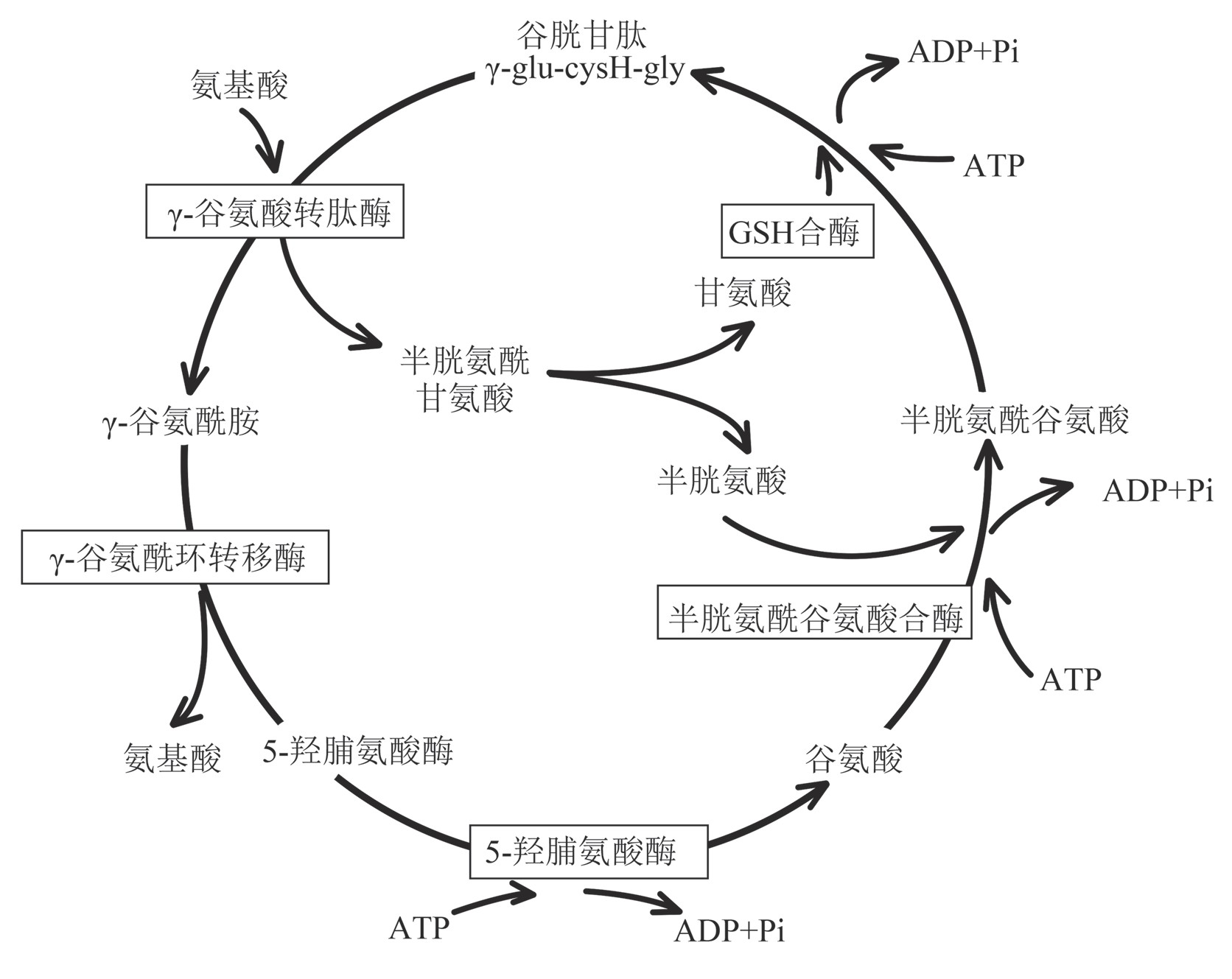
谷胱甘肽合成和利用的一系列酶反应,被称为γ-谷氨酰循环。γ-谷氨酰循环由六步酶催化反应组成,如图2所示。GSH在肾细胞质膜外侧的γ-谷氨酰转肽酶催化下,将γ-谷氨酰转移到受体氨基酸上,并生成半胱氨酰甘氨酸[41]。之后,生成的γ-谷氨酰氨基酸在γ-谷氨酰环转移酶的作用下被其他器官的细胞重新吸收生成中间产物5-羟脯氨酸,同时释放出转运的游离氨基酸[42]。5-羟脯氨酸与ATP在5-羟脯氨酸酶的作用下进一步生成谷氨酸,紧接着作为原料参与GSH的两步合成反应,从而形成一个循环。γ-谷氨酰循环也是哺乳动物介导氨基转运的系统之一[1]。
3、 GSH在医学上的应用
3.1、 GSH的抗氧化作用
GSH是机体内一种强抗氧化剂,具有很好的消除自由基的作用。它是机体所含的非蛋白巯基化合物中含巯基数最高、量最多的化合物。巯基能清除多种自由基,参与细胞的防御机制,包括细胞解毒及细胞的损伤与修复等,在维持机体内环境自身稳定方面起着关键的作用[43]。GSH可以作为GSH过氧化物酶的底物,抑制脂质过氧化,保护细胞膜,恢复细胞功能。可保护细胞内含巯基酶(如ATP酶)的活性,恢复已被破坏的酶分子中巯基的活性功能,防止因巯基氧化而导致的蛋白质(如血红蛋白)变性,减少自由基对DNA的攻击,从而减少DNA的损伤和突变。GSH对于放射线、放射性药和由于抗肿瘤药物所引起的血细胞减少等症状可起到强有力的保护作用。GSH还能纠正乙酰胆碱及胆碱酯酶的不平衡,起到抗过敏的作用,并可缓解因缺氧血症、恶心及肝脏疾病等引起的不适,抑制乙醇侵害肝脏产生脂肪肝,防止皮肤色素沉积,改善皮肤光泽,改善性功能及治疗眼角膜疾病[44]。还原性GSH可防治放疗所致的口腔炎,还可在化疗及肿瘤栓塞化疗后使用,起到护肝作用。对于急性肝肾损害,甚至肝肾功能障碍,GSH均有良好的疗效[45,46]。
图2 γ-谷氨酰循环
由于溶解度、吸收效率和稳定性等因素的影响,直接口服GSH给药的表观半衰期在60~120 min之间,并且GSH水平会在4 h内恢复到基础水平[47],对提高细胞GSH水平的效果有限,但是一些GSH的衍生物和前体则能够弥补这些不足。
3.2、 GSH的抗菌作用
谷胱甘肽可以通过多种不同的机制参与控制细胞内的细菌感染。首先,它能够作为一氧化氮的载体。一氧化氮是一种重要的抗菌分子,但其在体内会被很快地转化成没有杀菌效果的硝酸盐和亚硝酸盐。然而GSH可与一氧化氮反应生成S-亚硝基谷胱甘肽(s-nitrosoglutathione,GSNO)[48],大大增加其在体内的稳定性。GSNO随后可再将一氧化氮释放出来,杀死病原体。在小鼠中,5 mmol GSNO即可对结核分枝杆菌的生长有显着杀灭作用[49]。
除了作为载体稳定一氧化氮之外,GSH本身对于分岐杆菌属是有毒的[50],故其具有直接的抗分岐杆菌活性。GSH还可以通过调节巨噬细胞的反应和改变感染巨噬细胞分泌的细胞因子,帮助巨噬细胞控制细胞内细菌感染。Connell等[51]在诱导型一氧化氮合酶基因NOS2敲除小鼠中发现GSH能够显着地抑制细胞内卡介苗的生长。实验证明,单核细胞衍生巨噬细胞中,GSH在生理浓度下即可对一种致命的结核杆菌菌株H37RV起到抑制作用[52]。另外,GSH还可以提高自然杀伤细胞(natural killer cell,NK)细胞活性,使其表达相应的细胞表面配体从而诱导被感染的细胞启动凋亡。Kasai等[53]在GM1抗体对体内自然杀伤活性细胞的影响的研究中发现,使用GSH的前体N-乙酰半胱氨酸(N-acetyl-cysteine,NAC)能够显着地提高NK细胞的溶细胞活性。GSH还能够降低促炎细胞因子(IL-1、TNF-α和IL-6)的水平。Verhasselt等[54]发现,使用NAC能够显着减少体外感染结核杆菌的全血培养物中的促炎症细胞因子数量。
3.3、 GSH的抗病毒作用
GSH能够维持细胞还原态,通过抑制病毒的复制和减少组织损伤来保护机体抵御病毒。GSH还能够改变细胞因子的释放,从而促进Th细胞向在机体抗胞内病原体感染中发挥重要作用的Th1细胞分化。细胞内氧化还原状态在调节病毒的生命周期和传染性中起着关键作用,包括1-型单纯疱疹病毒、仙台病毒和HIV在内的各种病毒感染的体内外实验均出现了细胞氧化应激和胞内GSH水平的降低[50]。在感染人类免疫缺陷病毒(HIV)或丙型肝炎病毒患者的细胞和体液中,及感染流感病毒的小鼠的肺部都可以观察到GSH水平的下降。
Alsuwaidi等[55]在小鼠实验中发现肺部感染甲型流感病毒后细胞呼吸将被抑制,细胞内ATP爆发式增长,谷胱甘肽含量减少并最终会触发细胞凋亡。有研究表明,B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)基因高表达的细胞往往有更高的GSH含量,Bcl-2/GSH能够通过抑制血凝素、基质蛋白等病毒晚期蛋白的表达以及病毒核糖核蛋白的核质易位,抑制病毒在此类细胞中的复制。同时,GSH还能够抑制病毒诱导产生的caspase激活和Fas上调,从而避免细胞凋亡的发生[56,57,58]。Prinarakis等[59]研究证实了S-谷胱甘肽化作为一种翻译后修饰也参与控制了与病毒感染相关的细胞信号传导途径。在基孔肯雅病毒感染的细胞内,病毒诱导产生的氧化应激可以导致蛋白质发生谷胱甘肽化修饰,从而影响病毒蛋白的功能[60]。
由于RNA病毒感染组织和细胞均可能导致氧化应激,抗氧化剂的应用在一定程度上能够对抗病毒感染或感染相关症状。GSH作为一种含量较高的内源性抗氧化剂,在体内经分解只生成无毒性的氨基酸,具有一定的安全性。GSH在细胞和体内实验中均展现出了抗病毒活性。以流感病毒为例,随着年龄的增长、人体内GSH含量的下降,Th1细胞因子分泌会逐渐减少,导致免疫系统缺乏有效的Th1反应,削弱了机体抗流感病毒的能力,所以流感病毒对于老年群体的威胁更加显着。有研究证明,N-丁酰GSH(GSH-C4)作为一种更易进入细胞的GSH衍生物,在不同的免疫模型中都能够调控细胞白介素IL-12的分泌从而将免疫反应向Th1型切换[61]。Amatore等[56]在感染甲型流感病毒的老年小鼠模型研究中证实GSH-C4能够抵抗病毒诱导产生的氧化环境,并显着抑制流感病毒在小鼠体内的复制。此外,GSH-C4还能还原宿主细胞蛋白二硫异构酶(protein disulfide isomerase,PDI)以干扰病毒血凝素的成熟。Cai等[58]发现,在接种A/X-31菌株流感病毒的小鼠的饮用水中加入GSH,能够显着降低小鼠肺部及气管匀浆中的病毒滴度。
3.4 、GSH对肺部炎症的作用
肺是人体内唯一一种与外部空气接触的器官,且接触面积较大。肺部上皮细胞持续性地暴露在各种氧化剂当中,相较于其他组织更容易受到氧化损伤,产生炎症反应[8]。同时,呼吸道受到大气颗粒物等成分的刺激或发生细菌、病毒感染时也可导致肺部炎症。肺间质中的炎症细胞活化后又会产生ROS,氧化应激下,ROS能够改变细胞外基质刺激黏液分泌,引起呼吸道上皮细胞损伤,导致支气管敏感和慢性阻塞性肺疾病、特发性肺纤维化、严重呼吸窘迫症以及呼吸功能紊乱、哮喘等疾病[62]。除此之外,活化的炎症细胞还会释放大量的包括TNF-α、IL-1β在内的炎性介质,导致内皮细胞通透性增加、趋化因子的分泌增加,调动免疫系统招募大量炎症细胞到肺部,放大炎症级联反应[30,63]。这种正反馈一旦失控,会引起广泛、强烈的免疫应答,当多种细胞因子爆发性地产生免疫因子风暴时,免疫系统会在杀伤病原体的同时也大量破坏人体自身的细胞,并最终导致自身免疫性疾病,也就是过度免疫。大量研究表明,体内、胞内大量的免疫细胞产生的自由基,是过度免疫产生的主要原因[21,23,26,30,32,63,64]。
包括甲型H1N1流感病毒、SARS病毒在内的多种病毒感染都可导致免疫因子风暴[65],进一步促进了ARDS的发生[66]。2009年H1N1在世界范围内的广泛传播导致了大量死亡,其中有201 200例病人死于呼吸衰竭,占总死亡病例的69%[67]。免疫因子风暴也是此次新冠肺炎(COVID-19)部分患者病情急速加剧的重要原因,导致ARDS、多器官功能衰竭等严重并发症[64]。
GSH能够保护肺部上皮细胞免受氧化剂和炎症的损害[68],也是炎症因子转录调控的关键。存在于下呼吸道中的GSH和GSH相关酶是抵御氧化攻击的第一道防线。GSH是肺上皮细胞衬液中最为丰富的抗氧化剂,也是为数不多的肺部水平高于血浆水平的抗氧化剂之一[69]。这些胞外GSH可以保护肺泡巨噬细胞、肺上皮细胞和肺内皮细胞免受氧化应激[8],高水平的GSH还能够通过NF-κB通路减少肺泡上皮细胞细胞因子和趋化因子的释放,缓解炎症反应[70]。研究表明,向敲除了Gcl调节亚基的小鼠鼻内灌注柴油废气微粒6 h后,肺部TNF-α和IL-6等细胞因子的表达量是野生型的两倍[71]。在体外,GSH可以下调受伯霍尔德杆菌感染的肺上皮细胞炎症因子IL-8、TNF-α与IL-1β的表达[72]。焦桂萍等[73]在肺的缺血再灌注实验中初步证实了GSH能有效抑制TNF-α及细胞间黏附分子-1的释放,减轻中性粒细胞在肺内浸润聚集,对肺有一定的保护作用。雷章等[74]证实GSH能够减轻急性放射性肺损伤大鼠肺组织的炎症,降低支气管肺泡灌洗液中炎症细胞的数量,下调肺组织中IL-6与TNF-αmRNA的表达,降低血清中IL-6与TNF-α的浓度保护肺组织。
但是,由呼吸带来的持续刺激很容易导致肺部GSH和其他抗氧化剂的耗竭[69],许多呼吸系统的非传染性疾病都与肺和肺隔间的GSH水平有关,并伴随着慢性炎症[75]。同时,随着年龄增长,Nrf2核转位的减少也导致GSH的合成能力下降,故老年人患肺病的概率更高。老年小鼠模型中,相较于成年小鼠,其肺上皮细胞衬液GSH水平降低了约50%[76]。在急性肺炎患儿当中,血清GSH水平显着降低,全血脂质过氧化产物增加,而氧化应激又进一步恶化了炎症反应[77]。Li等[47]在大气颗粒物促炎症作用的研究中发现,大鼠气管滴注PM10后,其呼吸道表面的GSH水平显着下降。特发性肺纤维化患者的呼吸道上皮细胞衬液中GSH水平与正常人相比低四倍[78]。多个动物及临床试验表明[56,79,80],GSH及其前体或衍生物对于肺部疾病的治疗具有一定作用。还有研究显示,GSH和白蛋白可在长时间恶劣空气质量条件下维持肺部功能和哮喘稳定,环磷酰胺联合GSH治疗原发性干燥综合征肺间质病变患者疗效明显优于单用环磷酰胺组,且有更高安全性[81]。人Ⅱ型肺泡细胞中,使用GSH可以减少氧化诱导的NF-κB的核转位,缓解炎症反应[82]。此外,使用GSH前体乙酰半胱氨酸(N-acetylcysteine,NAC)也可抑制细胞因子诱导NF-κB激活[83]。实验表明,在大鼠胎儿肺泡上皮细胞中,NAC能够减少NF-κB诱导的TNF-α、IL-1等促炎因子的表达[84]。NAC在治疗特发性肺纤维化、囊性纤维化、有脓毒症的ARDS患者的临床试验中,均表现出了消除炎症的效果[79,85],同时,NAC与其他药物的联合治疗还能够改善特发性肺纤维化患者的肺活量和单次呼吸一氧化碳扩散能力[80]。慢性阻塞性肺病患者使用NAC和N乙酰半胱氨酸的赖氨酸盐治疗均可提高肺泡上皮细胞的细胞内GSH水平,缓解炎症反应[86]。过敏性哮喘小鼠模型中,羰基不带负电的N-乙酰半胱氨酸酰胺分子和谷胱甘肽乙酯都能够缓解小鼠呼吸道炎症和高反应性[87]。
4 、结语
细胞氧化还原状态对蛋白质修饰及信号转导途径的调控、酪氨酸磷酸化/脱磷酸化、转录调控、翻译后蛋白修饰、蛋白分解处理、泛素化等细胞生命活动具有重要意义。GSH作为最丰富的细胞内硫醇化合物,显然在上述过程中起着核心作用。GSH对蛋白质硫醇化修饰和修饰后功能调控的分子机制研究,可能会为慢性炎症、心血管疾病和神经退行性疾病等提供药物开发的新思路。
氧化还原状态的失衡在各种感染性疾病的发病过程中都扮演着重要角色。氧化应激反应会引起组织的炎症和损伤,从而为微生物感染创造有利条件。使用GSH将大大增强免疫细胞功能,控制多种细菌、病毒感染,扭转氧化剂损伤部位氧化剂与抗氧化剂的不平衡,防止组织的进行性损伤。对炎症反应中信号转导和信号传递调控中GSH作用机制的更深入研究,有利于设计新的抗氧化治疗策略,治疗各种炎症性疾病。
综上所述,GSH作为一种内源性活性肽,可以通过清除或中和人体中产生的各种有害过氧化物质和自由基,起到有效的排毒解毒、降低氧化应激反应、调节机体免疫反应和控制炎症的作用,值得临床大力推广和推荐,同时具有深远的研究意义。
参考文献
[1]Meister A,Tate SS.Glutathione and related γ-glutamyl compounds:biosynthesis and utilization.Annu Rev Biochem,1976,45:559-604
[2] Niwa T,Naito C,Mawjood AH,et al.Increased glutathionyl hemoglobin in diabetes mellitus and hyperlipidemia demonstrated by liquid chromatography/electrospray ionization-mass spectrometry.Clin Chem,2000,46(1):82-88
[3] Dilokthornsakul W,Dhippayom T,Dilokthornsakul P.The clinical effect of glutathione on skin color and other related skin conditions:a systematic review.J Cosmet Dermatol,2019,18(3):728-737
[4] Klatt P,Lamas S.Regulation of protein function by S-glutathiolation in response to oxidative and nitrosative stress.Eur J Biochem,2000,267(16):4928-4944
[5]Hayes JD,McLellan LI.Glutathione and glutathionedependent enzymes represent a co-ordinately regulated defence against oxidative stress.Free Radic Res,1999,31(4):273-300
[6] Lv H,Zhen C,Liu J,et al.Unraveling the potential role of glutathione in multiple forms of cell death in cancer therapy.Oxid Med Cell Longev,2019,2019:1-16
[7] Chen Y,Shertzer HG,Schneider SN,et al.Glutamate cysteine ligase catalysis:dependence on ATP and modifier subunit for regulation of tissue glutathione levels.J Biol Chem,2005,280(40):33766-33774
[8] Rahman I,Macnee W.Lug glutathione and oxidative stress:implications in cigarette smoke-induced airway disease.Am J physiol,1999,277(1):1067-1088
[9] Rahman I.Inflammation and the regulation of glutathione level in lung epithelial cells.Antioxid Redox Sign,1999,4(1):227-425
[10]Drozdz R,Parmentier C,Hachad H,et al.gammaGlutamyltransferase dependent generation of reactive oxygen species from a glutathione/transferrin system.Free Radic Biol Med,1998,25(7):786-792
[11]彭春媛,刘江勤.谷胱甘肽的合成、代谢对早产儿脑损伤的影响.医学综述,2019,25(22):4395-4399
[12] Nielsen J.Yeast cells handle stress by reprogramming their metabolism.Nature,2019,572(7768):184-185
[13]庞战军,陈瑗,周玫.谷胱甘肽硫转移酶基因表达的调控.生物化学与生物物理进展,1997(5):401-405
[14]邱近明,徐东波,孙保存,等.前列腺素E2对LDL氧化修饰和巨噬细胞清道夫受体活性的影响.中华病理学杂志,1995(3):165-167
[15] Adler V,Yin Z,Fuchs SY,et al.Regulation of JNKsignaling by GSTp.EMBO J,1999,18(5):1321-1334
[16]Perricone C,De Carolis C,Perricone R.Glutathione:a key player in autoimmunity.Autoimmun Rev,2009,8(8):697-701
[17] Gmunder H,Droge W.Differential effects of glutathione depletion on T cell subsets.Cell Immunol,1991,138(1):229-237
[18]Hughes M,MacKirdy FN,Ross J,et al.Acute respiratory distress syndrome:an audit of incidence and outcome in Scottish intensive care units.Anaesthesia,2003,58(9):838-845
[19] Lu Y,Song Z,Zhou X,et al.A 12-month clinical survey of incidence and outcome of acute respiratory distress syndrome in Shanghai intensive care units.Intensive Care Med,2004,30(12):2197-2203
[20] Rubenfeld GD,Cadwell E,Peabody E,et al.Incidence and outcomes of acute lung injury.N Engl J Med,2005,353(16):1685-1693
[21]罗雪莲.急性呼吸窘迫综合征的治疗进展.临床医药文献电子杂志,2019,6(11):194-195
[22]田炳哲.浅析重症监护病房中急性呼吸窘迫综合征的预后危险因素.中国医学工程,2015,23(4):189,191
[23]葛庆岗,赵建娟,吕旌乔,等.重症监护病房中急性呼吸窘迫综合征的预后危险因素分析.解放军医学杂志,2010,35(06):722-725
[24]陈韵岱,李玉珍,刘秀华,等.新型冠状病毒肺炎心肌损伤的病理生理机制探讨.中国病理生理杂志,2020,36(03):573-576
[25]中华预防医学会新型冠状病毒肺炎防控专家组.新型冠状病毒肺炎流行病学特征的最新认识.中国病毒病杂志,2020:1-7
[26] Wang D,Hu B,Hu C,et al.Clinical characteristics of138 hospitalized patients with 2019 novel coronavirusinfected pneumonia in Wuhan,China.JAMA,2020,323(11):1061
[27] Goodman RB,Pugin J,Lee JS,et al.Cytokine-mediated inflammation in acute lung injury.Cytokine Growth Factor Rev,2004,14(6):523-535
[28]冯志成.血清及支气管肺泡灌洗液中TNF-α、IL-1β、IL-6在急性呼吸窘迫综合症中的变化及意义.现代预防医学,2011,38(18):3804-3805
[29]舒彬,刘真,贾赤宇.急性肺损伤/急性呼吸窘迫综合征与NF-κB信号转导关系的研究进展.中华损伤与修复杂志(电子版),2016,11(2):147-150
[30] Rahman I,Biswas SK,Jimenez LA,et al.Glutathione,stress responses,and redox signaling in lung inflammation.Antioxid Redox Signal,2005,7(1-2):42-59
[31]Tewes F,B?l GF,Brigelius-Floh R.Thiol modulation inhibits the interleukin (IL)-1-mediated activation of an IL-1 receptor-associated protein kinase and NF-κB.Eur JImmunol,2005,27(11):3015-3021
[32]褚先秋,刘斌.化脓性心包炎心肌损害与氧自由基、谷胱甘肽、维生素E相关性的实验研究.中华小儿外科杂志,2001(1):45-47
[33]盛鹰,谢晓洪,王静恩,等.还原型谷胱甘肽对严重创伤患者全身炎症反应综合征的治疗作用.中国医师杂志,2010,12(2):209-211
[34]Dalle-Donne I,Rossi R,Colombo G,et al.Protein S-glutathionylation:a regulatory device from bacteria to humans.Trends Biochem Sci,2009,34(2):85-96
[35]Thomas JA,Poland B,Honzatko R.Protein sulfhydryls and their role in the antioxidant function of protein S-thiolation.Arch Biochem Biophys,1995,319(1):1-9
[36]Cotgreave IA,Gerdes RG.Recent trends in glutathione biochemistry-glutathione-protein interactions:a molecular link between oxidative stress and cell proliferation?Biochem Biophys Res Commun,1998,242(1):1-9
[37]Ziegler DM.Role of reversible oxidation-reduction of enzyme thiols-disulfides in metabolic regulation.Annu Rev Biochem,1985,54:305-329
[38] Ravichandran V,Seres T,Moriguchi T,et al.S-thiolation of glyceraldehyde-3-phosphate dehydrogenase induced by the phagocytosis-associated respiratory burst in blood monocytes.J Biol Chem,1994,269(40):25010-25015
[39] Schuppe-Koistinen I,Moldeus P,Bergma T,et al.S-thiolation of human endothelial cell glyceraldehyde-3-phosphate dehydrogenase after hydrogen peroxide treatment.Eur J Biochem,1994,221(3):1033-1037
[40]Catapano AL,Maggi FM,Tragni E.Low density lipoprotein oxidation,antioxidants,and atherosclerosis.Curr Opin Cardiol,2000,15(5):355-363
[41]段学辉,谢雷波,王锦.谷胱甘肽的应用和酶法生产谷胱甘肽的研究进展.江西科学,2005,5(6):750-753
[42] Wellner VP,Sekura R,Meister A,et al.Glutathione synthetase deficiency,an inborn error of metabolism involving the gamma-glutamyl cycle in patients with5-oxoprolinuria (pyroglutamic aciduria).Proc Natl Acad Sci USA,1974,71(6):2505-2509
[43]Chiaradia E,Avellini L,Rueca F,et al.Physical exercise,oxidative stress and muscle damage in racehorses.Comp Biochem Physiol B Biochem Mol Biol,1998,119(4):833-836
[44]Raghunathan VK,Ellis EM,Tettey JNA,et al.Involvement of reduced glutathione and glutathione reductase in the chronic toxicity of hexavalent chromium to monocytes in vitro.Toxicology,2007,231(2):105-10
[45] Bajic VP,Van Neste C,Obradovic M,et al.Glutathione“redox homeostasis”and its relation to cardiovascular disease.Oxid Med Cell Longev,2019,2019:1-14
[46]曹秀虹,庞惠,赵民生.谷胱甘肽的临床应用进展.中国综合临床,2002,2(9):16-17
[47] Li XY,Gilmour PS,Donaldson K,et al.Free radical activity and pro-inflammatory effects of particulate air pollution (PM10) in vivo and in vitro.Thorax,1996,51(12):1216-1222
[48]吴凯源,张玉英,粟文婷,等.亚硝基化谷胱甘肽还原酶:一个调控炎症反应的新分子.生物化学与生物物理进展,2013,40(8):731-738
[49] Venketaraman V,Dayaram YK,Talaue MT,et al.Glutathione and nitrosoglutathione in macrophage defense against Mycobacterium tuberculosis.Infect Immun,2005,73(3):1886-1889
[50]Morris D,Khurasany M,Nguyen T,et al.Glutathione and infection.Biochim Biophys Acta,2013,1830(5):3329-3349
[51] Dayaram YK,Talaue MT,Connell ND,et al.Characterization of a glutathione metabolic mutant of Mycobacterium tuberculosis and its resistance to glutathione and nitrosoglutathione.J Bacteriol,2006,188(4):1364-1372
[52] Brill KJ,Li Q,Larkin R,et al.Human natural killer cells mediate killing of intracellular Mycobacterium tuberculosis H37Rv via granule-independent mechanisms.Infect Immun,2001,69(3):1755-1765
[53] Kasai M,Yoneda T,Habu S,et al.In vivo effect of antiasialo GM1 antibody on natural killer activity.Nature,1981,291(5813):334-335
[54] Verhasselt V,Vanden BW,Vanderheyde N,et al.N-acetyl-L-cysteine inhibits primary human T cell responses at the dendritic cell level:association with NFkappaBinhibition.J Immunol,1999,162(5):2569-2574
[55]Alsuwaidi AR,Almarzooqi S,Albawardi A,et al.Cellular bioenergetics,caspase activity and glutathione in murine lungs infected with influenza a virus.Virology,2013,446(1-2):180-188
[56] Amatore D,Celestino I,Brundu S,et al.Glutathione increase by the n-butanoyl glutathione derivative(GSH-C4) inhibits viral replication and induces a predominant Th1 immune profile in old mice infected with influenza virus.FASEB BioAdvances,2019,1(5):296-305
[57] Nencioni L,Iuvara A,Aquilano K,et al.Influenza Avirus replication is dependent on an antioxidant pathway that involves GSH and Bcl-2.FASEB J,2003,17(6):758-760
[58]Cai J,Chen Y,Seth S,et al.Inhibition of influenza infection by glutathione.Free Radical Bio Med,2003,34(7):928-936
[59] Prinarakis E,Chantzoura E,Thanos D,et al.S-glutathionylation of IRF3 regulates IRF3-CBP interaction and activation of the IFN beta pathway.EMBO J,2008,27(6):865-875
[60]Saisawang C,Kuadkitkan A,Smith DR,et al.Glutathionylation of chikungunya nsP2 protein affects protease activity.Biochim Biophys Acta Gen Subj,2017,1861(2):106-111
[61]Fraternale A,Paoletti MF,Dominici S,et al.Modulation of Th1/Th2 immune responses to HIV-1 Tat by new proGSH molecules.Vaccine,2011,29(40):6823-6829
[62]Reynaert NL.Glutathione biochemistry in asthma.Biochim Biophys Acta,2011,1810(11):1045-1051
[63]徐兴祥.炎症过程中白细胞募集的分子机制.国外医学.呼吸系统分册,2001,21(1):13-15
[64] Huang C,Wang Y,Li X,et al.Clinical features of patients infected with 2019 novel coronavirus in Wuhan,China.Lancet,2020,10223(395):497-506
[65] Li C,Yang P,Zhang Y,et al.Corticosteroid treatment ameliorates acute lung njury induced by 2009 swine origin influenza A (H1N1) virus in mice.PLoS One,2012,7(8):e44110
[66] Bautista E,Chotpitayasunondh T,Gao Z,et al.Clinical aspects of pandemic 209 influenza A (H1N1) virus infection.N Engl J Med,2010,362(18):1708-1719
[67] Dawood FS,Iuliano AD,Reed C,et al.Estimated global mortality associated with the first 12 months of2009 pandemic influenza A H1N1 virus circulation:a modelling study.Lancet Infect Dis,2012,12(9):687-695
[68]Morrison D,Rahman I,MacNee W.Permeability,inflammation and oxidant status in airspace epithelium exposed to ozone.Respir Med,2006,100(12):2227-2234
[69] Biswas SK,Rahman I.Environmental toxicity,redox signaling and lung inflammation:the role of glutathione.Mol Aspects Med,2009,30(1-2):60-76
[70]Antonicelli F,Parmentier M,Drost EM,et al.Nacystelyn inhibits oxidant-mediated interleukin-8 expression and NF-κB nuclear binding in alveolar epithelial cells.Free Radical Biol Med,2002,32(6):492-502
[71]Weldy CS,White CC,Wilkerson H,et al.Heterozygosity in the glutathione synthesis geneGclm increases sensitivity to diesel exhaust particulate induced lung inflammation in mice.Inhal Toxicol,2011,23(12):724-735
[72] D Orazio M,Pacello F,Battistoni A.Extracellular glutathione decreases the ability of burkholderia cenocepacia to penetrate into epithelial cells and to induce an inflammatory response.PLoS One,2012,7(10):e47550
[73]焦桂萍,赵兵,袁志柳,等.还原型谷胱甘肽对大鼠肺缺血-再灌注后黏附分子-1,肿瘤坏死因子α蛋白表达影响.中国现代医学杂志,2006,16(18):2764-2766
[74]雷章,卢宏达,卢驰,等.还原型谷胱甘肽对大鼠急性放射性肺损伤炎症的影响.中国医院药学杂志,2014,34(17):1449-1453
[75]Gould NS,Day BJ.Targeting maladaptive glutathione responses in lung disease.Biochem Pharmacol,2011,81(2):187-193
[76]Teramoto S,Fukuchi Y,Uejima Y,et al.Age-related changes in the antioxidant screen of the distal lung in mice.Lung,1994,172(4):223
[77] Cemek M,Caksen H,Lu FB,et al.Oxidative stress and enzymic-non-enzymic antioxidant responses in children with acute pneumonia.Cell Biochem Funct,2006(24):269-273
[78]DeLeve LD,Kaplowitz N.Importance and regulation of hepatic glutathione.Semin Liver Dis,1990,10(4):251-266
[79] Tirouvanziam R,Conrad CK,Bottiglieri T,et al.Highdose oral N-acetylcysteine,a glutathione prodrug,modulates inflammation in cystic fibrosis.Proc Natl Acad Sci USA,2006,103(12):4628-4633
[80] Demedts M,Behr J,Buhl R,et al.High-dose acetylcysteine in idiopathic pulmonary fibrosis.N Engl JMed,2005,353(21):2229-2242
[81]鲁雅琴,宋焱峰,侯一平.还原型谷胱甘肽对大鼠局灶性脑梗死后丙二醛、谷胱甘肽过氧化物酶、超氧化物歧化酶表达的影响.中国康复理论与实践,2006,06(11):923-925
[82]Rahman I,Mulier B,Gilmour PS,et al.Oxidantmediated lung epithelial cell tolerance:the role of intracellular glutathione and nuclear factor-kappaB.Biochem Pharmacol,2001,62(6):787-794
[83] Blackwell TS,Blackwell TR,Holden EP,et al.In vivo antioxidant treatment suppresses nuclear factor-kappa B activation and neutrophilic lung inflammation.JImmunol,1996,157(4):1630-1637
[84] Haddad JJ,Olver RE,Land SC.Antioxidant/pro-oxidant equilibrium regulates HIF-1alpha and NF-kappa Bredox sensitivity.Evidence for inhibition by glutathione oxidation in alveolar epithelial cells.J Biol Chem,2000,275(28):21130-21139
[85] Suter PM,Domenighetti G,Schaller MD,et al.N-acetylcysteine enhances recovery from acute lung injury in man.A randomized,double-blind,placebocontrolled clinical study.Chest,1994,105(1):190-194
[86]Gillissen A,Nowak D.Characterization of N-acetylcysteine and ambroxol in anti-oxidant therapy.Resp Med,1998,92(4):62
[87] Koike Y,Hisada T,Utsugi M,et al.Glutathione redox regulates airway hyperresponsiveness and airway inflammation in mice.Am J Resp Cell Mol,2007,37(3):322-329





