摘要:以溶菌酶为分离对象, 将海藻酸钠溶液滴入CaCl2溶液中使其快速完成凝胶反应形成微球, 研究各种条件对其溶菌酶吸附容量的影响。结果表明, 当海藻酸钠溶液浓度为2% (w/v) 、CaCl2溶液浓度为2% (w/v) 、Ca2+交联时间为90min、溶菌酶溶液pH为6时, 所得海藻酸钠微球对溶菌酶的吸附容量最大, 达到了57.56mg/g海藻酸钠。将该微球用于鸡蛋清中蛋白质的吸附, 蛋白质的吸附量达到了69.47mg/g海藻酸钠。因此, 海藻酸钠微球在溶菌酶的分离纯化中具有较强的应用前景。
关键词:海藻酸钠; 微球; 吸附; 溶菌酶;
作者简介: 甄天元 (1975—) , 男, 山东济宁人, 硕士, 讲师, 研究方向:食品保鲜技术, E-mail:tianyuan82877@163.com; *黄国清 (1978—) , 男, 湖北荆州人, 博士、副教授, 研究方向:微囊化技术, E-mail:hgqfood@qau.edu.cn;
收稿日期:2019-04-10
基金: 山东省重点研发计划 (医用食品) 项目 (2018YYSP013); 山东省自然科学基金重大基础研究项目 (ZR2018ZC0945); 国家自然科学基金面上项目 (31571890);
Study on the Adsorption of Lysozyme by Sodium Alginate Microspheres and Its Application
ZHEN Tianyuan ZHANG Peizhi HAN Rongwei WANG Jun HOU Xiudan XIAO Junxia HUANG Guoqing
College of Food Science and Engineering, Qingdao Agricultural University
Abstract:In this paper, lysozyme was used as the object of separation.Sodium alginate solution was dropped into CaCl2 solution to rapidly complete the gel reaction to form microspheres, and the effects of various conditions on the lysozyme adsorption capacity were studied.Results showed that when sodium alginate solution of 2% (w/v) , CaCl2 solution of 2% (w/v) , Ca2+crosslinking time for 90 min, lysozyme solution pH of 6.0, the sodium alginate microspheres of lysozyme adsorption capacity was the largest, reached 57.56 mg/g sodium alginate.The microspheres were used for protein adsorption in egg whites, and the amount of protein adsorbed reached 69.47 mg/g sodium alginate.Therefore, sodium alginate microspheres have a strong application prospect in the separation and purification of lysozyme.
Keyword:sodium alginate; microspheres; adsorption; lysozyme;
Received: 2019-04-10
溶菌酶广泛存在于自然界中,高等动物组织及其分泌物、植物及各种微生物中均可检测到溶菌酶的存在,但是其在鸡蛋清液中的含量最为丰富[1]。溶菌酶对革兰氏阳性菌具有很强的抑制作用,并且还具有消炎、抗病毒等功效,因此在食品及医药领域具有广泛用途[2]。
目前,工业上分离溶菌酶的方法主要有阳离子交换树脂吸附、亲和层析、盐析、直接结晶、超滤等一系列方法[3],但是近年来复凝聚反应在酶分离中的应用开始引起人们的关注。
复凝聚反应是指当两种带相反电荷的聚电解质在溶液中共存时通过静电相互作用而发生相分离产生沉淀的过程[4]。由于聚电解质之间的静电相互作用只在一定的pH值范围内发生,因此可以利用这种专一性对生物大分子进行分离纯化。分离纯化过程中,将与目标分子带相反电荷的聚电解质加入到溶液中,调节pH值使其与目标分子发生复凝聚反应形成沉淀,通过离心分离或者过滤收集聚电解质复合物,即可以达到浓缩和分离目标分子的目的[5],目前复凝聚反应已被用于木瓜蛋白酶[6]、菠萝蛋白酶[7]、胰凝乳蛋白酶[8]和脂肪酶[9]的分离纯化。与传统的盐析沉淀和有机溶剂沉淀技术相比,复凝聚反应在酶分离中具有聚电解质用量少、对酶活性影响小、操作简便、环保等显着优点,因此被认为是一种极具工业化应用前景的蛋白质预分离和浓缩技术[10]。
利用复凝聚反应进行酶的分离时,在得到聚电解质复合物沉淀后通常还需要使沉淀重新溶解并进行进一步分离才将得到纯度较高的产物,这在一定程度上增加了复凝聚反应在分离中的复杂性。针对这一不足,本文拟采用海藻酸钠微球作为聚阴离子从溶液中吸附溶菌酶,吸附完成后通过改变pH值或离子强度即可将溶菌酶解吸附,同时海藻酸钠微球还可循环利用,因此可大大提高复凝聚反应在酶分离中的效率。本文有望为复凝聚反应在溶菌酶分离中的应用提供一定的参考。
1 材料和方法
1.1试验材料
海藻酸钠(AR),天津津东天正精细化学试剂厂;考马斯亮蓝G250(AR)、氯化钙(AR),天津广成化学试剂有限公司;溶菌酶(BR),泰兴市东圣食品科技有限公司。
1.2试验仪器
BSA323S-CW电子天平:德国Sartarius公司;90-3恒温磁力搅拌器:上海亚荣生化仪器厂;Delta320pH计:梅特勒-托利多公司;HH-2数显恒温水浴锅:龙口市先科仪器公司;7200分光光度计:尤尼柯(上海)仪器有限公司。
1.3试验方法
1.3.1影响海藻酸钠微球溶菌酶吸附容量的因素
1.3.1.1海藻酸钠浓度的影响
配制浓度分别为1%、1.5%、2%、2.5%、3%(w/v)的不同浓度的海藻酸钠溶液,各取10mL上述溶液,用14号针头按照30滴/min的速度滴加到30mL pH值自然的、浓度为2%(w/v)的CaCl2溶液中,滴完后静置30min,将形成的微球全部捞出,用去离子水反复冲洗后将微球全部放入30mL浓度为1mg/mL的溶菌酶溶液中静置吸附90min,完成后测定溶菌酶的吸附容量。
1.3.1.2 CaCl2溶液浓度的影响
配制浓度为2%(w/v)的海藻酸钠溶液。取10mL上述溶液,用14号针头按照30滴/min的速度分别滴加到30mL pH值自然的、浓度为1%、1.5%、2%、2.5%和3%的CaCl2(w/v)溶液中,滴完后静置30min,将形成的微球捞出,用去离子水反复冲洗后全部放入30mL浓度为1mg/mL的溶菌酶溶液中静置吸附90min,完成后测定溶菌酶的吸附量。
1.3.1.3 Ca2+交联时间的影响
配制浓度为2%(w/v)的海藻酸钠溶液。取10mL上述溶液,用14号针头按照30滴/min的速度分别滴加到30mL pH值自然、浓度为2%的CaCl2(w/v)溶液中,滴完后分别静置30min、60min、90min、120min,静置完成后将形成的微球捞出,用去离子水反复冲洗后全部放入30mL浓度为1mg/mL的溶菌酶溶液中静置吸附90min,完成后测定溶液中的溶菌酶含量,计算吸附容量。
1.3.1.4吸附时间的影响
配制浓度为2%(w/v)的海藻酸钠溶液。取10mL上述溶液,用14号针头按照30滴/min的速度分别滴加到30mL pH值自然、浓度为2%的CaCl2(w/v)溶液中,滴完后静置90min,静置完成后将形成的微球全部捞出,用去离子水反复冲洗后放入30mL浓度为1mg/mL的溶菌酶溶液中静置吸附,吸附时间分别为30min、60min、90min、120min,完成后测定溶液中的溶菌酶含量,计算吸附容量。
1.3.1.5溶菌酶溶液pH值的影响
配制浓度为2%(w/v)的海藻酸钠溶液。取10mL上述溶液,用14号针头按照30滴/min的速度分别滴加到30mL pH值自然的、浓度为2%CaCl2(w/v)溶液中,滴完后静置90min,静置完成后将形成的微球捞出,用去离子水反复冲洗后放入30mL pH值分别为3、4、5、6、7、8、9、10、11的浓度为1mg/mL的溶菌菌溶液中静置吸附120min,完成后测定溶液中的溶菌酶含量,计算吸附容量。
1.3.2溶菌酶含量的测定和吸附容量的计算
吸取吸附完成前后的溶菌酶溶液各1mL,分别加入5mL考马斯亮蓝溶液于试管,充分震荡,在5~10 min内进行595nm下吸光度的测定,根据BSA标准曲线得到相应的蛋白含量。吸附容量(a)按以下公式计算:
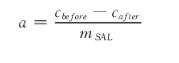
式中:cbefore指吸附前溶液中溶菌酶的量,mg;cafter指吸附后溶液中溶菌酶的量,mg;mSAL指制备凝胶微球所用海藻酸钠的量,g。
1.3.3应用试验
1.3.3.1鸡蛋清溶液的配制
在蛋清溶液中加入蛋清液体积两倍的蒸馏水,搅匀,初次过滤除去不溶性杂质和絮状蛋白,加入重量浓度为5%~10%的酸来调节溶液的pH,使蛋清溶液pH保持在4~5之间,静置15~20min,再次过滤除去静置产生的沉淀,对滤液进行水浴加热,使滤液温度达到75~80℃,使杂蛋白受热变性而沉淀,静置冷却至室温,继续静置不少于10h,之后过滤除去生成的沉淀得到上清液。
1.3.3.2蛋白质的吸附
配制浓度为2%(w/v)的海藻酸钠溶液。取10mL上述溶液,用14号针头按照30滴/min的速度分别滴加到30mL pH值自然、浓度为2%的CaCl2(w/v)溶液中,滴完后静置90min,静置完成后将形成的微球捞出,用去离子水反复冲洗后放入30mL pH值为6的鸡蛋清溶液中,静置吸附120min,测定吸附前后溶液中的蛋白质含量,计算吸附量。
1.3.3.3吸附量的测定
分别取吸附前后的蛋清液1mL,加入5mL考马斯亮蓝溶液充分震荡,5~10min内在595nm下进行吸光度的测定,根据BSA标准曲线计算得出相应蛋白含量,根据1.4中的公式计算吸附量。
1.4数据处理
本论文中所有实验数据均有三个平行,最终数值以平均值±标准差形式表示,用OriginPro Portable作图,用SPSS 16.0统计软件对数据(t检验)进行显着性分析,当p<0.05时认为差异显着。
2 结果与分析
2.1海藻酸钠溶液浓度对微球溶菌酶吸附容量的影响
海藻酸钠溶液浓度对相应微球溶菌酶吸附容量的影响如图1所示。当海藻酸钠溶液浓度由1%增加至2%时,溶菌酶的吸附容量随着海藻酸钠溶液浓度的升高而增大,其数值从35.67mg/g海藻酸钠上升至48.54mg/g海藻酸钠;当海藻酸钠溶液浓度进一步增加时,相应微球对溶菌酶的吸附容量显着下降,在海藻酸钠溶液浓度为3%时仅为30.1mg/g海藻酸钠。这表明海藻酸钠溶液浓度过高并不利于溶菌酶的吸附。这可能是由于当海藻酸钠浓度过高时微球的结构过于致密,影响了溶液中溶菌酶向微球内部的迁移,从而导致溶菌酶的吸附量开始下降;另外,当浓度超过2%时海藻酸钠处于过量状态也可能是吸附容量下降的另一原因。
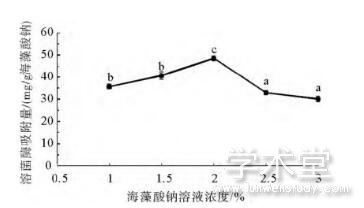
图1 海藻酸钠溶液浓度对微球溶菌酶吸附容量的影响
Fig.1 Effect of sodium alginate solution concentration on the lysozyme adsorption capacity of resultant microspheres
2.2 CaCl2溶液浓度对海藻酸钠微球溶菌酶吸附容量的影响
CaCl2溶液浓度对相应海藻酸钠微球溶菌酶吸附容量的影响情况如图2所示。与海藻酸钠溶液浓度的影响类似,当CaCl2溶液浓度由1%增加至2%时,海藻酸钠凝胶微球对溶菌酶的吸附容量从33.65mg/g海藻酸钠增加到45.1mg/g海藻酸钠;但是当CaCl2溶液浓度进一步增加时,微球对溶菌酶的吸附容量开始下降,且在3%时仅为28.66mg/g海藻酸钠。这可能是由于当CaCl2溶液浓度过高时,与海藻酸钠凝胶微球的交联过于致密,使得溶菌酶无法大量进入到海藻酸钠微球内部,从而导致吸附容量下降。这一结果与吴文果[1]研究团队的发现一致。
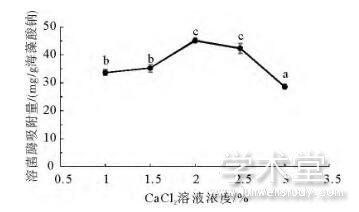
图2 CaCl2浓度对海藻酸钠微球溶菌酶吸附容量的影响
Fig.2 Effect of CaCl2concentration on the lysozyme adsorption capacity of sodium alginate microspheres
2.3 CaCl2交联时间对海藻酸钠微球溶菌酶吸附容量的影响
CaCl2交联时间对海藻酸钠微球溶菌酶吸附容量的影响如图3所示。当交联时间范围为30~90min时,随着交联时间的延长,相应微球对溶菌酶的吸附容量从36.18mg/g海藻酸钠增加到49.4mg/g海藻酸钠;但是当交联时间进一步延长时,海藻酸钠微球对溶菌酶的吸附容量开始降低,当交联时间为120min时降至42.61mg/g海藻酸钠,其原因与CaCl2溶液浓度(图2)的影响一致。
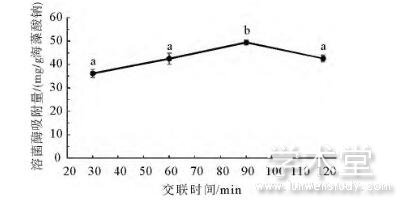
图3 CaCl2交联时间对海藻酸钠微球溶菌酶吸附容量的影响
Fig.3 Effect of CaCl2crosslinking time on the lysozyme adsorption capacity of sodium alginate microspheres
2.4吸附时间对海藻酸钠微球溶菌酶吸附容量的影响
吸附时间对溶菌酶吸附容量的影响结果如图4所示。在本文选择的时间范围内,海藻酸钠微球对溶菌酶的吸附容量随着吸附时间的延长而增加。当吸附时间为30min时,溶菌酶的吸附容量为33.32mg/g海藻酸钠;当吸附时间延长至2h后,海藻酸钠微球对溶菌酶的吸附量达到了57.17mg/g海藻酸钠。这可能是由于海藻酸钠微球致密的网络结构会在一定程度上影响溶菌酶向微球内部的渗透,需要足够长的时间才能使溶菌酶充分扩散至微球内部。由于吸附时间过长时会有酶活性降低及微生物污染的风险,在后续研究中选择120min为最佳吸附时间。
2.5溶液pH值对海藻酸钠微球溶菌酶吸附容量的影响
海藻酸钠对溶菌酶的吸附是基于静电吸引,而pH值会影响两者的荷电性质和电荷密度,因此会对两者之间的相互作用造成重要影响。由图5可知,当体系pH值为3时,海藻酸钠微球对溶菌酶的吸附容量为25.93mg/g海藻酸钠;当pH值增加至6时,吸附容量达到最大值57.56mg/g海藻酸钠;当反应体系pH值进一步增加时,吸附容量随之显着降低,当pH值为11时仅为30.00mg/g海藻酸钠。这表明,在本文确定的条件下,海藻酸钠从溶液中吸附溶菌酶的最适pH值为6,此时两者的静电相互作用最为强烈、溶菌酶的回收率最高。
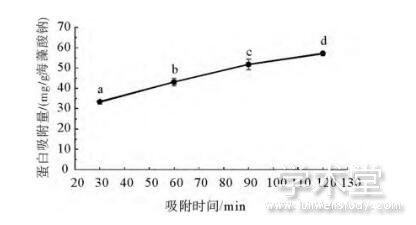
图4 吸附时间对海藻酸钠微球溶菌酶吸附容量的影响
Fig.4 Effect of adsorption time on the lysozyme adsorption capacity of sodium alginate microspheres
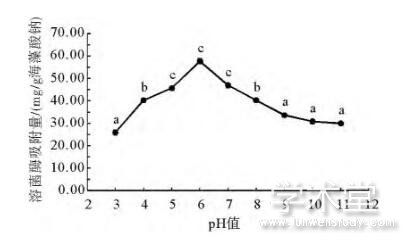
图5 pH值对海藻酸钠微球溶菌酶吸附容量的影响
Fig.5 Effect of pH on the lysozyme adsorption capacity of sodium alginate microspheres
2.6应用研究
本文还就在最适条件下得到的海藻酸钠微球对鸡蛋清中蛋白质中的吸附情况进行了研究,以便为其在溶菌酶分离中的应用提供依据,结果如表1所示。
由表1可知,海藻酸钠微球吸附前鸡蛋清溶液中的蛋白质含量为1 200μg/mL,而经最佳条件下制备的海藻酸钠微球吸附后蛋白质含量降至736.86μg/mL,表明海藻酸钠微球可有效的从原料中吸附蛋白质;另外,微球中海藻酸钠对蛋白质的吸附容量达到了69.47mg/g海藻酸钠,高于其对纯溶菌酶的吸附容量,表明鸡蛋清中很多杂蛋白也参与了该吸附过程,因此在后续研究中还需要采取进一步的措施以减少杂蛋白的吸附。
表1 海藻酸钠微球对鸡蛋蛋清溶液中蛋白质的吸附情况

3 结论
本文就海藻酸钠凝胶微球对溶菌酶的吸附条件进行了研究,结果发现,海藻酸钠凝胶微球吸附溶菌酶的最佳条件为海藻酸钠溶液浓度为2%、CaCl2溶液浓度为2%、固定化时间为90 min、吸附时间为120min、溶菌酶溶液pH值为6,在此条件下,海藻酸钠凝胶微球对溶菌酶的吸附容量最大可以达到57.56mg/g海藻酸钠。将该微球用于鸡蛋清中蛋白质有吸附,其吸附容量达到了69.47mg/g海藻酸钠,表明海藻酸钠微球可有效的吸附鸡蛋清溶液中的蛋白质,但是还需对吸附条件进行优化以提高溶菌酶的吸附量和纯度。
参考文献
[1]马正智, 胡国华, 方国生.我国溶菌酶的研究与应用进展[J].中国食品添加剂, 2007, (2) :177-182
[2]林向阳, 何承云, 阮榕生, 等.溶菌酶及其应用研究[J].中国食品添加剂, 2005, (6) :103-106
[3]宋亦超.膜乳化法制备具有显影和载药功能的海藻酸钙微球的研究[D].杭州:浙江大学, 2012
[4]HwangDS, Waite JH, Tirrell M.Promotion of osteoblast proliferation on complex coacervation-based hyaluronic acid-recombinant mussel adhesive protein coatings on titanium[J].Biomaterials, 2010, 31 (6) :1080-1084
[5]Xu Y, Mazzawi M, Chen K, et al.Protein purification by polyelectrolyte coacervation:influence of protein charge anisotropy on selectivity[J].Biomacromolecules, 2011, 12 (5) :1512-1522
[6]BraiaM, Ferrero M, Rocha MV, et al.Bioseparation of papain from Carica papaya latex by precipitation of papain-poly (vinyl sulfonate) complexes[J].Protein Expression and Purification, 2013, 91 (1) :91-95
[7]CamposDA, Woitovich valetti N, Oliveira A, et al.Platform design for extraction and isolation of Bromelain:complex formation and precipitation with carrageenan[J].Process Biochemistry, 2016.54:156-161
[8]Woitovich ValettiN, Lombardi J, Boeris V, et al.Precipitation of chymotrypsin from fresh bovine pancreas usingι-carrageenan[J].Process Biochemistry, 2012, 47 (12) :2570-2574
[9]BassaniG, Farruggia B, PicóG.Cationic polyelectrolytes-lipases complexes formation as tool for recovery of these enzymes from their natural sources[J].International Journal of Biological Macromolecules, 2011, 49 (3) :351-355
[10]Woitovich Valetti N, Brassesco ME, PicóGA.Polyelectrolytes-protein complexes:a viable platform in the downstream processes of industrial enzymes at scaling up level[J].Journal of Chemical Technology&Biotechnology, 2016, 91 (12) :2921-2928
[11]吴文果, 刘伟, 王士斌, 等.海藻酸钙/聚精氨酸微胶囊的载药和缓释性能[J].化工进展, 2014, 33 (5) :1271-1275





