摘 要: 目的:利用整合生物信息学手段分析EZH2(enhancer of zeste 2 polycomb repressive complex 2subunit)基因在乳腺癌中的表达及其临床意义。方法:在肿瘤基因组计划数据库(The Cancer Genome Atlas,TCGA)中下载乳腺癌与正常乳腺组织的基因表达谱数据,进一步利用Ualcan数据库和人类蛋白质图谱(The Human Protein Atlas)数据库数据分析EZH2基因在乳腺癌中的mRNA及蛋白表达水平。利用Ualcan数据库分析EZH2基因的甲基化水平并筛选其共表达基因;对EZH2及其共表达基因进行GO(Gene Ontology)富集分析和KEGG通路分析以明确EZH2的共表达基因参与的生物学过程和相关通路;使用Kaplan-Meier生存分析法分析乳腺癌患者的总生存期、无病生存期、无远处转移生存期及后进展生存期与EZH2基因表达水平的关系并绘制生存曲线。结果:与正常乳腺组织相比,EZH2在乳腺癌组织中的mRNA及蛋白表达量明显升高。而EZH2的甲基化程度在乳腺癌组织与正常乳腺组织中则差异不明显。同时,EZH2的表达水平与年龄、乳腺癌分期及乳腺癌分子分型等因素密切相关。EZH2及其共表达基因主要参与了核碱基的调节、细胞周期调控、染色体分离、DNA复制、DNA修复等生物学过程,并参与了细胞周期、DNA复制、M/G1期转化、M期、有丝分裂前中期、ATM通路等生物学通路。此外,EZH2基因表达水平高的乳腺癌患者的总生存期、无病生存期、无远处转移生存期及后进展生存期均明显低于EZH2基因低表达的患者。结论:EZH2在乳腺癌组织中高表达并且与患者不良预后密切相关。同时,EZH2的表达水平与乳腺癌的发生、发展密切相关。EZH2在乳腺癌诊断、靶向治疗及预后分析中具有重要的临床意义。
关键词: 乳腺癌; EZH2; TCGA; 生物标志物; 生物信息学分析;
Abstract: Objective:To analyze the expression and roles of enhancer of zeste 2 polycomb repressive complex 2 subunit(EZH2)in breast cancer(BC)via integrated bioinformatics analysis.Methods:The expression data of EZH2 in normal breast tissues and BC tissues were downloaded from The Cancer Genome Atlas(TCGA)database.The mRNA and protein levels of EZH2 in BC tissues were analyzed using Ualcan online tool and The Human Protein Atlas database,respectively.Gene Ontology(GO)and KEGG analyses were conducted for the co-expressed genes of EZH2.Kaplan-Meier plotter database was used to analyze the prognostic value of EZH2 in BC patients.Results:The mRNA and protein levels of EZH2 were significantly overexpressed in BC tissues compared to normal breast tissues.However,the DNA methylation status of EZH2 showed no significantly difference between BC patients and normal controls.Besides,the level of EZH2 in BC tissues was significantly different in patients from different subgroups.The GO and KEGG analyses showed that EZH2 and its co-expressed genes in BC were closely associated with regulation of nucleobase,regulation of cell cycle,chromosome segregation,DNA replication,ATM pathways,and other related pathways.Importantly,high expression of EZH2 predicted poor survival rates in BC patients.Conclusion:Our results showed that the EZH2 was highly expressed in BC and predicted poor survival of BC patients.Moreover,EZH2 might play a significant role in the development and progression of BC,thus it could be utilized as a biomarker and therapeutic target for diagnosis,prognosis,and treatment of BC.
Keyword: breast cancer; EZH2; TCGA; biomarker; bioinformatics;
乳腺癌(breast cancer,BC)是一种严重威胁人类健康的恶性肿瘤性疾病,其病死率在各类肿瘤中位居前列[1,2]。乳腺癌具有易转移复发、恶性程度高、增殖速度快等特点[2]。近年来,许多研究表明乳腺癌的发生发展伴随着众多基因表达水平的紊乱,但其机制尚不清楚[3,4]。此外,由于乳腺癌进展迅速、发病隐匿,导致多数患者失去早期手术根治的机会[5]。再者,部分患者容易对常规的化疗药物产生耐受性,导致乳腺癌患者的治疗效果不佳[6,7]。因此,挖掘并筛选乳腺癌相关的诊断及预后标志物对于提高乳腺癌患者的诊疗及生存具有重要意义。同时,对关键分子机制的研究和分析也有助于提高乳腺癌患者的靶向治疗成功率,进而提高患者的生存质量。
果蝇zeste基因增强子的人类同源物 2(enhancer of zeste 2 polycomb repressive complex 2 subunit,EZH2)基因位于人类染色体7q35上,EZH2基因可编码一种名为组蛋白赖氨酸N-甲基转移酶的生物酶,进而参与DNA的甲基化修饰并抑制其他基因的转录调控[8,9]。近年来,研究发现EZH2可参与调节包括胃癌、前列腺癌、恶性胶质瘤、结直肠癌在内的多种肿瘤的发生发展[10,11]。因而,EZH2有望成为肿瘤诊断和预后分析的新的标志物分子,甚至有望成为肿瘤靶向治疗的新的有效靶点[10,12]。EZH2主要参与肿瘤的增殖、转移、血管生成等恶性肿瘤生物学过程[9]。目前,EZH2基因在乳腺癌中的研究较少。因此,本课题拟通过整合生物信息学手段分析EZH2在乳腺癌中的表达水平及其对乳腺癌诊治和预后的价值。
1 、资料与方法
1.1 、数据来源
本文所分析数据来自肿瘤基因组计划数据库(The Cancer Genome Atlas,TCGA)中的乳腺癌数据集[13]。乳腺癌数据集包含114例正常乳腺组织的基因表达数据和1 097例原发性乳腺癌组织的基因表达数据。依据性别划分,乳腺癌患者中包含男性12例,女性1 075例;依据年龄划分,21~40岁患者97例,41~60岁患者505例,61~80岁患者431例,81~100岁患者54例;依据乳腺癌分期划分,则包含乳腺癌Ⅰ期患者183例,Ⅱ期患者615例,Ⅲ期患者247例,Ⅳ期患者20例。由于部分患者的性别、年龄、分期信息缺失,故未纳入相应分组中统计分析。
1.2 、研究方法
本文使用 Ualcan(http://ualcan.path.uab.edu)工具分析TCGA数据库中EZH2基因在乳腺癌组织和正常乳腺组织中mRNA表达差异及其甲基化水平的差异[14]。利用人类蛋白质图谱(The Human Protein Atlas)数据库(http://www.proteinatlas.org/)分析EZH2在乳腺癌组织和正常乳腺组织中的蛋白表达差异[15]。进一步依据性别、年龄、肿瘤分期等因素分组分析EZH2表达水平与上述因素的关系。筛选与EZH2相关表达的基因群并对其使用DAVID在线工具(http://sgk.hztsg.com:8081/rwt/ZGZW/https/MSRYM4LEF3YGG4LGMN3GMLUHN75A/)和FunRich(Version 3.1.3)工具进行 GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析[16]。最后,使用 Kaplan-Meier法分析EZH2基因表达水平与乳腺癌患者的总生存期、无病生存期、无远处转移生存期及后进展生存期之间的关系并绘制生存曲线[17]。
1.3 、统计学方法
本文中EZH2基因的表达水平以四分位数及箱线图形式表示,箱线图的中间线为该基因表达的中位数。在文章中,基因表达数据以“中位数(四分位间距)”,即M(P25,P75)的形式表示。其中,两组独立样本数据的比较使用Student's t-test检验,多组数据间的比较使用秩和检验。GO富集分析及KEGG通路分析使用Fisher精确检验法。生存分析使用Kaplan-Meier法绘图并采用Log-rank检验比较基因表达水平对患者预后的影响。P<0.05认为差异具有统计学意义。
2 、结果
2.1、 EZH2在乳腺癌组织及正常乳腺组织中的表达情况
通过分析EZH2的mRNA表达发现,乳腺癌组织中 EZH2的mRNA表达水平明显高于正常乳腺组织(图1A,P<0.001)。EZH2在正常乳腺组织中的转录本表达量(transcript per million,TPM)为2.906(1.73,4.56),其在乳腺癌组织中的转录本表达量则为12.32(8.01,18.96)。The Human Protein Atlas数据库中的免疫组化结果显示,EZH2在乳腺癌组织中的蛋白表达水平高于正常乳腺组织(图1B)。
图1 EZH2基因在正常乳腺组织与乳腺癌组织中的表达水平
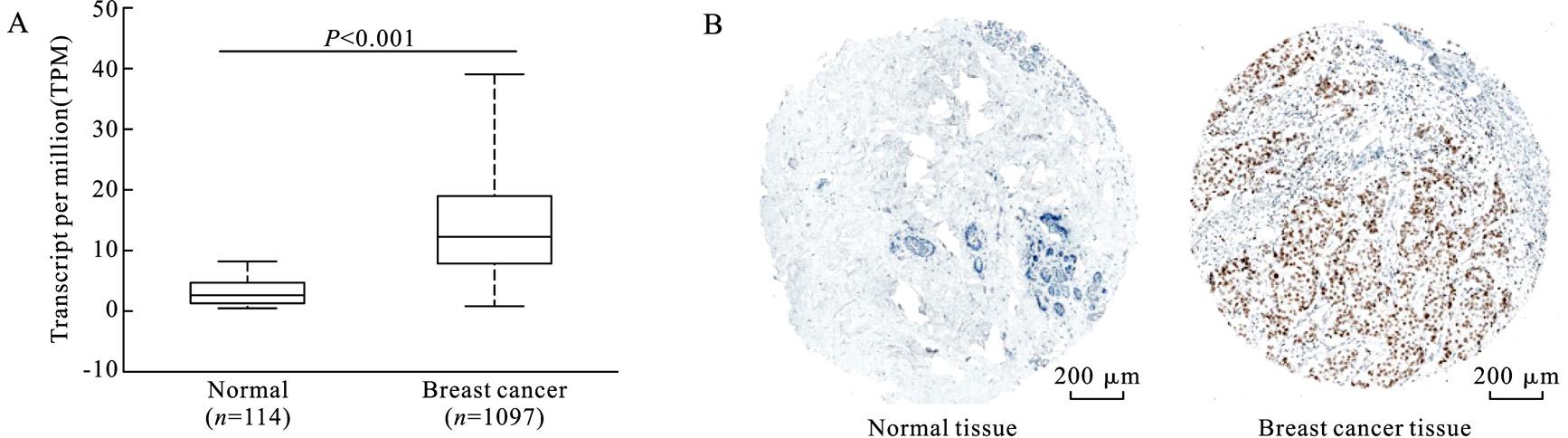
Fig.1 Expression level of EZH2 in BC tissues compared to normal breast tissues
A:mRNA水平(转录本表达情况);B:蛋白水平(免疫组化染色)。
A:mRNA expression levels(transcript expression).B:Protein expression levels(immunohistochemistry staining).
2.2、 EZH2 在乳腺癌患者不同分组中的表达情况
分组分析显示,EZH2基因在女性乳腺癌患者中的转录本表达量为12.55(9.98,16.96),在男性患者中的表达量为12.32(8.00,18.96),二者的表达量均高于正常乳腺组织,但二者的表达水平没有显着差异(图2A)。依据乳腺 癌分期来看,EZH2在乳腺 癌Ⅰ期组织中的表达量为10.70(6.75,15.91), 在乳腺癌Ⅱ期组织中的表达量为13.02 (8.42,19.61), 在乳腺癌Ⅲ期组织中的表达量为12.67 (8.38,18.78), 在乳腺癌Ⅳ期组织中的表达量为 10.65(8.02,20.43),上述分期患者的乳腺癌组织中EZH2表达量均高于正常乳腺组织(P<0.001,图2B)。此外,EZH2 的表达水平在乳腺癌Ⅰ期与Ⅱ期之间存在统计学差异(P<0.05)(图2B)。依据年龄分组来看,EZH2基因在21~40岁组的乳腺癌组织中表达量为16.95(9.27,25.73), 在41~60岁组的表达 量为13.06(8.51,19.92), 在61~80岁组的表达 量为11.58(7.48,17.69),在 81~100岁组的表达量为11.26(7.29,18.55)。其中,EZH2 的表达在21~40岁组与61~80岁组(P<0.001)、21~40岁组与81~100岁组(P<0.01)、41~60 岁组与 61~80岁组(P<0.001)及41~60岁组与 81~100岁组(P<0.05)均存在统计学差异(图2C)。
图2 EZH2 基因在不同分组的乳腺癌组织中的表达水平
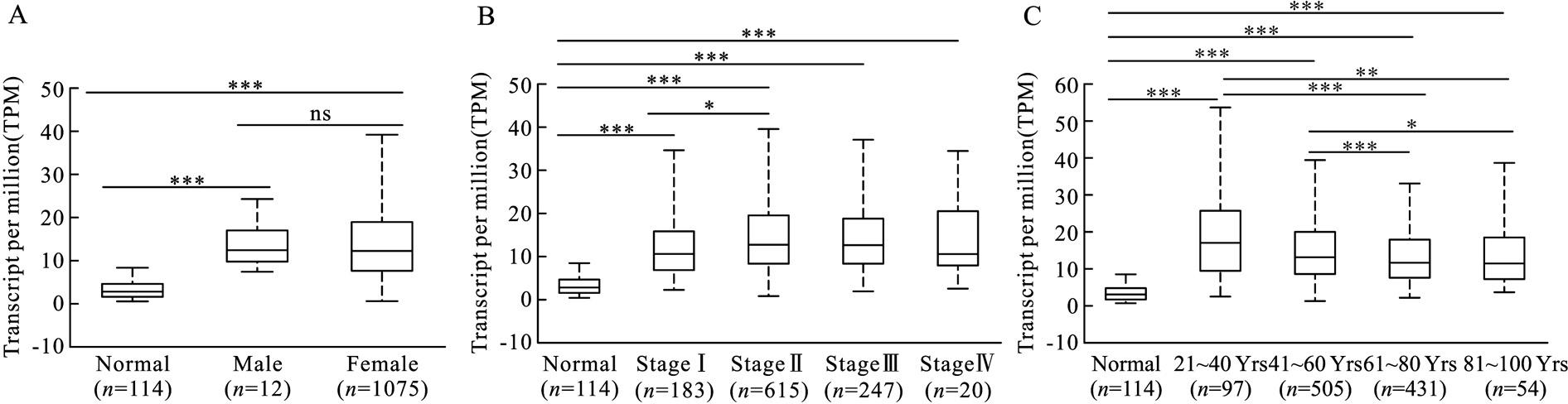
Fig.2 Subgroup analysis of expression levels of EZH2 in BC tissues compared to normal breast tissues
A:不同性别的乳腺癌患者中EZH2基因的表达水平;B:不同分期的乳腺癌患者中EZH2基因的表达水平;C:不同年龄组乳腺癌患者中EZH2基因的表达水平。*P<0.05,**P<0.01,***P<0.001,ns表示P>0.05。
A:Expression levels of EZH2 in BC tissues compared to normal breast tissues according to gender.B:Expression levels of EZH2 in BC tissues compared to normal breast tissues according to the stage.C:Expression levels of EZH2 in BC tissues compared to normal breast tissues according to age.*P<0.05,**P<0.01,***P<0.001.ns means P>0.05.
2.3、 EZH2在不同分子分型的乳腺癌中的表达情况
鉴于不同病理类型乳腺癌的发病机制不同,我们进一步分析了EZH2在不同分子分型乳腺癌中的表达水平。结果显示,EZH2在Luminal型乳腺癌、HER-2阳性乳腺癌及三阴性乳腺癌(TNBC)中的表达均高于正常乳腺组织(图3A)。EZH2表达水平在HER-2阳性和阴性的乳腺癌中的表达没有显着差异(图3B)。依据雌激素受体(ER)表达来看,EZH2在ER阴性的乳腺癌组织中表达高于ER阳性的乳腺癌组织 (图3C)。依据孕激素受体(PR)表达来看,EZH2在PR阴性的乳腺癌组织中表达高于PR阳性的乳腺癌组织(图3D)。此外,EZH2在TNBC患者中的表达高于非TNBC(图3E)。
2.4、 EZH2在乳腺癌组织及正常乳腺组织中的甲基化情况
基于TCGA 数据库中的乳腺癌样本数据分析发现,EZH2基因的甲基化水平在乳腺癌组织及正常乳腺组织中差异不明显(P>0.05,图4)。EZH2基因在正常乳腺组织中的甲基化Beta值为0.07(0.06,0.08),在乳腺癌组织中的甲基化Beta值为0.06(0.06,0.07)。
图3 EZH2在不同分子分型的乳腺癌中的表达情况
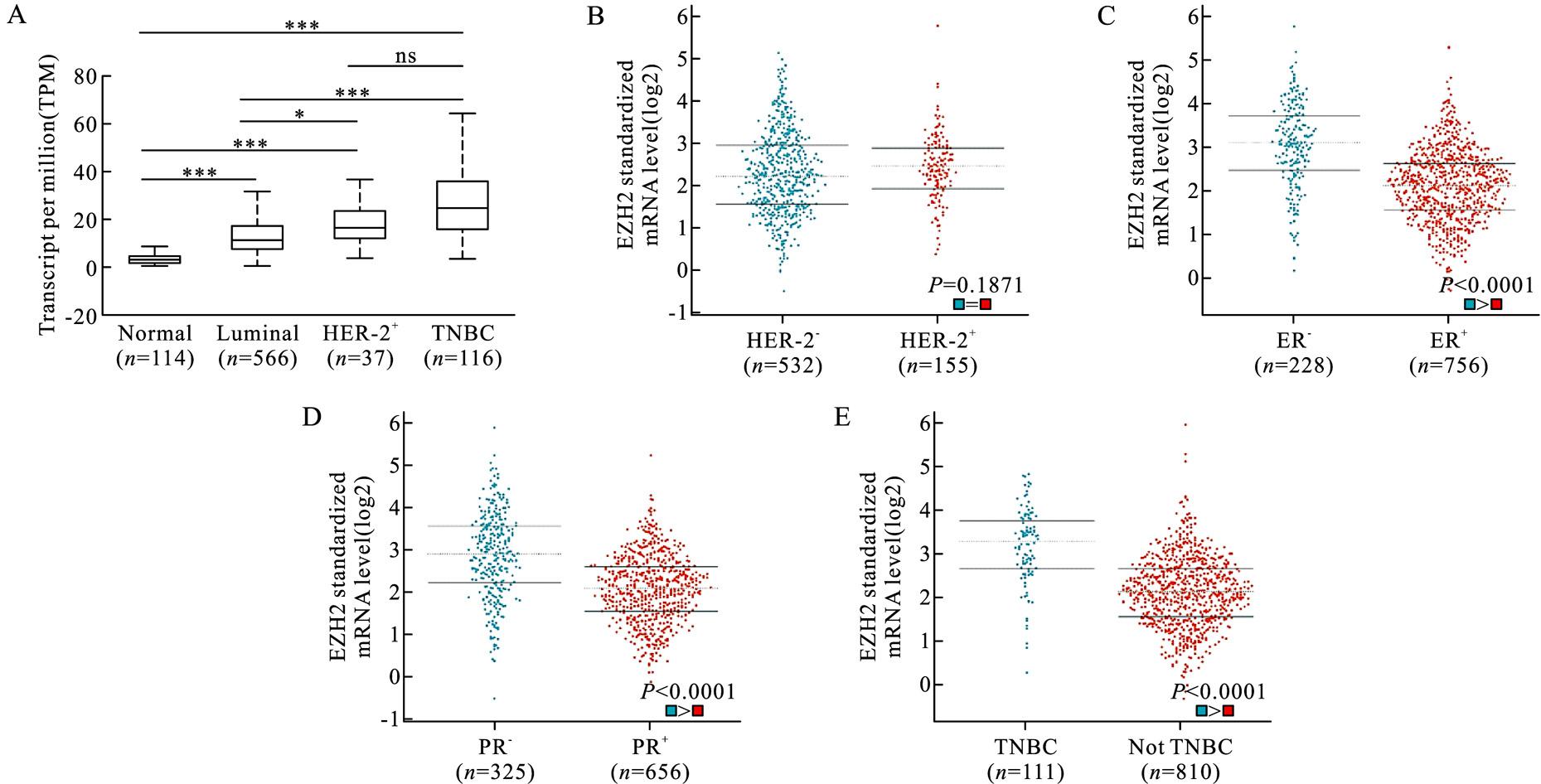
Fig.3 Expression levels of EZH2 in BC tissues according to molecular subtype
A:不同分子分型的乳腺癌患者中EZH2基因的表达水平(*P<0.05,***P<0.001,ns表示P>0.05);B:EZH2基因在HER-2阴性和HER-2阳性的乳腺癌患者中的表达水平;C:EZH2基因在雌激素受体(ER)阴性和阳性的乳腺癌患者中的表达水平;D:EZH2基因在孕激素受体(PR)阴性和阳性的乳腺癌患者中的表达水平;E:EZH2基因在三阴性乳腺癌患者和非三阴性乳腺癌患者中的表达水平。
A:Expression levels of EZH2 in BC tissues compared to normal breast tissues according to molecular subtype(*P<0.05,***P<0.001.ns means P>0.05).B:Expression levels of EZH2 in HER-2 negative BC tissues compared to HER-2 positive BC tissues.C:Expression levels of EZH2 in estrogen receptor(ER) negative BC tissues compared to ER positive BC tissues.D:Expression levels of EZH2 in progesterone receptor(PR)negative BC tissues compared to PR positive BC tissues.E:Expression levels of EZH2 in triple negative breast cancer(TNBC) tissues compared to not TNBC tissues.
图4 EZH2基因在正常乳腺组织及乳腺癌组织中的甲基化水平
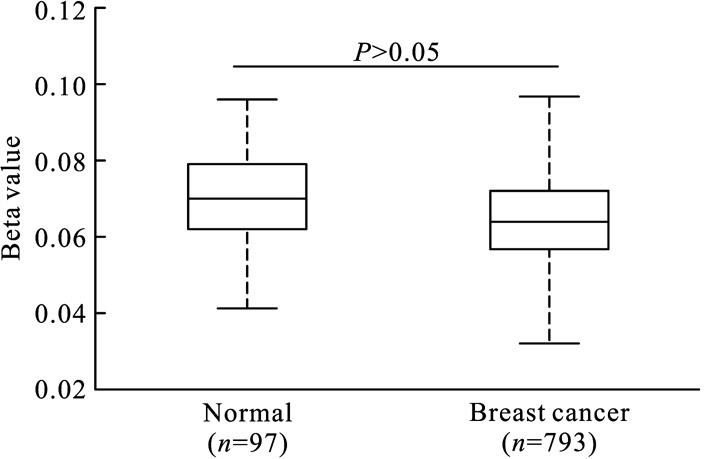
Fig.4 DNA methylation status of EZH2 in BC tissues compared to normal breast tissues
2.5 、乳腺癌组织中与EZH2共表达基因的GO富集分析
通过分析TCGA数据库,共发现1 662个EZH2的共表达基因。其中,Pearson相关系数绝对值≥0.4 的共表达基因有699 个。对EZH2及与其共表达的699个基因利用DAVID工具进行GO富集分析发现,上述基因在生物过程方面主要富集于核碱基的调节、细胞周期调控、染色体分离、DNA复制、DNA修复等方面;在细胞组成方面,上述基因主要富集于细胞核、核仁、中心体、核质、着丝粒等;在分子功能方面,上述基因主要与RNA结合、DNA结合、ATP结合、染色体结合连接酶活性等有关(图5)。
2.6、 乳腺癌组织中与EZH2共表达基因的KEGG通路分析
进一步分析EZH2及与其共表达的699个基因(相关系数绝对值≥0.4),使用FunRich(Version 3.1.3)工具进行KEGG通路分析。结果发现,EZH2及其共表达的基因主要富集在细胞周期、DNA复制、M/G1期转化、M期、有丝分裂前中期、ATM通路等方面。图6显示的是上述基因的 KEGG 通路富集结果。
2.7、 EZH2表达水平与乳腺癌患者的预后分析
利用Kaplan-Meier plotter在线数据库分析乳腺癌患者中EZH2基因表达水平与预后的关系,并绘制乳腺癌患者预后生存曲线图。结果表明,EZH2高表达的患者预后不良,其总生存期(overall survival,OS)、无病生存期(recurrence-free survival,RFS)、无远处转移生存期(distant metastasis-free survival,DMFS)及后进展生存期 (post-progression survival,PPS)均明显低于EZH2基因低表达的患者,Log-rank P值分别为P=0.014(图7A)、P=4.7e-13(图7B)、P=0.002 1(图7C)、P=0.000 97(图7D)。
3 、讨论
在本研究中,我们通过整合生物信息学手段分析了EZH2基因在乳腺癌中的表达水平及其临床意义。通过研究,我们发现EZH2基因在乳腺癌组织中的mRNA及蛋白表达水平均显着高于正常乳腺组织,这提示EZH2存在成为乳腺癌诊断标志物的价值。进而对其甲基化水平差异进行分析,发现EZH2的甲基化水平差异在二者之间并无统计学意义。此外,EZH2基因在乳腺癌组织中的表达水平和性别无关联性,男性乳腺癌患者和女性乳腺癌患者的EZH2表达水平没有明显差异,但二者均高于正常乳腺组织。EZH2基因在乳腺癌组织中的表达水平和年龄之间存在一定相关性。其中,21~40岁组与 61~80岁组、21~40岁组与81~100岁组、41~60岁组与61~80岁组及41~60岁组与81~100岁组发现EZH2表达存在差异。总体来看,年轻患者乳腺癌组织中的EZH2表达水平高于年长患者,这可能和乳腺癌患者体内的激素分泌水平相关[18]。从分期分组来看,仅Ⅰ期与Ⅱ期之间的EZH2表达存在差异,其他分期之间并没有发现类似现象,但各分期的乳腺癌组织中EZH2表达水平均高于正常乳腺组织。导致上述现象的原因可能是现今诊断技术不断提高,更多的乳腺癌患者在早期被确诊[19]。此外,乳腺癌年轻化也可能是一个影响因素[20]。
图5 EZH2及其共表达基因的GO富集分析结果
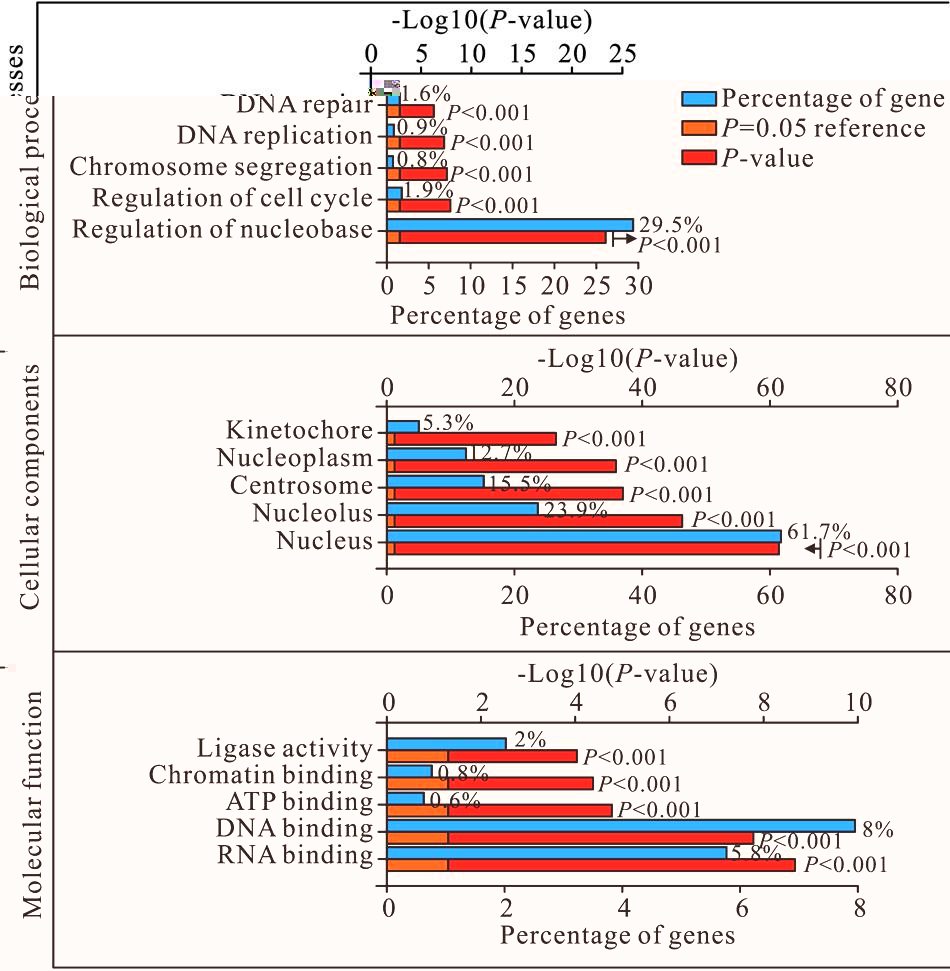
Fig.5 GO analysis of EZH2 and its co-expression genes
图6 EZH2及其共表达基因的生物学通路富集分析结果
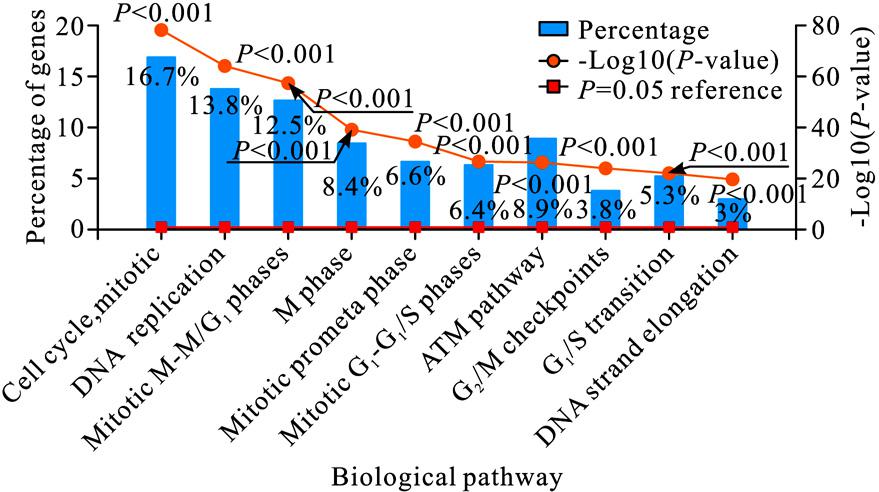
Fig.6 KEGG pathways analysis of EZH2 and its co-expression genes
不同分子分型的乳腺癌其临床病理特征不尽相同,ER阳性乳腺癌具有预后良好和晚期复发的特点,而HER-2阳性和三阴性乳腺癌(TNBC)患者的预后较差,更易出现早期复发以及多脏器受累[21]。本文中着重分析了EZH2在不同分子分型乳腺癌中的表达水平。其中,Luminal型乳腺癌、HER-2阳性乳腺癌及三阴性乳腺癌(TNBC)的EZH2表达水平均高于正常乳腺组织,提示EZH2可能成为乳腺癌靶向治疗疗效监测的标志物分子之一。进一步,我们发现EZH2基因在HER-2阴性和阳性乳腺癌中的表达没有差异,提示EZH2的表达与HER-2的表达无明确相关性。此外,EZH2在ER阴性或PR阴性乳腺癌中的表达分别高于ER阳性或PR阳性乳腺癌,提示EZH2可能是雌孕激素受体阴性乳腺癌的特异性标志物。在不同分型乳腺癌中,TNBC具有高侵袭转移性、高复发率以及预后差等特点[2,3],我们发现EZH2基因的表达水平在TNBC患者中高于非TNBC,这也进一步提示EZH2在乳腺癌中主导促癌作用,也为其成为乳腺癌分子亚型特异性靶点提供重要的理论依据。
此外,通过分析EZH2及其共表达基因群参与的生物学过程和分子通路发现,上述基因群在核碱基的调节、细胞周期调控、染色体分离、DNA复制、DNA修复、有丝分裂及ATM通路等方面发挥重要作用[22,23]。由此可见,乳腺癌的发生发展是一个多基因、多步骤参与的复杂过程,涉及多个生物反应和多条分子通路。这也提示EZH2参与并在乳腺癌发生发展中发挥重要作用,其有望为乳腺癌的治疗开辟新的道路[23]。有研究表明[18],肿瘤发生过程中伴随着细胞周期及DNA修复紊乱。因此,若能对参与上述过程调控的EZH2加以干预,将可能有效抑制肿瘤的发生发展。迄今为止,研究开发的EZH2抑制剂包括DZNep[24]、GSK126[25]及GSK343[26]等,部分已应用于临床前期,并展现出良好的肿瘤治疗前景[27,28]。
图7 EZH2表达水平与乳腺癌患者预后的生存曲线
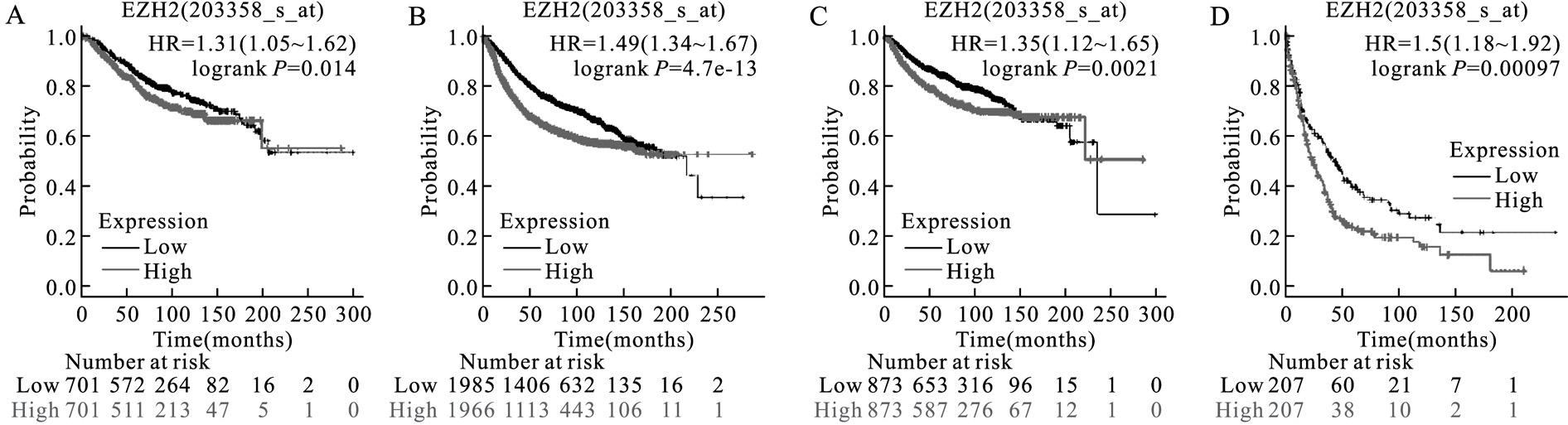
Fig.7 Relationship between EZH2 expression and prognosis of breast cancer patients
A:总生存期;B:无病生存期;C:无远处转移生存期;D:后进展生存期。
A:Overall survival(OS).B:Recurrence-free survival(RFS).C:Distant metastasis-free survival(DMFS).D:Post-progression survival(PPS).
在预后分析方面,我们发现高表达EZH2的乳腺癌患者的总生存期、无病生存期、无远处转移生存期及后进展生存期均明显低于EZH2基因低表达的患者。这提示EZH2在乳腺癌的预后分析方面具有重要的临床意义。综上,EZH2基因在乳腺癌组织中表达量高于正常乳腺组织,EZH2参与了乳腺癌发生发展的诸多生物学过程,且为乳腺癌患者的预后判断提供了依据。因此,EZH2有望成为乳腺癌诊断筛选、预后分析及靶向治疗的标志物分子或有效靶点。
参考文献
[1] Waks AG,Winer EP.Breast cancer treatment:A review[J].JAMA,2019,321(3):288-300.
[2] Ahmad A.Breast cancer statistics:Recent trends[J].Advances in Experimental Medicine and Biology,2019,1152:1-7.
[3] Nagini S.Breast cancer:Current molecular therapeutic targets and new players[J].Anti-Cancer Agents in Medicinal Chemistry,2017,17(2):152-163.
[4] Prat A,Pineda E,Adamo B,et al.Clinical implications of the intrinsic molecular subtypes of breast cancer[J].Breast,2015(Suppl 2):S26-S35.
[5] Kleibl Z,Kristensen VN.Women at high risk of breast cancer:Molecular characteristics,clinical presentation and management[J].Breast,2016(28):136-144.
[6] Thorat MA,Cuzick J.Preventing invasive breast cancer using endocrine therapy[J].Breast,2017(Suppl 1):S47-S54.
[7] Senkus E,Lacko A.Over-treatment in metastatic breast cancer[J].Breast,2017(31):309-317.
[8] Fujii S,Ito K,Ito Y,et al.Enhancer of zeste homologue 2(EZH2) down-regulates RUNX3 by increasing histone H3 methylation[J].The Journal of Biological Chemistry,2008,283(25):17324-17332.
[9] Kim KH,Roberts CW.Targeting EZH2 in cancer[J].Nature Medicine,2016,22(2):128-134.
[10] Yamagishi M,Uchimaru K.Targeting EZH2 in cancer therapy[J].Current Opinion in Oncology,2017,29(5):375-381.
[11] Han Li C,Chen Y.Targeting EZH2 for cancer therapy:Progress and perspective[J].Current Protein & Peptide Science,2015,16(6):559-570.
[12] Kondo Y.Targeting histone methyltransferase EZH2 as cancer treatment[J].Journal of Biochemistry,2014,156(5):249-257.
[13] Kim SY,Kawaguchi T,Yan L,et al.Clinical relevance of microRNA expressions in breast cancer validated using the cancer genome atlas(TCGA)[J].Ann Surg Oncol,2017,24(10):2943-2949.
[14] Chandrashekar DS,Bashel B,Balasubramanya SAH,et al.UALCAN:A portal for facilitating tumor subgroup gene expression and survival analyses[J].Neoplasia(New York,N.Y.),2017,19(8):649-658.
[15] Pontén F,Schwenk JM,Asplund A,et al.The Human Protein Atlas as a proteomic resource for biomarker discovery[J].Journal of Internal Medicine,2011,270(5):428-446.
[16] Yang WL,Ma JJ,Zhou W,et al.Identification of hub genes and outcome in colon cancer based on bioinformatics analysis[J].Cancer Management and Research,2019(11):323-338.
[17] Hou GX,Liu P,Yang J,et al.Mining expression and prognosis of topoisomerase isoforms in non-small-cell lung cancer by using Oncomine and Kaplan-Meier plotter[J].PLoS One,2017,12(3):e174515.
[18] Perkins MS,Louw-du Toit R,Africander D.Hormone therapy and breast cancer:Emerging steroid receptor mechanisms[J].Journal of Molecular Endocrinology,2018,61(4):R133-R160.
[19] Jafari SH,Saadatpour Z,Salmaninejad A,et al.Breast cancer diagnosis:Imaging techniques and biochemical markers[J].Journal of Cellular Physiology,2018,233(7):5200-5213.
[20] Johnson RH,Chien FL,Bleyer A.Incidence of breast cancer with distant involvement among women in the United States,1976 to 2009[J].The Journal of the American Medical Association,2013,309(8):800-805.
[21] Cadoo KA,Fornier MN,Morris PG.Biological subtypes of breast cancer:Current concepts and implications for recurrence patterns[J].Q J Nucl Med Mol Imaging,2013,57(4):312-321.
[22] Thu KL,Soria-Bretones I,Mak TW,et al.Targeting the cell cycle in breast cancer:Towards the next phase[J].Cell cycle(Georgetown,Tex.),2018,17(15):1871-1885.
[23] Gavande NS,VanderVere-Carozza PS,Hinshaw HD,et al.DNA repair targeted therapy:The past or future of cancer treatment[J].Pharmacology & Therapeutics,2016,160:65-83.
[24] Chen J,Zhang M,Zhang X,et al.EZH2 inhibitor DZNep modulates microglial activation and protects against ischaemic brain injury after experimental stroke[J].Euro J Pharmacol,2019,857:172452.
[25] Huang S,Wang Z,Zhou J,et al.EZH2 inhibitor GSK126 suppresses antitumor immunity by driving production of myeloid-derived suppressor cells[J].Cancer Research,2019,79(8):2009-2020.
[26] Ying L,Yan F,Williams BR,et al.(-)-Epigallocatechin-3-gallate and EZH2 inhibitor GSK343 have similar inhibitory effects and mechanisms of action on colorectal cancer cells[J].Clinical and Experimental Pharmacology & Physiology,2018,45(1):58-67.
[27] Lue JK,Amengual JE.Emerging EZH2 inhibitors and their application in lymphoma[J].Current Hematologic Malignancy Reports,2018,13(5):369-382.
[28] Crea F,Fornaro L,Bocci G,et al.EZH2 inhibition:Targeting the crossroad of tumor invasion and angiogenesis[J].Cancer Metastasis Reviews,2012,31:753-761.





