大鼠坐骨神经慢性结扎损伤模型 (ChronicConstriction Injury,CCI)[1],作为一个经典的疼痛动物模型,因其能够产生节律模式丰富多样的自发放电,已成为研究自发放电节律及其变化规律的常用模型。以往研究在低钙条件下观察到阵发周期节律、整数倍节律、周期簇放电、周期峰放电、混沌簇放电、混沌峰放电等放电节律,以及倍周期分岔、倍周期分岔序列到混沌、带混沌的加周期分岔和带有随机节律的加周期分岔[2-6]等分岔转迁模式。
这些研究发现,降低灌流液钙离子浓度或使用非特异性钾通道阻断剂四乙基铵(Tetraethylammonium,TEA)均可以诱发损伤神经起步点呈现自发放电节律的转迁,并且低钙和TEA诱发的转迁历程非常相似[12].以上结果提示,钙激活钾通道可能参与损伤神经自发放电的调节。由于TEA是非特异的钾通道阻断剂,上述推论仍缺乏直接的药理学证据。钙激活钾通道(Ca2+-activated K+channel,Kca)根据电导的大小可分为小电导钙激活钾通道(Thesmall-conductance Ca2+-activated K+channel,SK,2-25pS)、中电导钙激活钾通道(The medium-conduct-ance Ca2+-activated K+channel,IK,25-100pS)和大电导钙激活钾通道(The large-conductance Ca2+-activa-ted K+channel,BK,100-300pS)[13].BK通道由四个α亚单位构成的主体及附属的β调节亚单位(β1~β4)组成,是电压和Ca2+依赖的离子通道。细胞内钙和膜去极化都可激活BK通道,在神经元细胞上BK主要参 与 快 速 后 超 极 化 (fast after-hyperpolarization,fAHP)电流的形成,抑制了神经元冲动的发放[7].背根节(dorsal root ganglion,DRG)神经元上激活BK通道使DRG神经元动作电位的时程缩短,动作电位的爆发频率降低[8].BK通道可被蝎毒(Iberiotoxin,IBTX)特异性阻断[9]、TEA非特异性阻断[10].功能性SK通道包括两种亚单位: α亚基和与之相连的钙调蛋白(CaM)亚基,是Ca2+高敏感性和电压不依赖的离子通道[11].SK通道调节中等后超极化(medium rate-hyperpolarization,ImAHP)电 流 和 慢 速 后 超 极 化(small rate-hyperpolarization,IsAHP)电流,降低神经元兴奋性,限制神经元的放电频率,产生放电频率适应[12-13],可被蜂毒明肽(Apamin)特异性阻断[14].
这些研究表明,BK、SK对动作电位的调节起着极其重要的作用。本研究选取CCI模型大鼠的损伤坐骨神经作为研究对象,利用细胞外非特异性钙激活钾通道阻断剂TEA、BK通道特异性阻断剂IBTX和SK通道特异性阻断剂Apamin,研究其对损伤神经放电频率的影响;并重点观察是否出现放电节律的变化及分岔转迁;再仔细比较使用特异性阻断剂和非特异性阻断剂后的节律变化是否不同,观察钙激活钾通道状态改变对放电模式的影响,以及BK,SK通道在损伤神经自发放电中的作用。
1、材料和方法
1.1、实验方法
选用健康的成年雄性SD大鼠,由西安交通大学附属医院实验动物中心提供,体重150~300g,依照文献所述,制备坐骨神经慢性压迫模型[1].用戊巴比妥钠(40mg/kg,i.p)腹腔注射进行麻醉,暴露左侧坐骨神经,分离出一段神经干(1cm左右)再轻度结扎,形成一个对坐骨神经外周区段的慢性压迫。手术后3~7d,用乌拉坦腹腔注射麻醉手术后,再次将损伤区域暴露,去除结扎线、游离损伤区段的坐骨神经,用34~35℃正常灌流液浸浴损伤区域。在距离损伤区域约20mm的中枢端处另行切口,可暴露出一段正常未受损伤的坐骨神经,再用34~35℃温热石蜡油浸浴正常区段的神经,在显微镜下分离出中枢端神经细束,切断它与中枢神经的联系,使其仅与损伤区域相连,将分离出的神经细束放于铂金丝引导电极上,用chart5.5软件观察并记录神经细束的自发放电情况。计算神经传导速度以对神经纤维进行分类。速度大于2m/s为A类神经元,小于2m/s为C类神经元[15],若出现了单个A纤维放电则进行记录保存,神经电活动信号可经powerlab系统放大、采集之后输入计算机系统,采样频率是10.0kHz.顺序记录相邻动作电位峰峰间期时间间隔,获得神经 自 发 放 电 峰 峰 间 期 (Inter-Spike Interval,ISI)序列,所得数据用origin软件分析并作相应的时间序列图等。实验中利用不同浓度的TEA、IBTX和Apamin替换正常灌流液灌流损伤区,分别记录放电的ISI序列。
1.2药品 Apamin,IBTX,TEA购于Sigma公司。
1.3实验溶液。
正常灌流液成 分 (mmol/L):150NaCl、5KCl、1MgCl2、1.2CaCl2、10HEPES.所用 药 物 浓 度:TEA(40 mmol/L),Apamin(100μmol/L),IBTX(20μmol/L),用正常灌流液稀释得到。药品溶于蒸馏水后,以1mol/L的NaOH或者HCl调节pH值为7.35~7.45.
2实验结果。
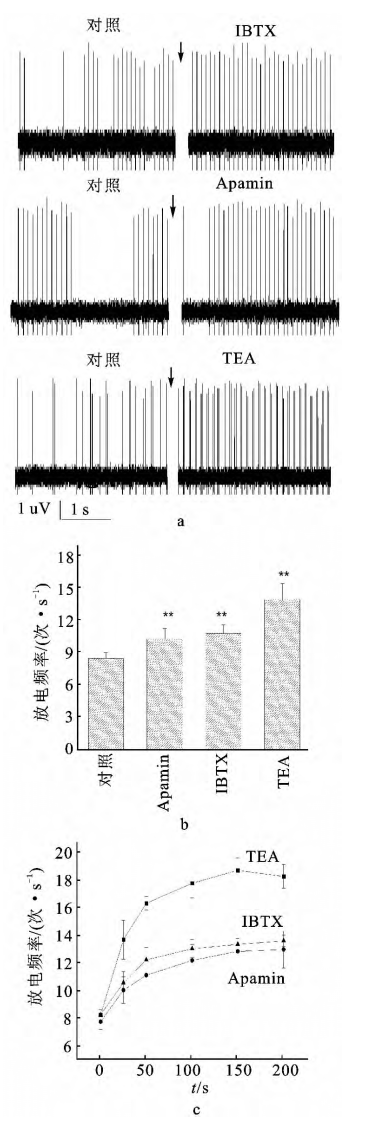
2.1、不同阻断剂对自发放电频率的影响
在实验性神经起步点,观察不同的钙激活钾通道阻断剂对放电频率的影响。在非特异性阻断剂TEA的作用下,60例 数 据 均 出 现 放 电 频 率 增 加(100%);在BK特异性阻断剂IBTX的作用下,28例数据中22例出现放电频率的增加(78.6%);在SK特异性阻断剂Apamin的作用下,40例数据中有35例出现了放电频率增加(87.5%)。加药后25s与加药前相比,3种药物的施加均显著提高了放电频率(配对t检验,P<0.01)。加药后25s,TEA组的放电频率远高于IBTX组和Apamin组(独立样本t检验,P<0.01),IBTX组和Apamin组无显著差异(图1)。
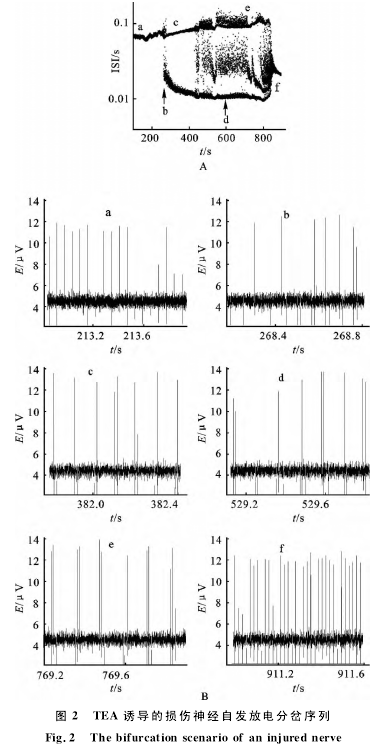
2.2不同阻断剂对放电节律的影响
2.2.1非特异性 Kca阻断剂 TEA的自发放电依据分岔转迁规律TEA使放电从周期1开始逐渐向较高周期转化,到簇内含有多个峰的放电再经过激变到达峰端。图2显示了1例有代表性的分岔过程。
在1例神经起步点(图2),损伤神经的自发放电在正常灌流液表现为阵发,调节TEA的浓度从0升高到40mmol的过程中,经过周期1簇放电、周期2簇放电、周期2周期3混沌、周期3、高周期到达峰端周期1,说明在TEA的作用下,放电节律呈现出程度较大、较丰富的转迁历程,从簇端周期1经过复杂的节律变化到达峰端周期1.上述结果提示在神经损伤区可能存在Kca.
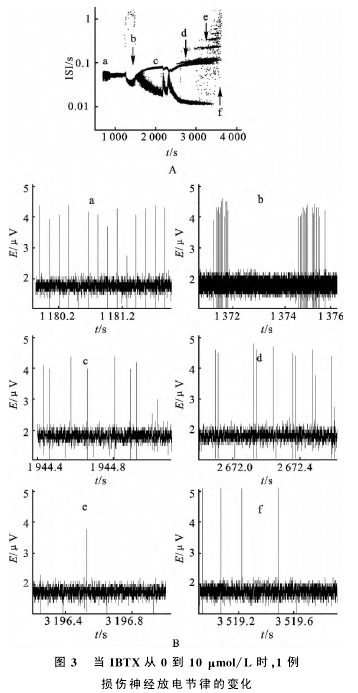
2.2.2 BK特异性阻断剂IBTX使自发放电呈现部分节律转迁
在IBTX的作用下,放电仅呈现部分节律转迁,不能到达峰端,图3显示了1例有代表性的分岔过程。调节IBTX的浓度从0~20μmol/L的变化过程中,损伤神经自发放电从周期1放电变为阵发经过倍周期分岔到周期2、周期1周期2间新节律、012共存、整数倍,最后到达静息,没有发生激变。该结果显示IBTX能引起放电节律的转迁,说明在损伤区存在BK通道。但这种IBTX引起的节律转迁历程与TEA的作用效果相比较为简单,只是部分再现TEA所诱发的转迁历程,最后到达静息没有经过激变且无法洗回。
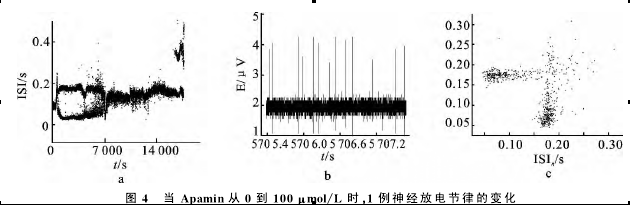
2.2.3SK特异性阻断剂Apamin使自发放电呈现部分节律转迁
在Apamin的作用下,损伤神经自发放电只呈现部分节律转迁历程,不能到达峰端,图4显示了一例有代表性的分岔过程。如图4,调节Apamin的浓度从0~100μmol/L的变化过程中,损伤神经的自发放电从周期Apamin,发现可使放电经历TEA所诱发的大分岔的一部分,既有频率的变化又有节律的变化,表明BK、SK通道均可参与放电节律的调节,联合应用IBTX和Apamin,放电模式的分岔转迁历程和TEA所诱发的更为接近。上述实验结果提示,在损伤神经上可能存在BK、SK通道亚型。对损伤区含有BK、SK通道的进一步的证明可通过免疫组织化学等方法研究[17],本文没有涉及。1簇放电经过混沌到达周期2,出周期2经过周期1周期2混沌进入周期1,最后经过整数倍到静息。该结果说明在Apamin的作用下能引起放电节律的转迁,说明在损伤区存在SK通道。但这种Apamin引起的节律转迁历程比较简单,仅部分再现TEA所诱发的转迁历程。
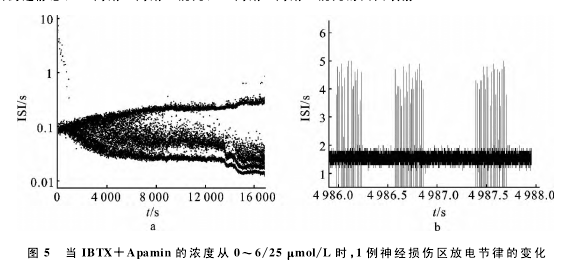
2.2.4 联合应用IBTX 和 Apamin诱发的分岔转迁历程
联合应用IBTX和Apamin观察损伤神经起步 点 的 节 律 转 迁 历 程。如 图5,调 节IBTX+Apamin的浓度从0~6/25μmol/L的变化过程中,损伤神经的自发放电从周期1簇放电开始经过混沌逐渐向较高周期转变,最后进入簇内含有多个峰的放电(图5b),但不能经过激变到达峰端。该结果说明在两种药物共同作用下,放电节律的变化更丰富,转迁程度高于单独加药,更接近TEA所诱发的节律转迁历程。进一步证明损伤神经起步点存在BK、SK通道亚型。
3、讨论。
在正常的神经轴突上,不存在大量裸露的离子通道,尤其是钾离子通道和钙离子通道[16].我们之前的工作利用CCI模型,发现在慢性压迫的损伤神经上,可以产生持久并且节律丰富的自发传入放电,本研究从功能上证明在损伤区可能存在钙激活钾通道,参与调节动作电位的时间序列模式。本文首先利用非特异性钙激活钾通道阻断剂TEA作用于损伤区,结果发现TEA可以使放电经历从阵发或周期一再到高周期到簇内有多个峰的放电经过激变到达峰端的大分岔,提示在损伤区Kca可能起着关键的作用,再分别使用BK、SK特异性阻断剂IBTX和已有研究发现在损伤神经的轴突上有多种离子通道的聚集,例如钠通道、钾通道,以及超极化激活的混合阳离子通道等[18-20].我们的这一实验结果提示在损伤神经上有钙激活钾通道的聚集。虽然这些离子通道聚集产生的原因目前还不清楚,但可以猜测,当神经发生损伤时,会启动再生过程,细胞内各种蛋白质表达,包括各类离子通道,这些离子通道经轴浆运输运送到轴突。在正常情况下这些离子通道并不装配在裸露的轴突膜上,但在损伤的神经上,某种正常情况下控制通道蛋白上膜的机制被破坏,导致各种离子通道蛋白表达在损伤神经轴突膜上。以往对Kca的研究表明,在神经元上BK主要参与IfAHP的形成,抑制了因胞内Ca2+浓度升高或膜去极化所引起的兴奋和神经递质的释放所引起的神经元冲动的发放。研究表明,激活BK通道使DRG神经元动作电位的时程缩短,动作电位的爆发频率降低,用阻断剂可使放电频率增加[8].SK通道调节ImAHP和IsAHP,主要是限制神经元的放电频率,产生放电频率适应。邢俊玲等利用大鼠背根神经节慢性压迫模型,发现Apamin作用于损伤DRG可使放电频率明显增加[21].本研究在神经损伤区使用BK、SK通道特异性阻断剂,不仅观察了放电频率的变化,而且重点观察了放电节律的变化,证明在损伤神经起步点存在BK、SK通道;分别应用BK、SK通道特异性阻断剂IBTX和Apamin,发现其诱发的分岔转迁表现出细致的区别,即放电节律在apamin的作用下出现分岔转迁后一般会自行恢复到加药前状态,而在IBTX的作用下一般不会出现自行恢复现象,提示BK、SK通道在调节放电节律中的作用不同。
4、结论。
本研究在CCI模型大鼠坐骨神经损伤区施加BK通道特异性阻断剂IBTX和SK通道特异性阻断剂Apamin,观察到损伤神经自发放电节律的转迁,和TEA及降低胞外Ca2+浓度所诱发的转迁历程相似但表现有细致的区别,只是部分的诱发了TEA所诱发的转迁历程。这些结果提示在损伤区存在钙激活钾通道,这些钙激活钾通道可能参与了损伤神经自发放电的调控。这些发现有助于了解慢性神经痛的外周机制,也为临床上治疗慢性神经痛提供了新的思路。
参考文献:
[1]Bennett G J,Xie Y K.A peripheral mononeuropathy inrat that produces disorders of pain sensation like thoseseen in man[J].Pain,1988,33:87-107.
[2]Yang Minghao,An Shucheng,Gu Huaguang,et al.Understanding of physiological neural firing through dy-namical bifurcation machineries[J].Neuroreport,2006,17(10):995-999.
[3]Ren Wei,Hu Sanjue,Zhang Baojun,et al.Period-adding bifurcation with chaos in the interspike intervalsgenerated by an experimental neural pacemaker[J].In-ternational Journal of Bifurcation and Chaos,1997,7:1867-1872.
[4]Zheng Qiaohua,Liu Zhiqiang,Yang Minghao,et al.Qualitatively different bifurcation scenarios observed inthe firing of identical nerve fibers[J].Physics LettersA,2009,373:540-545.
[5]Li Li,Gu Huaguang,Yang Minghao,et al.A series ofbifurcation scenarios in the firing transitions in an exper-imental neural pacemaker[J].International Journal ofBifurcation and Chaos,2004,14(5):1813-1817.
[6]Gu Huaguang,Yang Minghao,Li Li,et al.Noise in-duced multi-mode firing patterns in neural period addingbifurcation scenario[J].International Journal of ModernPhysics B,2003,17:4195-4200.
[7]Vergara C,Latorre R,Marrion N,et al.Calcium-acti-vated potassium channels[J].Current Opinion in Neuro-biology,1998,8:321-329.
[8]Zhang X F,Gopalakrishnan M,Shieh C C.Modulation ofaction potential firing by iberiotoxin and NS1619in ratdorsal root ganglion neurons[J].Neuroscience,2003,122(4):1003-1011.