摘 要: 小胶质细胞是神经系统的免疫细胞,参与调节神经系统的发育以及维持神经系统稳态。小胶质细胞的发育和功能存在显着的性别差异,可能是脑性分化的关键介质。该文总结了小胶质细胞在发育、免疫应答以及神经系统疾病中的性别特征,为研究脑性分化和神经系统疾病的性别差异提供理论参考。
关键词: 小胶质细胞; 性别差异; 神经系统疾病;
Abstract: Microglia are the immune cells of the nervous system and involved in the development of brain as well as in the maintaining of brain homeostasis. There are significant gender differences in the development and function of microglia, which may be the key medium for brain sexual differentiation. This review summarized gender characteristics of microglia in development, immune response and nervous system diseases, thus providing reference for the study of brain sexual differentiation as well as gender differences in nervous system diseases.
Keyword: microglia; gender differences; nervous system diseases;
1、 小胶质细胞背景介绍
1.1 、小胶质细胞的起源
小胶质细胞是中枢神经系统(central nervous system,CNS)中的巨噬细胞,在大脑和脊髓中均匀分布,占中枢神经系统细胞总数的10%~15%[1]。在小鼠中,小胶质细胞起源于卵黄囊血岛(yolk sac,YS)中产生的原始巨噬细胞,在胚胎期8.5 d(E8.5),随血液循环迁移至大脑。在E9.0~E9.5阶段,小胶质细胞通过软脑膜和侧脑室进入大脑皮层,并以不同的速度从两个方向分布于大脑皮层,随后分布于整个脑组织[2]。小胶质细胞具有增殖能力,其数量在小鼠出生后2周内逐步增加,随后在第3周开始显着下降,6周时小胶质细胞数量降至2周峰值时的50%,并长期保持稳定[3]。
1.2 、小胶质细胞的发育与成熟
小胶质细胞的发育受到多种转录因子的调节。小胶质细胞来源于髓系细胞中的原始巨噬细胞,髓系细胞的发育需要多种转录因子参与,如Pu.1(Ets家族的成员)和干扰素调节因子(Irf8)[4]。Kierdorf等[5]利用Pu.1和Irf8基因敲除的小鼠发现,Pu.1基因敲除导致小鼠大脑中小胶质细胞缺失,Irf8基因敲除导致成熟小胶质细胞(A2型)数目和密度的降低,但A1型小胶质细胞数目无变化。Runx1是Runx转录因子家族成员,具有调节髓样细胞分化和增殖的作用。Zusso等[6]在研究Runx1表达与出生后小胶质细胞增殖的关系中发现,Runx1能够抑制小胶质细胞的增殖,并促进小胶质细胞由阿米巴样形态向分枝状形态转变,表明Runx1可能具有促进小胶质细胞成熟的作用。胞外环境信号参与调节小胶质细胞发育。集落刺激因子1(colony stimulating factor 1,CSF1)及其受体(CSF1R)是髓系细胞发育的关键调节信号。Erblich等[7]发现,CSF1R基因缺失的小鼠大脑中小胶质细胞的数量明显减少。给成年小鼠注射CSF1R抑制剂后发现,小鼠大脑内小胶质细胞逐渐消除,停止注射抑制剂后小胶质细胞的数量逐渐恢复[8]。白细胞介素-34(interleukin-34,IL-34)也是CSF1R的配体,CSF1和IL-34分布于脑内的不同区域,呈现一定的区域特异性,共同调控小胶质细胞发育及其数目的维持[9,10]。此外,转化生长因子β(transforming growth factor-β,TGF-β)及其受体也参与调节小胶质细胞数目的维持,TGF-β1受体缺失导致小胶质细胞数量明显降低[11]。

1.3、 小胶质细胞的稳态调节作用
小胶质细胞在稳态调节中发挥作用。生理条件下,大脑中的小胶质细胞表现出复杂的形态,具有高度分枝的突起。这种突起由紧凑的细胞体延伸而来,负责监测神经元的活动和定期扫描周围区域以感知病理变化或干扰[12]。小胶质细胞能够监测神经元的电活动。Kettenman等[13]研究发现,小胶质细胞表达多种神经递质、神经肽以及神经调节素受体;兴奋性神经递质能够促进小胶质细胞活性,导致细胞因子的释放增加、小胶质细胞突起的动态变化以及吞噬能力增强,而抑制性神经递质GABA能够降低小胶质细胞的炎症反应[14]。此外,小胶质细胞能够通过突起感知病理变化或干扰,并分泌多种细胞因子,调节局部免疫反应[15]。Abellanas等[16]对小鼠进行全身脂多糖(lipopolysaccharide,LPS)给药后发现,海马、中脑和纹状体中肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)、IL-1β和IL-6显着增加。由此可见,小胶质细胞在大脑中不是“静止”的,而是在“监视和快速反应”状态下高度活跃。
2、 小胶质细胞发育与功能的性别差异
2.1、 小胶质细胞影响大脑性别分化
小鼠大脑的性别分化是由围产期睾丸产生的雄激素增加引起的。视前区(POA)是大脑中具有高度性别差异的区域,在POA的脂肪细胞中,由睾酮经过芳香化酶作用转变的雌二醇可促进前列腺素E2(prostaglandin E2,PGE2)的生成,从而促进大脑的性别发育[17]。Lenz等[18]在研究POA中小胶质细胞是否存在性别差异时发现,刚出生的雄性小鼠POA中阿米巴样小胶质细胞数量是雌性的2倍,形态更加活跃;在小鼠的围产期,使用二甲胺四环素(一种小胶质细胞活动的抑制剂)可抑制由雌二醇诱导的PGE2的表达上调,进而抑制大脑雄性化。许多研究证实了小胶质细胞在大脑性别分化过程中的关键性作用,但如何影响脑性别分化的调控机制还需要更进一步研究。
2.2 、小胶质细胞发育的性别差异
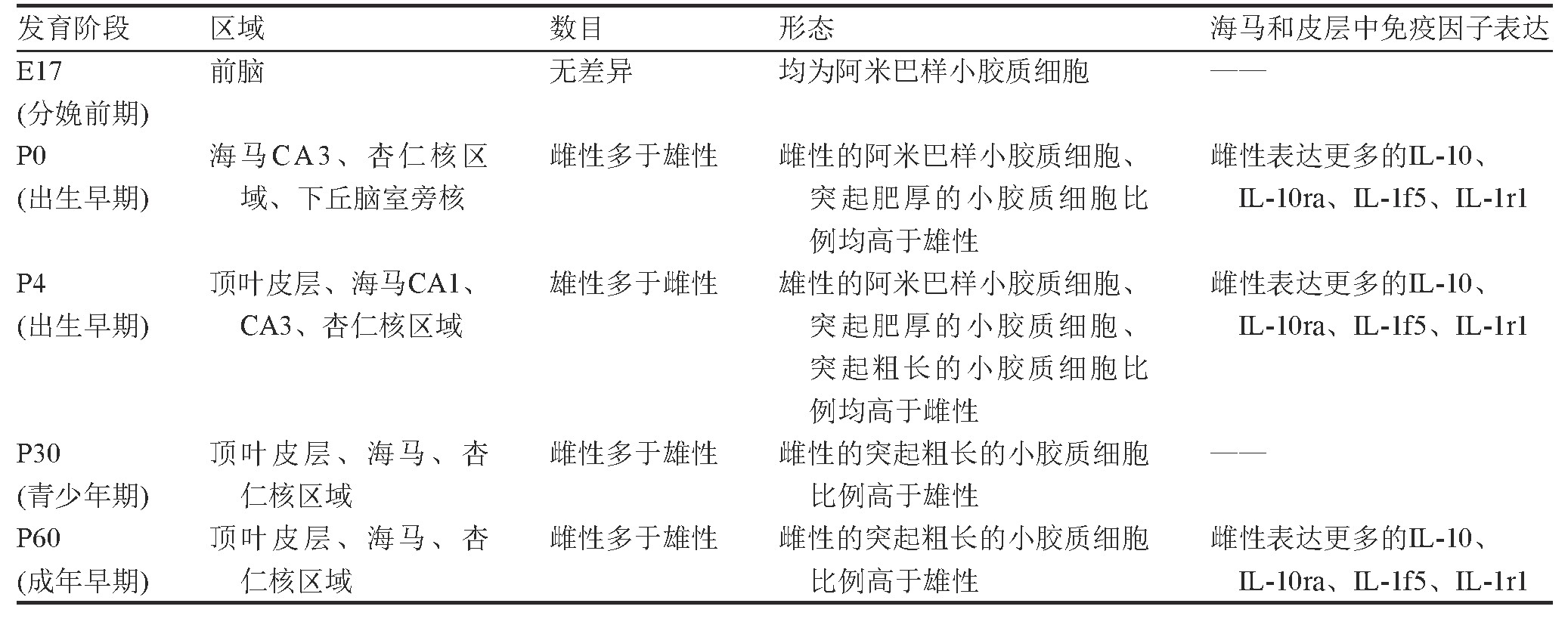
在大脑发育过程中小胶质细胞的形态和数量受性别影响。Schwarz等[19]研究发现,在P0大鼠的杏仁核、下丘脑室旁核以及海马的CA3区,雌性比雄性具有更多的阿米巴样小胶质细胞和突起肥厚的小胶质细胞;P4阶段,在顶叶皮层、海马CA1区和杏仁核,雄性大鼠的阿米巴样小胶质细胞、突起肥厚的小胶质细胞和突起粗长的小胶质细胞明显多于雌性;P30阶段,在顶叶皮层、海马的CA3、齿状回以及杏仁核,雌性比雄性拥有更多突起粗长的小胶质细胞;P60阶段,在顶叶皮层、海马的CA1、CA3和齿状回以及杏仁核区,雌性比雄性拥有更多突起粗长的小胶质细胞,暗示雌性小胶质细胞形态更加活跃(表1)。Hanamsagar等[20]对小鼠脑发育过程中的小胶质细胞转录组进行了分析,发现从E18开始,性别对小胶质细胞的成熟有着显着的影响,雄性的小胶质细胞的成熟比雌性晚;并且在急性免疫激活的情况下,如用LPS刺激后,雄性的小胶质细胞的发育加快,而雌性的小胶质细胞的成熟阶段没有发生变化。
2.3、 免疫应答过程中小胶质细胞的性别差异
在生理条件下,雌性和雄性小鼠在炎症因子表达方面具有明显差异。Schwarz等[19]研究发现,P0~P60阶段雌性小鼠的IL-10和IL-10ra以及IL-1f5和IL-1r1的表达均明显高于雄性(表1);P60阶段,雌性小鼠海马和皮质中IL-1β、IL-16、IL-1α和Tollip表达水平均明显高于雄性小鼠。在急性应激条件下,雌性和雄性小鼠在小胶质细胞激活和炎症因子表达方面具有显着差异。Xu等[21]将雄性和雌性小鼠在4℃冷刺激条件下处理12 h后发现,雄性小鼠海马中TNF-α和IL-6比雌性表达量更多,并且在海马CA1区雄性小鼠激活的小胶质细胞比雌性明显增多,表明雄性小鼠海马可能比雌性小鼠海马更容易受到寒冷的影响。Meneses等[22]利用BALB/c和CD-1小鼠研究炎症反应的遗传调节和性别差异,LPS注射2 h后,在中枢神经系统中,CD-1雄性小鼠TNF-α的表达量高于BALB/c雄性小鼠。在大脑中,只有CD-1雄性小鼠的IL-1β的表达量增加,CD-1、BALB/c两种小鼠雄性和雌性大脑中的IL-6表达量均增加,但BLAB/c雌性增加的水平较低;72 h后,TNF-α、IL-1β、IL-6的表达均下降。在LPS注射72 h后,BALB/c雄性小鼠和CD-1小鼠大脑皮层中Iba1阳性的小胶质细胞的比率显着增加,而BALB/c雌性小鼠大脑皮层中Iba1阳性的小胶质细胞的比率无显着性变化。这些结果表明,LPS诱导的中枢神经系统中小胶质细胞激活具有遗传和性别依赖性。
表1 小胶质细胞发育的性别差异(以啮齿类动物为例)
3、 小胶质细胞在神经系统疾病中的性别差异
神经系统疾病的患病概率和病症表现存在着性别差异[23]。例如,自闭症在男性儿童中更普遍[24],帕金森氏症在男性中更常见,而女性患抑郁症和焦虑症的概率大于男性[25]。尽管在疾病进展中潜在的性别差异的机制还不是很清楚,但是在男性和女性中不同炎症状态和他们发展某些疾病的倾向之间存在着很强的联系[26]。
3.1、 神经发育性疾病
3.1.1、 自闭症
自闭症谱系障碍(autistic disorder,ASD)是发生在儿童早期的一组疾病,其特征是社会交往和社会互动不足,情感互惠性低,言语交流障碍和刻板重复行为。在临床研究中发现,ASD更倾向于影响男性儿童,并且男性与女性的诊断率为4:1[27]。此外,男性和女性自闭症患者表现出不同的症状,男性表现出更强的攻击性和重复性行为,而女性更多表现出焦虑和抑郁[28]。Werling等[29]研究发现,ASD男性患者脑中小胶质细胞、星形胶质细胞标记物高于正常男性;另外,男性ASD相关基因的表达(如asd M12V、asdM16V、asdM5G,其中asdM16V、asdM5G与小胶质细胞功能相关)高于女性。在早期发育过程中,男性小胶质细胞的活性比女性高,因此,自闭症的性别特异性发病率可能与较高的小胶质细胞反应活性有关,小胶质细胞在功能上调控神经元的连接,这也可能导致该疾病在男性中更加普遍存在[20]。因此,男性和女性在中枢神经系统内的免疫差异可能是一个关键的ASD易感性因素。
3.2、 精神性疾病
3.2.1、 抑郁症与焦虑症
抑郁症(major depressive disorder,MDD)是一种常见而严重的情绪障碍疾病,其环境风险因素包括童年逆境、细菌或病毒感染、压力。抑郁症患者通常表现为情绪低落、快感缺失、食欲减退和睡眠障碍。焦虑症又称为焦虑性神经症,主要体现为惊恐障碍、广场恐惧症、社交焦虑症和广泛性焦虑症。MDD和焦虑症的男女患病比例大约为1:1.8[30]。抑郁症患者在病理上表现出几种炎症介质水平的升高,包括IL-6和C反应蛋白(C-reactive protein,CRP)[31],这可能与小胶质细胞免疫功能异常有关。Seney等[32]对男性和女性抑郁症患者死后大脑样本进行基因芯片检测和Meta分析,发现在前扣带回、基底外侧杏仁核和前额叶皮质的皮质边缘区域,男性小胶质细胞相关基因,如CCL2、CCL4、CD83等表达增加,而女性小胶质细胞相关基因表达降低。
3.2.2 、精神分裂症
精神分裂症(schizophrenia,SCZ)是一种精神障碍疾病,症状包括幻觉、妄想、语无伦次、阴性症状即冷漠(言语贫乏)、情感平淡、快感缺乏(缺乏欲望)、精神分裂(缺乏动力)和认知缺陷[33]。SCZ可能由环境风险因素引发的遗传病理变化所导致[34]。病理研究显示,精神分裂症患者的神经递质失衡(如多巴胺、谷氨酸、GABA)[35,36]以及小胶质细胞功能缺失导致神经元突触修剪异常[37,38,39]。精神分裂症患者的全基因组研究发现,其前额皮质中小胶质细胞数目增多[40],与吞噬或溶酶体相关的基因表达异常[41]。这些结果表明,小胶质细胞在精神分裂症中发挥重要作用,而潜在的机制在很大程度上仍不清楚。虽然男性和女性具有相似的患病率,但发病机制、病前阶段、发病、病程以及治疗反应性在性别之间有所不同。女性与男性相比,发病高峰期通常推迟4~5年[42]。雌激素假说认为,雌激素通过特定的受体调节小胶质细胞的活性,并作为转录因子诱导抗炎基因表达[43],从而发挥神经保护作用。
3.3、 神经退行性疾病
3.3.1 、阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)是老年痴呆症最常见的病因,是一种逐渐丧失认知功能的神经退行性疾病[44]。AD的病理学特征之一是脑内小胶质细胞过度激活和增殖,并聚集在淀粉样斑块周围[45]。全基因组分析发现,在小胶质细胞中表达的TREM2、CR1、CLU和CD33等免疫功能基因与AD遗传风险相关[46]。Zhang等[47]研究发现,免疫系统和小胶质细胞功能障碍可能是AD的主要致病原因。在AD发展过程中,小胶质细胞对神经突触调节异常,突触结构的退化与AD症状的发展同步,因此,小胶质细胞对神经突触的异常调节可能是AD发展的重要原因[48]。
AD患者中有70%为女性,女性患者数量远远高于男性。尽管AD的发生和发展很可能受到小胶质细胞免疫功能的影响,并且大量证据也表明雄性和雌性的炎症反应有显着差异,但这些差异是否会导致男性和女性AD易感性的差异尚不清楚。未来的研究需要回答女性自身免疫增强是否是导致女性AD风险增加的主要原因。
3.3.2 、帕金森病
帕金森病(Parkinson's disease,PD)是一种常见的神经系统退行性疾病,其主要病理特征是黑质多巴胺能神经元进行性丢失和黑质残存神经元胞质内出现嗜酸性包涵体,即路易小体[49]。帕金森病的主要运动症状包括运动迟缓、僵硬、静止性震颤和步态障碍,精神症状包括自主性神经功能障碍、认知异常、焦虑、抑郁以及冷漠等[50]。Vegeto等[51]指出,小胶质细胞过度分泌含有神经毒性的炎症介质可对神经系统造成损伤,该过程导致小胶质细胞的过度激活,进而导致黑质-纹状体多巴胺(nigral-striatal dopamine,NSDA)系统神经元死亡。帕金森病的患病风险存在明显的性别差异,所有年龄段的男性患帕金森病的风险都是女性的1.5倍[52]。帕金森病发病率的差异可能是由于男性和女性在NSDA系统的组成和反应上有区别,与女性相比,男性的NSDA系统有更多的多巴胺能神经元和更强烈的多巴胺的释放。与女性帕金森病患者相比,男性帕金森病患者纹状体中TNF-α、IL-1β和IFN-γ的表达量较高,推测与NSDA系统中过度激活的小胶质细胞数量增多有关[51]。
4、 展望
目前,人们对小胶质细胞的起源和功能已经有了一定的认识,但仍需要有更多研究去探讨小胶质细胞的发育及功能,尤其应当重视性别分化中小胶质细胞表现的不同以及这种性别分化在神经系统相关疾病发生发展中的作用。未来应充分认识性别分化中小胶质细胞的差异,而小胶质细胞有望成为治疗或缓解神经系统相关疾病的新的靶点。
参考文献
[1] Aguzzi A, Barres BA, Bennett ML. Microglia:scapegoat,saboteur, or something else? Science, 2013, 339:156-61
[2] Ginhoux F, Prinz M. Origin of microglia:current concepts and past controversies. Cold Spring Harb Perspect Biol,2015, 7:a020537
[3] Nikodemova M, Kimyon RS, De I, et al. Microglial numbers attain adult levels after undergoing a rapid decrease in cell number in the third postnatal week. J Neuroimmunol, 2015, 278:280-8
[4] Rosenbauer F, Tenen DG. Transcription factors in myeloid development:balancing differentiation with transformation.Nat Rev Immunol, 2007, 7:105-17
[5] Kierdorf K, Erny D, Goldmann T, et al. Microglia emerge from erythromyeloid precursors via Pu.1-and Irf8-dependent pathways. Nat Neurosci, 2013, 16:273-80
[6] Zusso M, Methot L, Lo R, et al. Regulation of postnatal forebrain amoeboid microglial cell proliferation and development by the transcription factor Runx1. J Neurosis, 2012, 32:11285-98
[7] Erblich B, Zhu L, Etgen AM, et al. Absence of colony stimulation factor-1 receptor results in loss of microglia,disrupted brain development and olfactory deficits. PLoS One, 2011, 6:e26317
[8] Elmore MR, Najafi AR, Koike MA, et al. Colonystimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron, 2014, 82:380-97
[9] Greter M, Lelios I, Pelczar P, et al. Stroma-derived interleukin-34 controls the development and maintenance of langerhans cells and the maintenance of microglia.Immunity, 2012, 37:1050-60
[10] Easley-Neal C, Foreman O, Sharma N, et al. CSF1R ligands IL-34 and CSF1 are differentially required for microglia development and maintenance in white and gray matter brain regions. Front Immunol, 2019, 10:2199
[11] Zoller T, Schneider A, Kleimeyer C, et al. Silencing of TGF-βsignalling in microglia results in impaired homeostasis. Nat Commun, 2018, 9:4011
[12] Tremblay M?, Lowery RL, Majewska AK. Microglial interactions with synapses are modulated by visual experience. PLoS Biol, 2010, 8:e1000527
[13] Kettenmann H, Kirchhoff F, Verkhratsky A. Microglia:new roles for the synaptic stripper. Neuron, 2013, 77:10-8
[14] Lee M, McGeer EG, McGeer PL. Mechanisms of GABA release from human astrocytes. Glia, 2011, 59:1600-11
[15] Colonna M, Butovsky O. Microglia function in the central nervous system during health and neurodegeneration.Annu Rev Immunol, 2017, 35:441-68
[16] Abellanas MA, Zamarbide M, Basurco L, et al. Midbrain microglia mediate a specific immunosuppressive response under inflammatory conditions. J Neuroinflammation,2019, 16:233
[17] Amateau SK, McCarthy MM. Induction of PGE2 by estradiol mediates developmental masculinization of sex behavior. Nat Neurosci, 2004, 7:643-50
[18] Lenz KM, Nugent BM, Haliyur R, et al. Microglia are essential to masculinization of brain and behavior. J Neurosci, 2013, 33:2761-72
[19] Schwarz JM, Sholar PW, Bilbo SD. Sex differences in microglial colonization of the developing rat brain. J Neurochem, 2012, 120:948-63
[20] Hanamsagar R, Alter MD, Block CS, et al. Generation of a microglial developmental index in mice and in humans reveals a sex difference in maturation and immune reactivity. Glia, 2017, 65:1504-20
[21] Xu B, Lian S, Li SZ, et al. GABAB receptor mediate hippocampal neuroinflammation in adolescent male and female mice after cold expose. Brain Res Bull, 2018, 142:163-75
[22] Meneses G, Rosetti M, Espinosa A, et al. Recovery from an acute systemic and central LPS-inflammation challenge is affected by mouse sex and genetic background. PLoS One, 2018, 13:e0201375
[23] Kodama L, Gan L. Do microglial sex differences contribute to sex differences in neurodegenerative diseases. Trends Mol Med, 2019, 25:741-9
[24] Bekhbat M, Neigh GN. Sex differences in the neuroimmune consequences of stress:focus on depression and anxiety. Brain Behav Immun, 2018, 67:1-12
[25] Mandy W, Chilvers R, Chowdhury U, et al. Sex differences in autism spectrum disorder:evidence from a large sample of children and adolescents. J Autism Dev Disord, 2012, 42:1304-13
[26] Hanamsagar R, Bilbo SD. Sex differences in neurodevelopmental and neurodegenerative disorders:focus on microglial function and neuroinflammation during development. J Steroid Biochem Mol Biol, 2016, 160:127-33
[27] Fombonne E. Epidemiological surveys of autism and other pervasive developmental disorders:an update. J Autism Dev Disord, 2003, 33:365-82
[28] Hattier MA, Matson JL, Tureck K, et al. The effects of gender and age on repetitive and/or restricted behaviors and interests in adults with autism spectrum disorders and intellectual disability. Res Dev Disabil, 2011, 32:2346-51
[29] Werling DM, Parikshak NN, Geschwind DH. Gene expression in human brain implicates sexually dimorphic pathways in autism spectrum disorders. Nat Commun,2016, 7:10717
[30] Paul A. Why is depression more prevalent in women? J Psychiatry Neurosci, 2015, 40:219-21
[31] Dowlati Y, Herrmann N, Swardfager W, et al. A metaanalysis of cytokines in major depression. Biol Psychiatry,2010, 67:446-57
[32] Seney ML, Huo Z, Cahill K, et al. Opposite molecular signatures of depression in men and women. Biol Psychiatry, 2018, 84:18-27
[33] O'Leary DS, Flaum M, Kesler ML, et al. Cognitive correlates of the negative, disorganized, and psychotic symptom dimensions of schizophrenia. J Neuropsychiatry Clin Neurosci, 2000, 12:4-15
[34] Davis J, Eyre H, Jacka FN, et al. A review of vulnerability and risks for schizophrenia:beyond the two-hit hypothesis.Neurosci Biobehav Rev, 2016, 65:185-94
[35] Schmidt MJ, Mirnics K. Neurodevelopment, GABA system dysfunction, and schizophrenia. Neuropsychopharmacology, 2015, 40:190-206
[36] Albert Y, Shih-Jen T. New targets for schizophrenia treatment beyond the dopamine hypothesis. Int J Mol Sci,2017, 18:1689-703
[37] Bradford A. The dopamine and glutamate theories of schizophrenia:a short review. Curr Anaesth Crit Care,2009, 20:240-1
[38] De Picker LJ, Morrens M, Chance SA, et al. Microglia and brain plasticity in acute psychosis and schizophrenia illness course:a meta-review. Front Psychiatry, 2017, 8:238
[39] Miller BJ, Goldsmith DR. Towards an immunophenotype of schizophrenia:progress, potential mechanisms, and future directions. Neuropsychopharmacology, 2016, 42:299-317
[40] Gosselin D, Skola D, Coufal NG, et al. An environmentdependent transcriptional network specifies human microglia identity. Science, 2017, 356:eaal3222
[41] Ma C, Gu C, Huo Y, et al. The integrated landscape of causal genes and pathways in schizophrenia. Transl Psychiatry, 2018, 8:67
[42] Andersen SL. Trajectories of brain development:point of vulnerability or window of opportunity? Neurosci Biobehav Rev, 2003, 27:3-18
[43] Sarvari M, Hrabovszky E, Kallo I, et al. Estrogens regulate neuroinflammatory genes via estrogen receptorsɑandβin the frontal cortex of middle-aged female rats. J Neuroinflammation, 2011, 8:82
[44] Oboudiyat C, Glazer H, Seifan A, et al. Alzheimer's disease. Semin Neurol, 2013, 33:313-29
[45] Hansen D V, Hanson J E, Sheng M. Microglia in Alzheimer's disease. J Cell Biol, 2018, 217:459-72
[46] Fisher DW, Bennett DA, Dong H. Sexual dimorphism in predisposition to Alzheimer's disease. Neurobiol Aging,2018, 70:308-24
[47] Zhang B, Gaiteri C, Bodea LG, et al. Integrated systems approach identifies genetic nodes and networks in lateonset Alzheimer’s disease. Cell, 2013, 153:707-20
[48] Hong S, Beja-Glasser VF, Nfonoyim BM, et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science, 2016, 352:712-6
[49] Cerri S, Mus L, Blandini F. Parkinson's disease in women and men:what's the difference? J Parkinsons Dis, 2019, 9:501-15
[50] Picillo M, Erro R, Amboni M, et al. Gender differences in non-motor symptoms in early Parkinsons disease:a2-years follow-up study on previously untreated patients.Parkinsonism Relat Disord, 2014, 20:850-4
[51] Vegeto E, Villa A, Della Torre S, et al. The role of sex and sex hormones in neurodegenerative diseases. Endocr Rev,2020, 41:273-319
[52] Picillo M, Nicoletti A, Fetoni V, et al. The relevance of gender in Parkinson’s disease:a review. J Neurol, 2017,264:1583-607





