摘要:伴随环境和资源紧缺问题日益突出,开发绿色可持续发展的新材料,拓展植物材料的应用空间具有重大的意义。本文对丝瓜络纤维的天然特性如形态、密度、孔隙率、纤维直径、化学组成和力学性能进行了概述;同时结合近年来国内外的研究成果,重点综述了丝瓜络纤维在环境保护、增强复合材料、纳米纤维素制备、细胞固定化载体及生物反应器等领域的综合利用研究进展。针对目前国内在开发丝瓜络纤维新用途和高附加值利用方面的研究现状,提出了今后丝瓜络纤维在拓宽其应用范围和加快工业化应用步伐方面的建议,并对丝瓜络纤维的开发利用前景进行了展望
随着社会的发展,环境和资源紧缺问题日益突出,人们已将目光重点投向寻求成本低廉且性能优良的天然可再生生物质资源的综合开发利用研究,以期能逐步摆脱日渐枯竭的石化资源对人类生活、社会生产发展所带来的制约。自然界中种类繁多的生物质材料不仅具有来源丰富、可生物降解和可持续再生等特点,而且通常皆由纳米至亚微米尺度的结构单元自组装形成刚柔并具的多尺度复杂结构,呈现出天然的性能优越性和功能多样性。天然植物纤维材料在地球上储量巨大,被誉为高度可持续利用的材料,开展此类材料的高值化综合利用已然成为国内外科研人员的研究热点之一。
丝瓜为葫芦科丝瓜属一年生攀缘性草本植物,作为一种新兴的经济作物,在国内外热带、亚热带地区均有广泛种植[1-4].丝瓜浑身是宝,除了具有很高的食用和药用价值之外,成熟丝瓜籽可以用于提取丝瓜籽油或制备生物柴油[5];由丝瓜络加工而成的各类绿色生活、保健用品也深受国内外消费者的欢迎[6].丝瓜络是成熟丝瓜果实除去外皮和种子后获得的纤维质网状结构的天然维管束组织,又名丝瓜海绵、植物海绵。近年来,随着科技的发展,丝瓜络经科学开发,已悄然成为一种新型的天然工业材料,在包装、消声、过滤、保温、减震和抗冲击缓冲器等工程领域获得应用[7].目前,国内的丝瓜络日用产品已打开国际市场,丝瓜络产业也实现了种植、加工、产品质检和销售的规范化、科学化、标准化和现代化,每年可实现产值上亿元[8].本文以丝瓜络优良的天然理化特性为背景,对丝瓜络的综合利用现状和发展前景进行综述。
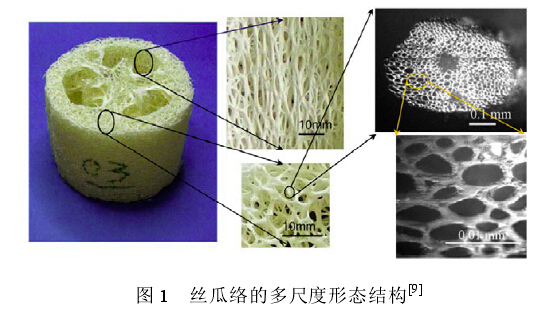
丝瓜络的外观多呈白色或者黄白色,为长圆筒形或长梭形,略弯曲,两端较细,长约 25~60cm,直径约 5~10cm.丝瓜络是由多层丝状纤维纵横交织而成的立体多孔网状物,具有体轻、质韧、耐磨、富有弹性等天然特性;横切面可见 3 室子房形成的 3 个大空腔,丝瓜络的多尺度形态结构如图 1所示[9].
丝瓜络的主要化学组成为纤维素、半纤维素和木质素,三者的相对含量高低与丝瓜络的生长条件和生长期有关,文献报道的丝瓜络化学成分及其物理特性参数列于表 1[4,10-14].由表 1 中数据可见,丝瓜络的 α-纤维素含量高达 60%以上,而灰分含量则较低;质轻且孔隙结构发达,是一种物丰价廉的优质植物纤维材料。Laidani 等[15]研究了丝瓜络纤维的热物理性质,结果显示丝瓜络纤维的热容及对各种吸附水的脱附行为与木质纤维相近。
丝瓜络整体是由多层丝状纤维自组装而成的立体交织网状物,丝状纤维在其不同部位的连接方式和空间取向存在差异,因此导致丝瓜络不同部位的力学性能亦不尽相同。Shen 等[16]首次对圆柱状丝瓜络样品的力学性能进行了测试,结果显示丝瓜络柱状体的刚度、强度以及能量吸收性能可与泡沫铝、Ni-P 微晶合金等金属基多孔材料相媲美,预示着丝瓜络是一种极具发展潜力的环境友好型轻质多孔工程材料。他们后来还进一步考察了丝瓜络柱状体样品的动态力学性能,研究发现丝瓜络的压缩强度、平台应力和比吸收能均呈现出明显的应变速率效应。为了深入研究丝瓜络的多级结构与力学性能之间的关系,Chen 等[17]分别截取出柱状丝瓜络样品的4 个不同结构部位和单根丝瓜络纤维,对其结构和力学性能展开研究。结果显示丝瓜络纤维呈天然多孔复合结构,单根纤维(长度约 30mm,直径 0.3~0.5mm)的杨氏模量和断裂强度与木质纤维相当,分别约为 2.3GPa 和 103MPa,并得出了丝瓜络外圆周壁部位的平均力学性能约是其芯部1.6倍的结论。
丝瓜络纤维(luffa cylindrica fibers,LCF)天生具 有 很 发 达 的 多 级 孔 隙 结 构 , 其 BET(Brunauer-Emmertt-Teller equation)比表面积平均值可达 123m2/g,因此可以作为有机染料分子或离子型污染物的天然吸附剂[18-19].天然丝瓜络纤维对吸附质的吸附过程多为自发的物理吸附过程,吸附能力与吸附质的初始浓度、溶液的 pH 值、吸附时间、温度等因素有关,其吸附等温线类型基本都符合单分子层吸附的 Langmuir 方程。Alt?n???k 等[2]考察了 LCF 对孔雀绿染料(malachite green,MG)的吸附性能。热动力学研究结果表明,MG 在 LCF 上的吸附行为表现为自发的吸热吸附特征,在 pH≥5的条件下 LCF 对 MG 的最大吸附量达到了29.4mg/g.此外,Demir 等[18]研究指出 LCF 对亚甲基蓝(methylene blue,MB)的吸附容量高达 49mg/g,明显优于文献报道的多种其他纤维质类天然吸附剂。最近,Ye 等[20]研究了溴化十六烷吡啶(1-cetylpyridinium bromide,CPB)在 LCF 上的吸附行为,根据 Langmuir 等温吸附方程计算出 LCF对 CPB 的吸附容量为 122mg/g,显示了其在治理水环境中阳离子表面活性剂有害物质的应用潜力。
为了进一步提升 LCF 的吸附性能,扩大 LCF作为天然吸附剂的应用空间,对 LCF 进行表面改性以期获得预期的表面理化性质是一种行之有效的方法[19].研究发现,利用乙烯基单体对天然植物纤维表面进行改性,有助于改善天然纤维的弹性、吸水性、离子交换能力以及热稳定性等。Gupta 等[21]制备了丙烯酸接枝改性的 LCF,改性后的 LCF 表现出更优异的热稳定性,并且能有效吸附亚甲基蓝(最大吸附量为 62.15mg/g)和 Mg2+等金属离子。
LCF 拥有天然纤维作为复合材料增强相的优势,如低密度、高强度、可再生性、可降解性和天然网络结构[22].LCF 的表面理化特性,如吸附、润湿、热稳定性、黏附性和化学反应性等,对其所制备的生物复合材料的综合应用性能影响显着[4].为了克服 LCF 的强吸水性及其与有机高分子基体之间相容性差等不足,需要对 LCF 表面进行物理或化学改性处理。
在对 LCF 进行化学改性之前,通常需要用稀碱溶液对 LCF 进行丝光化预处理。丝光化预处理可以在不破坏 LCF 结构完整性的基础上,有效去除包覆在丝瓜络纤维表面的胶质、蜡质等憎水性组分,同时对半纤维素、木质素也有一定的脱除效果,增大了 LCF 的表面粗糙度,有助于改善 LCF 的反应可及度和结晶性,为其化学改性创造有利条件[4,19,23].
为了改善 LCF 与非极性聚合物基体的界面结合强度,Botaro 等[24]用二苯酮四甲酸二酐对 LCF 进行酯化改性后,制备了改性 LCF/乙烯基酯树脂复合材料。研究结果显示,添加改性 LCF 后,该复合材料的热稳定性和力学性能明显增强。Tanobe 等[4]分别用 2% NaOH 和 1%~3%甲基丙烯酰胺水溶液对丝瓜络进行预处理。结果显示甲基丙烯酰胺预处理对LCF 会产生显着的破坏作用。相比之下,NaOH 预处理可以在一定程度上脱除丝瓜络中的木质素和半纤维素,而且在不破坏 LCF 基本化学结构的基础上可以有效增大其比表面积和热稳定性。因此,利用NaOH 稀溶液处理丝瓜络,有利于将其进一步作为复合材料的绿色增强体进行使用。Demir 等[3]制备了 LCF/聚丙烯(polypropylene,PP)复合材料,进一 步 考 察 了 3- 氨 丙 基 三 乙 氧 基 硅 烷[(3-aminopropyl)-triethoxysilane,AS]、(3-巯基丙基)三甲氧基硅烷[3-(trimethoxysilyl)-1-propanethiol,MS] 和马来酸酐接枝聚丙烯( maleic anhydridegrafted polypropylene,MAPP )这三种偶联剂对LCF/PP 复合材料的形貌、力学和吸水性能的影响。
Saw 等[22]则利用分层铺叠和热压成型技术,制备了热稳定性、力学性能和防水性能优良的糠醇接枝 改 性 的 丝 瓜 络 纤 维 ( furfuryl alcohols-luffacylindrica fibers,FA-LCF)/环氧树脂复合材料。由于 FA-LCF 与环氧树脂基体之间存在化学键合作用,力学性能测试结果显示 FA-LCF/环氧树脂复合材料的拉伸强度、弹性模量分别是同等条件下未经改性处理的 LCF/环氧树脂复合材料的 2 倍和 2.23倍。热分析结果表明 FA-LCF/环氧树脂复合材料的起始热分解温度也上升至 334℃,比纯的环氧树脂基体和 LCF/环氧树脂复合材料分别提高了 111℃和76℃。不仅如此,FA-LCF/环氧树脂复合材料的疏水性较之 LCF/环氧树脂复合材料也有明显改善。
Kaewtatip 等[25]也采用热压成型技术制备了一系列LCF/热塑性淀粉(thermoplastic starch,TPS)复合材料。由于 LCF 和 TPS 化学结构相似,故 LCF 增强体与 TPS 基体之间具有很好的相容性。研究结果显示,在 TPS 中掺入 LCF 后,该复合材料的热稳定性、拉伸强度和疏水性均有所改善。当 LCF 添加量达到10%时,复合材料的抗拉强度是TPS的2倍,该复合材料可望用于生物塑料领域。Bal 等[26]在碱预处理后的 LCF 表面包裹壳聚糖(chitosan,CS)涂层,为纳米银粒子的原位生成提供一个天然的微型 反 应 场 所 , 制 备 了 具 有 长 效 抗 菌 性 能 的Ag-LCF-CS 生物复合材料。该材料可望在药物控释系统和创伤敷料等领域获得应用。Akgül 等[10]还将LCF 成功应用于中密度纤维板材的制备,所制备出的板材力学性能符合欧洲标准。
Yang 等[19]在微波辅助作用下,成功实现了 LCF的高效酯化改性。对比改性 LCF 的酯化率可知,经20min 微波辐照后的酯化率约是传统油浴加热90min 所得酯化率的 25 倍。Kocak 等[27]联合利用微波加热和超声作用,分别利用甲酸和乙酸对 LCF 表面进行化学改性,有效提升了 LCF 的力学性能。
Martínez-Barrera 等[28]则考察了 γ 射线辐照剂量和LCF 含量对石英砂/间苯二甲酸聚酯水泥复合材料力学性能的影响。结果表明,用 LCF 增强的聚酯水泥经过 γ 射线辐照处理后,其压缩应变、弯曲应变和动态弹性模量都得到提升。在 100kGy 的辐射剂量下,添加了 0.9% LCF 的聚酯水泥可以获得最大的弯曲形变。Wang 等[29]利用 110W 的等离子体束对 LCF 进行 10s 的辐照处理后,LCF 中纤维素的平均含量由处理前的 66.19%明显上升至 85.65%,有利于增强其热稳定性。相对于传统的碱丝光化预处理方式,离子体束辐照为 LCF 的表面改性提供了一种绿色、高效的新途径。
纳米纤维素作为一种新型的生物材料,由于其特殊的纳米尺寸结构、优良的力学性能和光学性能而成为纤维素科学与技术的前沿研究热点之一。丝瓜络来源丰富且富含纤维素,利用 LCF 制备高附加值的纳米纤维素晶体及其衍生化产品具有优良的生态和经济效益。丝瓜络纳米纤维素在制备纳米生物纤维增强的绿色复合材料领域具有较大的应用潜力[30].
吴巧妹等[14]表征了丝瓜络纯化纤维素的纤维形态,结果显示其纤维平均特性与杉木浆相近,并进一步利用超声辅助酸水解丝瓜络纯化纤维素,制备了长度约在 200~400nm、直径约 10nm 的高得率(79%)棒状丝瓜络纳米纤维素晶体。Siqueira 等[13]分别通过高压均质物理法和硫酸水解法制备了高结晶度的丝瓜络微纤化纤维素和纳米纤维素。最近,他们还以丝瓜络纳米纤维素为增强相,制备了聚已内酯(polycaprolactone,PCL)为基体的生物纳米复合材料[31].研究发现利用十八烷基异氰酸酯对丝瓜络纳米纤维素晶体进行表面化学改性后,大大改善了它与 PCL 基体之间的相容性,从而使所制备的纳米复合材料呈现出更加优异的热稳定性和力学性能。
细胞固定化技术是将生物活性细胞利用物理或化学的方法与固体的水不溶性载体相结合,在限定的空间范围进行生长、繁殖和新陈代谢等生命活动,使其保持活性并可以反复用于获得细胞的酶和代谢产物的一种新兴生物技术[4,32].与传统的悬浮生物处理法相比,固定后的活性细胞可以进行高密度连续的微生物发酵,极大提高了反应效率和代谢产物的生产能力。目前,固定化细胞技术的应用已遍及工业、医学、制药、化学分析、环境保护、能源开发等多个领域[33].天然高分子载体材料是一种主要的细胞固定化载体材料,具有无毒无害、传质性能好、生物相容性佳、物丰价廉、制备形式灵活多样等优点[34].丝瓜络是一种具有连续型多通道微孔网状结构的轻质天然高分子材料,具备了作为细胞固定化载体材料的特质。近年来,天然丝瓜络纤维应用于固定化细胞培养基和生物反应器[35]、生物组织工程支架材料的研究热度迅速攀升,正是得益于丝瓜络质轻、孔隙结构发达、理化性质稳定、良好的生物相容性和优越的力学性能[36].以丝瓜络作为细胞固定化载体,能够解决固定化中遇到一系列的问题:譬如缺乏用于生长细胞所需的足够空间[37-38];由于机械强度不足和合成聚合物的毒性引起酶的活性降低、破裂[39-40];稳定性欠佳和成本相对较高等[40-41].1993 年,Iqbal 等[42]最先将丝瓜络作为生物载体应用于紫藻活性细胞的固定化培养。此后,基于 LCF 的细胞固定化技术研究发展迅速,在固定化培养微藻细胞[42-43]、真菌菌丝[35,44]、酵母和细菌[41]、植物细胞[40,42,45]、哺乳动物肝细胞等[46-47]所取得的成效令人瞩目,逐步得到分子生物学家和生物化学家的广泛重视。Chen 等[48]首次将丝瓜络作为人类肝细胞的培养基质,发现在丝瓜络支持物上生长的肝细胞具有很高的肝功能活性,该研究预示着天然丝瓜络生物基体在培育人造器官方面的潜在应用价值。
最近,Saeed 和 Saudagar 等[49-50]综述了丝瓜络细胞固定化载体材料在生物乙醇、有机酸、酶和次级代谢产物生产方面的研究进展。与细胞自由悬浮培养法、传统的天然和人工合成高分子载体材料相比,丝瓜络载体在细胞固定化培养技术方面的表现更胜一筹。丝瓜络固定化细胞体系已被有效地应用于各种生物化学品的生产、生物农药的降解、富含无机和有机污染物的废水处理等方面。此外,基于丝瓜络载体材料发展起来的填充床、流化床、膜反应器、生物转盘等细胞固定化生物反应器还可以实现微生物发酵等生物触媒反应的连续、大型化和高度自动化生产[49-51].多种研究迹象表明,丝瓜络作为一种质优价廉、无毒、可再生的环境友好型天然高分子材料,在细胞固定化技术领域的应用极具竞争力[36,52].
丝瓜络天生拥有高度复杂且孔隙发达的多尺度结构,以丝瓜络为生物模板可以实现具有特定形貌和性能的新型无机材料的仿生合成。Zampieri 等[53]以丝瓜络为生物模板,制备了结构复杂且具有多级孔结构的自支撑型沸石块体材料。该仿生结构沸石较好地复制了天然丝瓜络的结构形态特征,有望用于催化、吸附、分离和传感器等领域。Mazali 等[54]也将丝瓜络作为生物模板,简便地实现了具有多尺度仿生结构碳酸钙和羟基磷灰石材料的形貌可控制备。El-Roz 等[55]则通过溶胶-凝胶法制备了稳定性和光催化性能良好的纳米 TiO2/丝瓜络复合材料。此外,李园园等[56-57]以丝瓜络为原料,分别以 KOH和 H3PO4为活化剂,制备了大比表面积、吸附性能优异的丝瓜络活性炭样品,为丝瓜络的高值化利用提供了一种新借鉴。
伴随现代科技的不断发展,丝瓜络作为一种绿色的可再生资源,其独特的轻质多孔立体网状结构和优良的综合性能,使其日益在工程材料、生物技术、环境工程等领域开辟出崭新而广阔的应用空间。
在丝瓜络的综合利用研究方面,国际上已经针对丝瓜络纤维的改性及其在生物技术领域的应用开展了较为广泛的基础性研究,并取得了一些可喜的阶段性成果,但绝大部分研究尚属起步阶段。相比之下,目前国内在开发丝瓜络纤维新用途和高附加值利用方面的研究则较少:相关研究一方面主要集中在其药用价值上;另一方面则突出表现为低价值加工利用特点,以商业化生产各类天然丝瓜络的日用低端产品居多。因此,要进一步重视和加强丝瓜络纤维增值利用的基础性研究,拓展新的应用领域,实现丝瓜络这一优势生物质资源的高值化利用。综上所述,丝瓜络的发展前景与挑战并存,为了拓宽其应用范围并加快工业化应用步伐,建议重点进行以下几方面的研究:①开发通用性强的高端丝瓜络纤维工业化产品,并制定相关行业的产品生产及应用性能评价标准;②联合利用物理-化学改性技术,切实实现丝瓜络纤维的高效和功能多样化改性,获取能满足特定使用性能要求的多品种丝瓜络纤维衍生物产品;③深入开展丝瓜络固定化细胞生物反应器的优化设计研究,进一步提升实际生产效率。
参考文献:
[1] Oboh I O,Aluyor E O. Luffa cylindrical-An emerging cash crop[J].African Journal of Agricultural Research,2009,4(8):684-688.
[2] Alt?n???k A,Gür E,Seki Y. A natural sorbent,luffa cylindrical for theremoval of a model basic dye[J]. Journal of Hazardous Materials,2010,179(1):658-664.
[3] Demir H,Atikler U,Balk?se D,et al. The effect of fiber surfacetreatments on the tensile and water sorption properties ofpolypropylene-luffa fiber composites[J]. Composites Part A:AppliedScience and Manufacturing,2006,37(3):447-456.
[4] Tanobe V O A,Sydenstricker T H D,Munaro M,et al. Acomprehensive characterization of chemically treated Braziliansponge-gourds(luffa cylindrica)[J]. Polymer Testing,2005,24(4):474-482.
[5] Adewuyi A,Oderinde R A,Rao B,et al. Blighia unijugata and luffacylindrica seed oils:Renewable sources of energy for sustainabledevelopment in rural Africa[J]. BioEnergy Research,2012,5(3):713-718.
[6] 颜国纲,郑振佳,时新刚,等。 丝瓜的营养价值及其综合利用研究进展[J]. 中国果菜,2011(7):35-36[7] Shen J,Min Xie Y,Huang X,et al. Mechanical properties of luffasponge[J]. Journal of the Mechanical Behavior of BiomedicalMaterials,2012,15:141-152.
[8] 黎炎,李文嘉,王益奎,等。 丝瓜络在医药,日用洗涤及保健品等方面的应用研究进展[J]. 广西农业科学,2010(1):85-87.
[9] Shen J H,Xie Y M,Huang X D,et al. Behaviour of luffa spongematerial under dynamic loading[J]. International Journal of ImpactEngineering,2013,57:17-26.
[10] Akgül M,Korkut S,?aml?bel O,et al. Some chemical properties ofluffa and its suitability for medium density fiberboard (MDF)production[J]. BioResources,2013,8(2):1709-1717.
[11] Espert A,Vilaplana F,Karlsson S. Comparison of water absorption innatural cellulosic fibres from wood and one-year crops inpolypropylene composites and its influence on their mechanicalproperties[J]. Composites Part A : Applied Science andManufacturing,2004,35(11):1267-1276.
[12] Guimar?es J L,Frollini E,Da Silva C G,et al. Characterization ofbanana,sugarcane bagasse and sponge gourd fibers of Brazil[J].Industrial Crops and Products,2009,30(3):407-415.
[13] Siqueira G,Bras J,Dufresne A. Luffa cylindrica as a lignocellulosicsource of fiber , microfibrillated cellulose and cellulosenanocrystals[J]. BioResources,2010,5(2):727-740.
[14] 吴巧妹,陈思源,陈燕丹。 丝瓜络纳米纤维素晶体的制备与表征[J].西北农林科技大学学报:自然科学版,2014,42(4):229-234.
[15] Laidani Y,Hanini S,Mortha G,et al. Study of a fibrous annual plant,luffa cylindrica for paper application Part Ⅰ:Characterization of thevegetal[J]. Iranian Journal of Chemistry & Chemical Engineering:International English Edition,2012,31(4):119-129.
[16] Shen J,Min X Y,Huang X,et al. Mechanical properties of luffasponge[J]. Journal of the Mechanical Behavior of BiomedicalMaterials,2012,15:141-152.
[17] Chen Q,Shi Q,Gorb S N,et al. A multiscale study on the structuraland mechanical properties of the luffa sponge from luffa cylindricaplant[J]. Journal of Biomechanics,2014,47(6):1332-1339.
[18] Demir H,Top A,Balk?se D,et al. Dye adsorption behavior of luffacylindrica fibers[J]. Journal of Hazardous Materials,2008,153(1):389-394.
[19] Yang H,Mao H,Lu Q,et al. Esterification of luffa with aceticanhydride under microwave radiation determined by FTIR[J]. Journalof Macromolecular Science,Part B:Physics,2010,50(2):319-328.
[20] Ye C,Hu N,Wang Z. Experimental investigation of luffa cylindricaas a natural sorbent material for the removal of a cationic surfactant[J].Journal of the Taiwan Institute of Chemical Engineers,2013,44(1):74-80.
[21] Gupta V K,Agarwal S,Singh P,et al. Acrylic acid grafted cellulosicluffa cylindrical fiber for the removal of dye and metal ions[J].Carbohydrate Polymers,2013,98(1):1214-1221.
[22] Saw S K,Purwar R,Nandy S,et al. Fabrication,characterization,and evaluation of luffa cylindrica fiber reinforced epoxycomposites[J]. BioResources,2013,8(4):4805-4826.
[23] Ghali L,Msahli S,Zidi M,et al. Effect of pre-treatment of luffa fibreson the structural properties[J]. Materials Letters,2009,63(1):61-63.
[24] Botaro V R,Novack K M,Siqueira E J. Dynamic mechanicalbehavior of vinylester matrix composites reinforced by luffacylindrica modified fibers[J]. Journal of Applied Polymer Science,2012,124(3):1967-1975.
[25] Kaewtatip K,Thongmee J. Studies on the structure and properties ofthermoplastic starch/luffa fiber composites[J]. Materials & Design,2012,40:314-318.
[26] Bal K E,Bal Y,Cote G,et al. Morphology and antimicrobialproperties of Luffa cylindrica fibers/chitosan biomaterial asmicro-reservoirs for silver delivery[J]. Materials Letters,2012,79:238-241.
[27] Kocak D,Merdan N,Yuksek M,et al. Effects of chemicalmodifications on mechanical properties of luffa cylindrica[J]. AsianJournal of Chemistry,2013,25(2):637-641.
[28] Martínez-Barrera G,Vigueras-Santiago E,Martínez-López M,et al.Luffa fibers and gamma radiation as improvement tools of polymerconcrete[J]. Construction and Building Materials,2013,47:86-91.
[29] Wang Y,Shen X Y. Optimum plasma surface treatment of luffafibers[J]. Journal of Macromolecular Science,Part B,2012,51(4):662-670.
[30] Siqueira G , Bras J , Dufresne A. Cellulose whiskers versusmicrofibrils:Influence of the nature of the nanoparticle and its surfacefunctionalization on the thermal and mechanical properties ofnanocomposites[J]. Biomacromolecules,2008,10(2):425-432.
[31] Siqueira G,Bras J,Follain N,et al. Thermal and mechanicalproperties of bio-nanocomposites reinforced by luffa cylindricacellulose nanocrystals[J]. Carbohydrate Polymers,2013,91(2):711-717.
[32] 王洪祚,刘世勇。 酶和细胞的固定化[J]. 化学通报,1997(2):22-27.
[33] 张磊,张烨,侯红萍。 固定化细胞技术的研究进展[J]. 四川食品与发酵,2006(2):17-18.
[34] 白燕,王士斌,刘源岗。 细胞固定化载体材料的研究进展及应用[J].广东化工,2010,37(4):11-12.
[35] Pekdemir T,Keskinler B,Yildiz E,et al. Process intensification inwastewater treatment : Ferrous iron removal by a sustainablemembrane bioreactor system[J]. Journal of Chemical Technology andBiotechnology,2003,78(7):773-780.
[36] Krusong W,Tantratian S. Acetification of rice wine by acetobacteraceti using loofa sponge in a low-cost reciprocating shaker[J]. Journalof Applied Microbiology,2014,117(5):1348-1357.
[37] Jin Y L,Alex Speers R. Flocculation of Saccharomyces cerevisiae[J].Food Research International,1998,31(6):421-440.
[38] Macaskie L E,Wates J M,Dean A C R. Cadmium accumulation by aCitrobacter sp. immobilized on gel and solid supports:Applicabilityto the treatment of liquid wastes containing heavy metal cations[J].Biotechnology and Bioengineering,1987,30(1):66-73.
[39] Boyaval P,Goulet J. Optimal conditions for production of lactic acidfrom cheese whey permeate by Ca-alginate-entrapped Lactobacillushelveticus[J]. Enzyme and Microbial Technology,1988,10(12):725-728.
[40] Liu Y K,Seki M,Tanaka H,et al. Characteristics of loofa (luffacylindrical) sponge as a carrier for plant cell immobilization[J].Journal of Fermentation and Bioengineering,1998,85(4):416-421.
[41] Ogbonna J C,Liu Y C,Liu Y K,et al. Loofa(luffa cylindrica spongeas a carrier for microbial cell immobilization[J]. Journal ofFermentation and Bioengineering,1994,78(6):437-442.
[42] Iqbal M,Zafar S I. The use of fibrous network of matured dried fruitof luffa aegyptica as immobilizing agent[J]. BiotechnologyTechniques,1993,7(1):15-18.
[43] Jones R F,Speer H L,Kury W. Studies on the growth of the red algaporphyridium cruentum[J]. Physiologia Plantarum,1963,16(3):636-643.
[44] Roble N,Ogbonna J,Tanaka H. A novel circulating loop bioreactorwith cells immobilized in loofa (luffa cylindrical) sponge for thebioconversion of raw cassava starch to ethanol[J]. AppliedMicrobiology and Biotechnology,2003,60(6):671-678.
[45] Murashige T,Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures[J]. Physiologia Plantarum,1962,15(3):473-497.
[46] Chen J P,Lin T C. Loofa sponge as a scaffold for culture of rathepatocytes[J]. Biotechnology Progress,2005,21(1):315-319.
[47] Chen J P,Lin T C. High-density culture of hepatocytes in apacked-bed bioreactor using a fibrous scaffold from plant[J].Biochemical Engineering Journal,2006,30(2):192-198.
[48] Chen J P,Yu S C,Hsu B R S,et al. Loofa sponge as a scaffold for theculture of human hepatocyte cell line[J]. Biotechnology Progress,2003,19(2):522-527.
[49] Saeed A,Iqbal M. Loofa (luffa cylindrical) sponge:Review ofdevelopment of the biomatrix as a tool for biotechnologicalapplications[J]. Biotechnology Progress,2013,29(3):573-600.
[50] Saudagar P S,Shaligram N S,Singhal R S. Immobilization ofstreptomyces clavuligerus on loofah sponge for the production ofclavulanic acid[J]. Bioresource Technology,2008,99(7):2250-2253.
[51] 郭晓燕,徐尔尼。 固定化细胞生物反应器的应用及研究进展[J]. 食品工业科技,2006,27(5):191-194.
[52] Saab H B,Fouchard S,Boulanger A,et al. Luffa cylindrica andphytosterols bioconversion:From shake flask to jar bioreactor[J].Journal of Industrial Microbiology & Biotechnology,2013,40(11):1315-1320.
[53] Zampieri A,Mabande G T P,Selvam T,et al. Biotemplating of luffacylindrica sponges to self-supporting hierarchical zeolitemacrostructures for bio-inspired structured catalytic reactors[J].Materials Science and Engineering:C,2006,26(1):130-135.
[54] Mazali I O,Alves O L. Morphosynthesis:High fidelity inorganicreplica of the fibrous network of loofa sponge (luffa cylindrical)[J].Anais da Academia Brasileira de Ciências,2005,77(1):25-31.
[55] El-Roz M,Haidar Z,Lakiss L,et al. Immobilization of TiO2nanoparticles on natural luffa cylindrica fibers for photocatalyticapplications[J]. RSC Advances,2013,3(10):3438-3445.
[56] 李园园,陈少华,张召基,等。 KOH 活化丝瓜络制备高比表面积活性炭[J]. 化工进展,2012,31(6):1274-1279.
[57] 李园园,张召基,石建稳,等。 氯化锌活化丝瓜络制备微孔活性炭[J]. 炭素技术,2012,31(3):A1-A5.