植物生物技术涉及细胞,原生质体和组织培养以及基因重组技术,在提高作物产量,珍稀植物的快速繁殖,生产人工种子,创造植物新类型,改良品种品质和增强植物抗逆性等方面有着广阔的应用前景。下面是搜索整理的植物生物技术论文8篇,供大家借鉴参考。
植物生物技术论文第一篇:植物组织培养技术的应用现状与展望
摘要:植物的组织培养主要利用植物细胞的全能性, 是一门新生的生物技术学科, 目前在很多领域得到了应用, 拥有较好的发展前景。本文以植物组织培养技术为切入点, 在概述植物组织培养技术的基础上, 通过分析植物组织培养技术的现状, 探讨了植物组织培养技术的发展趋势, 旨在说明植物组织培养技术的重要性, 以期指导实践。
关键词:植物; 组织培养; 现状; 发展趋势;
Present Situation and Development Trend of Plant Tissue Culture Technology
Chen Hong
School of Life Science and Engineering, Northwest National University
Abstract:Tissue culture of plants is a new subject of biotechnology based on the omnipotence of plant cells. It has been applied in many fields and has a good prospect of development. Based on the overview of plant tissue culture technology, this paper discusses the development trend of plant tissue culture technology by analyzing the current situation of plant tissue culture technology, in order to explain the importance of plant tissue culture technology, in order to guide practice.
植物组织培养指从植物体中分离出满足需要的组织。植物体的任何一个细胞都有长成完整个体的潜在能力, 人们利用植物组织培养技术快速获取优良植物株系, 为植物组织培养提供了新的思路和方法。近年来, 生物技术学科发展较快, 植物组织培养技术得到迅速发展和推广, 如何优化植物组织培养技术是当前植物组织培养关注的焦点。因此, 探索植物组织培养技术的现状及发展趋势具有十分重要的现实意义。鉴于此, 笔者对植物组织培养技术进行了相关思考。
1 植物组织培养技术的基本内涵
1.1 植物组织培养技术的定义
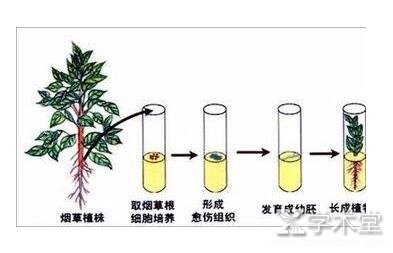
组织培养技术是在人为创造的无菌条件下, 将生活的离体器官 (如根、茎、叶、茎段、原生质体) 、组织或细胞置于培养基内, 并放在适宜的环境中进行连续培养, 以获得细胞、组织或个体的技术。这种技术在基础理论研究和生产时间中的作用与日俱增, 已广泛应用于农业和生物、医药的研究[1]。
1.2 植物组织培养技术的原理
植物组织培养的原理是细胞全能性。细胞全能性是指高度分化的植物体细胞具有全能性, 细胞经分裂和分化后, 均具有同样的或基本相同的成套的遗传物质, 只不过在特定条件下才会表达, 如一定营养的物质、激素和其他适宜条件。组织培养基于此原理诱导形成愈伤组织, 帮助伤口愈合, 在伤口表面新生的组织, 再在愈伤组织上形成新的丛生芽[2]。
1.3 植物组织培养技术的要点
植物组织培养技术要把握好四个关键点。 (1) 愈伤组织的培养条件必须无菌, 避免微生物的侵入。 (2) 刚生长不久的茎尖、芽尖, 从茎尖生长点出现新的叶原基后, 还没有受到病毒的侵染。 (3) 组织能培养成植株, 细胞分化程度有高低之分, 但植物细胞全能性不变。 (4) 组织培养中光照也是重要的条件之一, 完成接种工作后, 在培养室中培养时就需要光照条件, 一般在光照 (日光灯照射) , 温度 (30℃) 中培养。
2 植物组织培养技术的应用现状
随着科学技术的不断发展, 植物组织培养技术得到较快发展, 在转基因育种、种质资源离体保存、植物脱毒和快速繁殖、植物育种等方面得到了应用。
2.1 转基因育种
转基因技术在农业领域的应用最为广泛, 把从植物或微生物中分离获得的目的基因片段转入特定植物中, 培育出更加高产、优质、多抗的新品种。植物转基因育种有很强的目的性, 通过农杆菌介导或基因枪法改变植物的基因, 使植物细胞的基因重组, 且转化受体均为离体培养的植物细胞, 通过继代培养增殖, 获得细胞群体, 需要注意的是, 转基因育种技术应建立高效稳定的组织培养再生体系上, 促进产量和品质遗传改良。
2.2 种质资源离体保存
种质资源又称遗传资源, 是植物育种的基础, 它往往存在于特定品种之中。目前, 很多植物物种正逐年消失, 种质资源离体保存技术采用限制、延缓或者停止其生长的方法, 传递给子代并决定固有生物性状的遗传物质, 需要时可重新恢复其生长, 并再生植株, 对于生物多样性保护意义重大, 取得了一定的成效, 帮助了许多植物的延续, 避免灭绝的可能[3]。但种质资源离体保存时需要定期进行继代培养, 连续数代的扩繁培养过程将降低培养物的分化和再生能力, 为解决这一问题, 离体种质资源冷冻保存技术应运而生, 细胞培养中对细胞低温冷冻贮存, 使将来建立离体种质资源库成为可能。
2.3 植物脱毒和快速繁殖
植物脱毒技术是利用高温处理、茎尖组织培养等方法, 脱除植物所感染的病毒, 在超净无菌的条件下培养不带病菌的植株, 进行营养繁殖。一些农作物经过长时间的种植往往会携带病毒, 植物脱毒技术具有恢复原品种特征特性, 通过脱毒苗进行繁殖, 作物就不会发生病毒, 以达到优质、高效和低成本的目的。离体快速繁殖技术比常规方法快数万倍, 可以在短期内获得大量一致的遗传性, 有利于扩大繁殖。植物脱毒和快速繁殖技术的应用, 为观赏植物、园艺作物、经济林木、无性繁殖作物等提供苗木, 并形成产业化。
2.4 植物育种
植物育种是培育优良新品种的技术, 我国植物组织培养现已在单倍体育种、胚胎培养、细胞融合和培养细胞突变体等方面开展应用, 力求达到高产、稳产、优质、高效的目标。
单倍体育种是植物育种手段之一, 在单倍体育种方面, 利用花药培养等方法诱导产生单倍体, 单倍体植株经染色体加倍后, 使其单一的染色体各自加倍成对, 育成大面积种植的作物新品种。单倍体能在植株上充分地显现重组的配子类型, 我国在单倍体育种方面取得了重大成果, 可提供新的遗传资源和选择材料。从我国单倍体育种的成果上看, 作物新品种单育1号烟草品种, 以及中花8号水稻和京花1号、京单92-2097小麦等面积栽培的作物新品种[4,5]。
胚胎培养是植物育种的又一应用。胚胎培养是植物组织培养的一个主要领域, 植物的杂交不孕使远缘杂交不易成功, 但采用胚的早期离体培养能够使胚正常发育和培养出杂交后代, 以无性系繁殖获得数量较多、性状一致的群体, 胚培养已在多个科属中成功。植物胚胎培养可以克服杂种胚的败育, 获得稀有杂种, 与此同时, 还可以获得单倍体和多倍体植株, 育成多倍体新品种。
植物育种的手段还表现在细胞融合技术方面。植物细胞融合是植物细胞工程的一个重要分支, 植物组织培养技术就是原生质体融合, 可部分克服有性杂交不亲和性, 获得体细胞杂种, 创造新种或育成优良品种。当前, 已获得几十个种间、属间、甚至科间的体细胞杂种、愈伤组织, 分化成苗。采用原生质体融合技术从不杂交的植物中如番茄和马铃薯、烟草等获得属间杂种[6]。
培养细胞突变体也是植物组织培养技术在植物育种的应用。在植物组织培养技术中, 愈伤组织培养通过细胞培养, 培养的细胞一直处于不断的分生状态, 筛选出对人们有用的突变体, 从而育成新品种。目前, 植物组织培养技术在培养细胞突变体上的应用, 已应用到筛选抗病、抗盐、高赖氨酸、高蛋白、矮秆高产的突变体。
3 植物组织培养技术的发展趋势
植物组织培养技术现已得到了推广和应用, 但其良好的发展趋势和应用前景不容忽视。从植物组织培养技术的发展趋势上看, 揭开生命活动的秘密、作为植物生物反应器以及其他未知科学的研究, 将成为植物组织培养技术研究的重点和难点内容。
3.1 揭开生命活动的秘密
揭开生命活动的秘密是植物组织培养技术的发展趋势之一。植物组织培养技术在未来的发展中, 多科学、多技术的相互配合将是大势所趋, 植物组织培养技术与遗传学、细胞生物学、基因工程、生物工程等领域深度融合[7], 揭开生命活动的秘密。在揭开生命活动的秘密的过程中, 了解单个基因的作用, 接受基因的受体细胞要产生再生植株, 就需要通过组织培养的方法才能实现。
3.2 作为植物生物反应器
作为植物生物反应器是植物组织培养技术的又一发展趋势。植物生物反应器是近年来生物技术领域新的研究方向, 随着新功能基因的分离、克隆等技术的发展, 在今后15~20年内, 利用组织培养的材料作为植物生物反应器产生的高新生物技术产品将不断涌现。在植物组织培养技术的应用方面, 利用培养的植物细胞和组织细胞作为生物反应器, 也可以生产某些蛋白质、氨基酸、抗生素、疫苗等, 进而造福于人类[8]。
3.3 其他未知科学的研究
植物组织培养技术的发展趋势还表现在其他未知科学的研究方面。现代科学发展非常迅速, 为了认识客观事物的内在本质和运动规律, 新发明、新发现、新创造层出不穷, 植物组织培养技术现在仍然处于发展阶段, 科学研究是面向未知世界的认识活动, 很多机理人们还没有搞清楚, 植物组织培养技术具有很大的发展潜力, 能够适用的领域也越来越大, 植物组织培养新技术不断被运用到科学各个领域中。相信在今后的几十年内, 组织培养将会有更大的发展, 在农业、制药业、加工业等方面将会发挥更大的作用, 创造出更大的经济效益。
4 结语
植物组织培养技术的研究任重道远。现阶段, 虽然在转基因育种、种质资源离体保存、植物脱毒和快速繁殖、植物育种等方面得到了应用, 取得了一定成效, 植物组织培养技术得到了提升, 但植物组织培养仍然处于发展阶段。从植物组织培养技术的发展趋势上看, 相信在今后的几十年内, 将植物组织培养技术渗透到科研、生产和生活各个领域, 最大化发挥植物组织培养技术的作用, 必将为社会创造更大的价值和效益。
参考文献
[1]卢思.植物组织培养技术及应用[J].科技展望, 2016 (11) :73.
[2]梁佩瑶.植物保护中的生物技术应用[J].科技资讯, 2018 (3) :114, 116.
[3]司姗姗.生物技术在植物保护中的应用探究[J].农业与技术, 2017, 37 (4) :28.
[4]任目瑾, 周建峰.植物组织培养的常见污染及其防控技术[J].陕西林业科技, 2016 (6) :103-105.
[5]徐心诚, 马丽.浅谈如何提高植物组织培养课程教学质量[J].读与写 (教育教学刊) , 2015, 12 (8) :79.
[6]刘瑞光, 李芹.设施农业植物保护常用技术[J].北京农业, 2015 (12) :114.
[7]曾云英.植物开放式组织培养的研究进展及发展前景[J].江苏农业科学, 2015, 43 (4) :11-13.
[8]朱明玉, 雷世鸣, 苏宏虎.植物保护中生物技术的应用探析[J].农技服务, 2015 (2) :84.
植物生物技术论文第二篇:CRISPR/Cas9基因编辑技术在植物中的应用
摘要:CRISPR/Cas9系统作为一个简单、有效的基因编辑技术,自2012年诞生以来已经成为各个领域的研究热点,被誉为21世纪目前为止生物技术领域的重大突破。本文讨论了CRISPR/Cas9的进展,根据其未来的发展潜力综述了基因编辑技术在植物上的应用前景。
关键词:CRISPR/Cas9; 基因编辑; 检测方法;
1 CRISPR/Cas9系统介绍
1.1 CRISPR/Cas9的发展历程
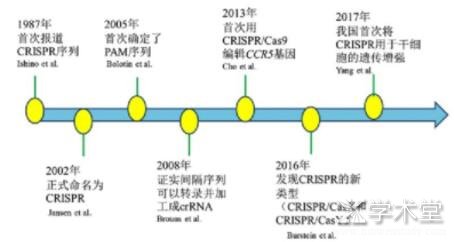
CRISPR/Cas9是一种RNA介导的适应性免疫系统,可以保护细菌和古生菌免受病毒或质粒的侵袭。早在1987年日本研究者在大肠埃希菌编码的碱性磷酸酶基因附近发现了一些短的串联重复序列和间隔序列,但其作用机制还不清楚[1]。随着深入的研究,到2002年,这些特殊的序列被科学家正式命名为CRISPR。发现其可以与附近的Cas蛋白在功能上协同作用[2]。2005年,研究发现成簇间隔的短回文重复序列与免疫功能有关,是细菌在长期进化过程中形成的一种抵御外来DNA入侵的保护机制[3]。随着研究的不断深入,2008年,相关试验证明CRISPR作用在DNA的靶序列上,并证实了间隔序列可以转录加工成为成熟的crRNA[4]。2012年,Jinek等在新型基因编辑技术CRISPR的研究取得巨大进步,其发现了Cas9蛋白,并表示Cas9是TypeⅡ型的标志性蛋白质,由2种RNA指导核酸内切酶对目标DNA结合并进行剪切[5]。2013年,利用CRISPR/Cas9切割人类细胞基因组的CC5基因,并表现出与人工嵌合RNA同样的效果[6]。2016年,在微生物中发现2个新类型的CRISPR-Cas,将其命名为CRISPR/CasX和CRISPR/CasY[7]。2017年,我国科学家首次将基因编辑技术用于干细胞的遗传增强[8]。到目前为止,该技术广泛应用于基因治疗、疾病模型构建、核酸检测、动植物品种培育等领域,CRISPR-Cas9技术的广泛应用证明了这项发明的重要意义。
图1 CRISPR/Cas9基因编辑技术的发展历程
1.2 CRISPR/Cas9系统的组成与分类
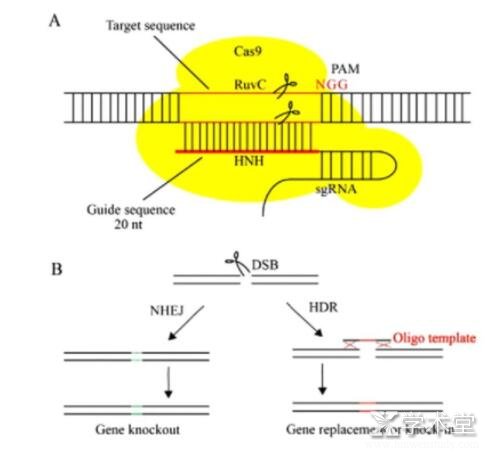
CRISPR/Cas9是由crRNA,反式激活crRNA(trans-activatIngcrRNA,tracrRNA)和Cas蛋白3部分组成,3部分在DNA结构上依次排列并形成tracrRNA,crRNA以及Cas9蛋白形成复合物,使其在特定的靶位点进行切割。Cas9蛋白含有HNH和Ruv C功能域,HNH负责剪切与crRNA互补的DNA链,RucV负责剪切双链DNA的另一条链(图3)。由间隔序列相邻基序(protospaceradjacent motIf,PAM)指导Cas9蛋白可以精准的切割外源DNA。PAM位于结合区域的上游并与结合区域相邻,通常是NGG(N为任意核苷酸,G为鸟嘌呤)3个碱基。在实际操作中,为了更加简单的操作,Jinek等通过接头将crRNA和tracrRNA合并成为1条RNA链,从而形成单一指导RNA(single-guideRNA,sgRNA)。人工设计gRNA时,结合的区域也就是20nt,其位于gRNA的5'末端,作为指导序列靶序列互补配对。简单来说,改造后的CRISPR/Cas9系统仅需要在sgRNA指导下,就能完成Cas9蛋白对特定位点的剪切。
CRISPR/Cas9系统可以分为3类,分别是TypeⅠ、TypeⅡ、TypeⅢ,TypeⅠ类型普遍存在于Cas3蛋白,Cas3是一种解旋酶/核酸酶,但是与DNA核酸酶和解旋酶活性不同。TypeⅡ类型是Cas9蛋白所必需的,其包含Ruvc结构域和HNH结构域,这2个结构域对Cas9内切酶活性至关重要。TypeⅢ类型需要大量的RAMP蛋白、Cas6和Cas9蛋白参与到crRNA对目标DNA的切割。TypeⅢ类型不需要识别外源DNA序列上的PAM序列,但仍有降解外源DNA的能力,从而使其成为一个非特异性系统。
1.3 CRISPR/Cas9系统作用原理
CRISPR/Cas9可以产生与目标序列互补的RNA序列,并通过碱基互补配对的方式形成RNA-DNA结构,之后,使Cas9核酸内切酶对靶DNA剪切形成双链断裂的DNA(double strand break,DSB)。产生的DSB可以通过同源定向修复(homology-directed repair,HDR)途径修复,也可以通过非同源末端链接(nonhomologous end-joining,NHEJ)途径修复。CRISPR/Cas9系统的作用机制可以总结为以下3步。
1.3.1 第1步
外源DNA的入侵,外来的DNA首先被Cas蛋白识别,并随后整合到CRISPR位点的2个相邻的重复序列之间的间隔。
1.3.2 第2步
CRISPR-RNA的产生,当外源物质再次入侵时,整合了外源DNA片段的CRISPR基因座转录生成precrRNA和tracrRNA,pre-crRNA被核酸酶Ⅲ与tracrRNA切割形成成熟的cr-RNA[9]。
1.3.3 第3步
CRISPR/Cas9系统剪接,pre-crRNA和crRNAs形成复合物,通过碱基互补配对原则特异性识别外来的DNA(或RNA),这种复合物降解外来DNA并维持噬菌体的免疫,此外,Cas9蛋白还可以与复合物形成结合,识别外来DNA序列上的PAM序列,行驶剪接功能(图2)。
2 CRISPR/Cas9在植物中的应用
2.1 基因敲除
CRISPR/Cas9导致特定基因下调或破坏目标基因的表达,在很多植物中成功应用。如在玉米上,美国杜邦公司利用CRISPR/Cas9技术成功敲除玉米中编码淀粉合成酶的糯质基因Wx1,从而培育出新的糯玉米品种[11]。在水稻上,CRISPR/Cas9诱导水稻转录因子编码基因Os ERF922的靶向突变,从而增强其对稻瘟病真菌病原体的抗性[10]。利用水稻密码子优化Cas9基因,采用水稻U3启动子启动sgRNA转录,对水稻中的PDS基因定点突变,获得了纯合的基因敲除突变体[6]。在番茄上,用CRISPR/Cas9技术敲除番茄slmapk3基因,相对于野生型植株,突变体表现出严重的叶片枯萎和弯曲,因此可以更深入地了解SlMAPK3基因介导的干旱调控机制[12]。
图2 CRISPR/Cas9编辑靶基因的示意图[18]
2.2 同时编辑多个基因座
随着CRISPR/Cas9系统的在植物中不断的应用,其可以实现对多个基因同时编辑。该作用的发挥需要Cas9与多种不同的sgRNA融合来实现。如,嵌合导向RNA(cgRNA)可以靶向小麦中2种不同的基因肌醇加氧酶(inositol oxygenase,inox)和八氢番茄红素去饱和酶(phytoene desaturase,pds)基因[13]。
2.3 基因置换
利用CRISPR/Cas9技术可以实现靶基因置换或敲入,将外源DNA整合到基因组中所需的位点。如,将潮霉素磷酸转移酶基因(hygromycin phosphotransferase,HPT)通过同源重组的方法成功整合到大豆的第4条染色体上[14]。基因置换可以通过Cas9-sgRNA载体共转化实现,或者通过合成含有供体序列或与单一供体序列的Cas9-sgRNA的表达盒。
2.4 产生无标记的转基因植物
转基因可以将外源基因随机的整合到染色体上,还可以通过水平基因转移到同一物种的非转基因植物或者其它物种的植物上。然而,CRISPR/Cas9基因编辑系统可以避免这种现象发生,sgRNA与Cas9形成复合体,指导Cas9对特定序列进行精确突变,其作用对象不是整条染色体。CRISPR/Cas9复合体会在细胞内降解,不会遗传给下一代。已经在小麦中利用CRISPR/Cas9引入DNA或RNA,并通过瞬时转化愈伤组织细胞的方法,可以得到无转基因的、纯合的T0代小麦突变体[15]。
3 基因编辑与传统转基因技术的比较
转基因技术(Transgentic Technology)是指从植物中分离得到或经过修饰的目的基因导入到植物体内,使其在植物体内稳定表达和遗传。简单说,转基因是将外源DNA随机整合到染色体上,所以,转基因技术无论是在过程中还是在最后得到的植株中都会涉及外源DNA的导入。利用CRISPR/Cas9在最后得到的植株中不存在外源DNA,是将DNA序列插入到染色体的特定位置上与传统的育种方式得到的植株无法区分,所以,基因编辑技术相对更容易被接受且更安全。美国农业部宣布,利用CRISPR/Cas9基因编辑技术的到的蘑菇和玉米不属于转基因监管的范围[16];利用CRISPR/Cas9基因编辑技术可以精确目标位点,使基因型与表型联系起来,减少了筛选转基因植株导致的DNA随机插入的样本数量,从而可以确切的判断基因的功能,使研发时间和成本有所下降。总之,利用基因编辑得到植物中不含有转基因成分,相比之下,更容易被人们接受。
4 基因编辑植物检测方法
利用CRISPR/Cas9系统剪切的DNA双链,经过细胞的自我修复,将DNA双链连接起来,没有涉及到外源基因的加入,获得的植物中不带任何标记,与经过基因突变的植物并无明显区别。
目前对基因编辑植物检测最常用的方法是PCR/RE。利用该方法需要满足的条件是gRNA靶序列内存在限制性酶切位点。经基因编辑得到的阳性植株靶序列的酶切位点突变,而不能被内切酶识别,而野生型植株中存在酶切位点可以被相应的酶识别。该方法可以检测单等位基因和双等位基因突变,但是不能区分双等位基因纯合子或杂合突变体[17]。
还有一种检测方法-Sanger测序法,该方法在检测植物编辑中也较为常用。但是该方法只能确定靶序列是否发生突变,不能对突变类型进一步确定。PCR-Sequencing最终也是利用Sanger法,该技术通过对PCR产物测序,对测序结果的峰值进行比较,确定基因组位点是否发生突变[18],虽然这种方法确定突变位点较为精确,但是此方法费时、费力,只适用于对少量的靶位点进行分析,对于公司或者大批量检测基因编辑来说效率不高。
CRISPR/Cas9作为第3代基因编辑系统,近几年的迅速发展和应用领域的拓展,其在基因编辑的精确性和高效性方面已经不可替代,受到科研人员的重视和关注。利用基因编辑技术得到的植物新品种中不存在外源DNA,可以使植物的培育过程更加安全。开发出一个省时、省力、高效的方法来检测基因编辑的植物,这也使科研人员所面临更大的挑战。
5 展望
CRISPR/Cas9作为一种操作简单、有效、精确度高的基因编辑技术,广泛应用于各个领域。尽管CRISPR/Cas9被成功用于植物基因组编辑,但也存在很多风险。如,最小化脱靶机制,并阐述这种机制,如何对CRISPR/Cas9系统进行优化,以及开发出一种对植物基因组编辑检测的有效方法。这需要对CRISPR/Cas9系统进行更加深入的研究,以促进CRISPR/Cas9基因编辑技术在未来会创造更大的价值。
参考文献
[1]Ishino Y,Shinagawa H,Makino K,et al. Nucleotide sequence of the iap gene,responsible for alkaline phosphatase isozyme conversion in Escherichia coli,and identification of the gene product[J]. Journal of Bacteriology,1987,169(12):5429-5433.
[2]Jansen R,Embden J D,Gaastra W,et al. Identification of genes that are associated with DNA repeats in prokaryotes[J]. Molecular Microbiology,2002,43(6):1565-1575.
[3]Bolotin A,Quinqusis B,Sorokin A,et al. Clustered regularly interspaced short palindrome repeats(CRISPRs)have spacers of extrachromosomal origin[J]. Microbiology,2005,151(8):2551-2561.
[4]Brouns S,Jore M,Lundgren M,et al. Small CRISPR RNAs Guide Antiviral Defense in Prokaryotes[J]. Science,2008,321(5891):960-964.
[5]Jinek M,Chylinski K,Fonfara I,et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J]. Science,2012,337(6096):816-821.
[6]Shan Q,Wang Y,Li J,et al. Targeted genome modification of crop plants using a CRISPR-Cas system[J]. Nature Biotechnology,2013,31(8):686-688.
[7]Burstein D,Harrington L,Strutt S,et al. New CRISPR-Cas systems from uncultivated microbes[J]. Nature,2017,542(7640):237-241.
[8]Yang J,Li J,Suzuki K,et al. Genetic enhancement in cultured human adult stem cells conferred by a single nucleotide recoding[J].Cell research,2017,27(9):1178-1181.
[9]Lander ES. The Heroes of CRISPR[J]. Cell,2016,164(1-2):18-28.
[10] Wang F,Wang C,Liu P,et al. Enhanced Rice Blast Resistance by CRISPR/Cas9-Targeted Mutagenesis of the ERF Transcription Factor Gene Os ERF922[J]. PLoS One, 2016, 11(4):e0154027.
[11] Chilcoat D,Liu Z B,Sander J. Use of CRISPR/Cas9 for Crop Improvement in Maize and Soybean[J]. Progress in molecular biology and translational science,2017(149):27-46.
[12] Wang L,Chen L,Li R,et al. Reduced drought tolerance by CRISPR/Cas9-mediated SlMAPK3 mutagenesis in tomato plants[J]. Journal of Agriculture Food Chemistry,2017,65(39):8674-8682.
[13] Upadhyay SK,Kumar J,Alok A,et al. RNA-Guided Genome Editing for Target Gene Mutations in Wheat[J]. G3:Genes|Genomes|Genetics,2013,3(12):2233-8.
[14]Li Z,Liu ZB,Xing A,et al. Cas9-Guide RNA Directed Genome Editing in Soybean[J]. Plant physiology,2015,169(2):960-970.
[15] Zhang Y,Liang Z,Zong Y,et al. Efficient and transgene-free genome editing in wheat through transient expression of CRISPR/Cas9 DNA or RNA[J]. Nature communications,2016(7):12617.
[16]Peng J,Wang Y,Jiang J,et al. Production of Human Albumin in Pigs Through CRISPR/Cas9-Mediated Knock in of Human c DNA into Swine Albumin Locus in the Zygotes[J]. Scientific Reports,2015(5):16705.
[17]L Y,Zhu,JK. Precise Editing of a Target Base in the Rice Senome Using a Modified CRISPR/Cas9 System[J]. Molecular Plant,2017,10(3):523-525.
[18] Gao Y,Zhang Y,Zhang D,et al. Auxin binding protein 1(ABP1)is not required for either auxin signaling or Arabidopsis development[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(7):2275-2280.