制药设备论文第四篇:药品生产企业设备管理体系构建
摘要:药品的生产主要通过设备实现,产品质量及生产规模都依赖于设备运行状态。为了尽可能降低药品在生产和加工过程中交叉污染的风险,持续稳定生产出质量稳定符合要求的药品,生产企业应当按照《药品生产质量管理规范》(药品GMP)的要求,对于生产过程中的设备进行系统化管理,以控制设备这一要素。虽然设备千差万别,不同工艺需要不同设备。但是对于设备的管理,企业可以通过文件和记录建立设备管理体系,按照设备的生命周期进行管理,使设备在整个生命周期内处于有效控制状态并持续保持。并且做到设备活动有文可依,有据可查。设备生命周期自采购计划、设备选型始,至安装、使用、维护保养、至报废终。药品GMP(2010)的第五章对于设备的设计、安装、维护维修、使用和清洁、校准等做出了详细的规定。将管理要求与设备全生命周期有机结合,将设备确认融入到设备全生命周期,同时,将风险评估和变更控制融入到设备的生命周期管理,这样能更好的符合药品GMP的要求。
关键词:药品GMP; 设备生命周期; 设备确认;
Analysis on The Management of Production Equipment of Pharmaceutical Enterprises
Abstract:the production of drugs is mainly realized by equipment. Product quality and production scale largely depend on the operating status of equipments. In order to minimize the risk of cross contamination in the production and processing of drugs and produce drugs with stable quality continuously and stably, the production enterprise shall carry out systematic management on the equipment in the production processs according to the requirements of GMP. Although different process needs different equipment, the enterprise can manage its production equipments according to the life cycle and establish equipment management system by documents and records. By these measures, the enterprise can keep the equipment under effective control throughout its life cycle and has documents to follow and evidence to check through equipment activities. The life cycle of the equipment starts from the purchase plan and equipment selection to the installation, use, maintenance and scrapping. Chapter 5 of GMP(2010) has made detailed regulations on the design, installation, maintenance, use, cleaning and calibration of equipment. The enterprise should integrate management requirements, equipment validation, risk assessment and change control into the whole life cycle of equipment to meet the requirements of GMP better,
药品生产主要通过设备实现。我国制药工业早已脱离手工业、单机等小规模生产模式,进入自动化大规模生产。企业规模日益增大,购置的生产设备成百上千,而每台设备上可能集成了压力、温度、流量等多种参数仪表。比如原料药企业需要粉碎机、热风循环烘箱、台秤等设备,生物制剂生产线需要安瓿清洗机组、干燥灭菌设备、水针剂灌封设备等,还有水系统及空调系统等公共系统。而设备是药品GMP(2010)中重点提及的要素,其第五章对于设备的设计、安装、维护维修、使用和清洁、计量校准、确认等做出了详细的规定。同时,附录确认与验证对于设备确认提出了具体要求。如何高效有序的对企业内部设备进行统一管理,使得企业的设备能持续有效地符合药品GMP规定。本文件建议,在对设备进行生命周期管理的基础上,结合设备分类,将设备确认、风险评估和变更控制融入到设备的生命周期管理使得设备在全生命周期符合GMP条款的要求,从而保证产品质量。
1 设备生命周期管理
设备生命周期粗略包括前期管理,使用中管理和后期管理。
对应图1,前期管理主要包括购置计划和可行性研究,形成用户需求文件URS)、设计及设计确认(DQ;进行验收测试(FAT)、安装确认(IQ)、运行确认(OQ)和性能确认(PQ),及初期管理(设备分类、唯一性标示、设备台账、设备档案等)。使用中管理主要包括设备的使用和清洁、维护和维修、再确认、故障分析与纠正、设备变更。后期管理主要指设备报废,应确定设备报废条件和流程,并形成文件。
表1 ISPE关键性非关键性分类

生命周期是从时间维度对设备进行管理,分类则是从重要性权重对设备进行管理。对不同分类的设备采用相适应的管理策略。对于测量仪器而言,国际制药工程协会ISPE分为关键性和非关键性,如表1所示。国内和美国FBA的ABC分类管理如表2所示。企业可经过风险评估,自行选择分类方法,但分类方法及评估程序应形成文件。
图1 设备生命周期管理周期管理流程图[1]
表2 ABC分类管理
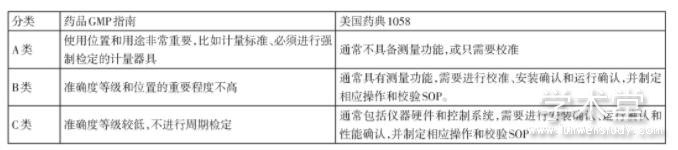
表3 设备生命周期与设备确认对应关系表

同时,设备处于不同生命周期涉及不同人员不同部门,比如前期管理中的URS的起草一般涉及生产部门、质量部门、维修部门、研发部分等,比如使用中管理的操作规程的起草一般涉及使用车间和操作人员,等等。人员是药品生产的关键因素之一,加强全员GMP的教育宣贯,使药品GMP对于设备的要求深入人心。因为GMP是一个有机的整体,设备管理的过程中也涉及到药品GMP对于风险评估、变更控制、文件控制等相关条款。提高全员对于GMP的认识和觉悟,有助于从全局角度去理解和执行药品GMP,更好的对设备进行管理。
2 设备确认
药品GMP(1998)将确认作为验证的一个组成部分存在。而药品GMP(2010)沿用欧美法规的要求,对验证进行了重新定义,并将确认作为一个独立概念。确认是指:证明厂房、设施、设备能正确运行并可达到预期结果的一系列活动。从功能角度,设备确认包括设计确认、安装确认、运行确认和性能确认。从时间角度,设备确认包括确认和再确认,对于设施设备应当定期评估以确认它们持续保持验证状态。从管理角度,设备确认是贯穿设备生命周期的,两者是密不可分有机结合的。设备确认与设备生命周期的对应关系如下表3所示。
从操作角度,确认的对象是设备,验证的对象是生产工艺。设备是生产工艺的硬件基础,因此,确认是验证的前提和基础。而设备的计量校准是进行确认的前提和基础。在设计确认阶段,应考虑设备的校准需求及设计对于设备校准的可操作性;在安装确认阶段,应进行校准需求的评估、需校准的设备仪表建立校准方法和完成初始校准;在运行确认阶段,应确保所有使用的有校准需求的设备经过校准,并建立校准计划。对于设备校准范围,应小于设备仪表设计范围,大于设备确认范围。
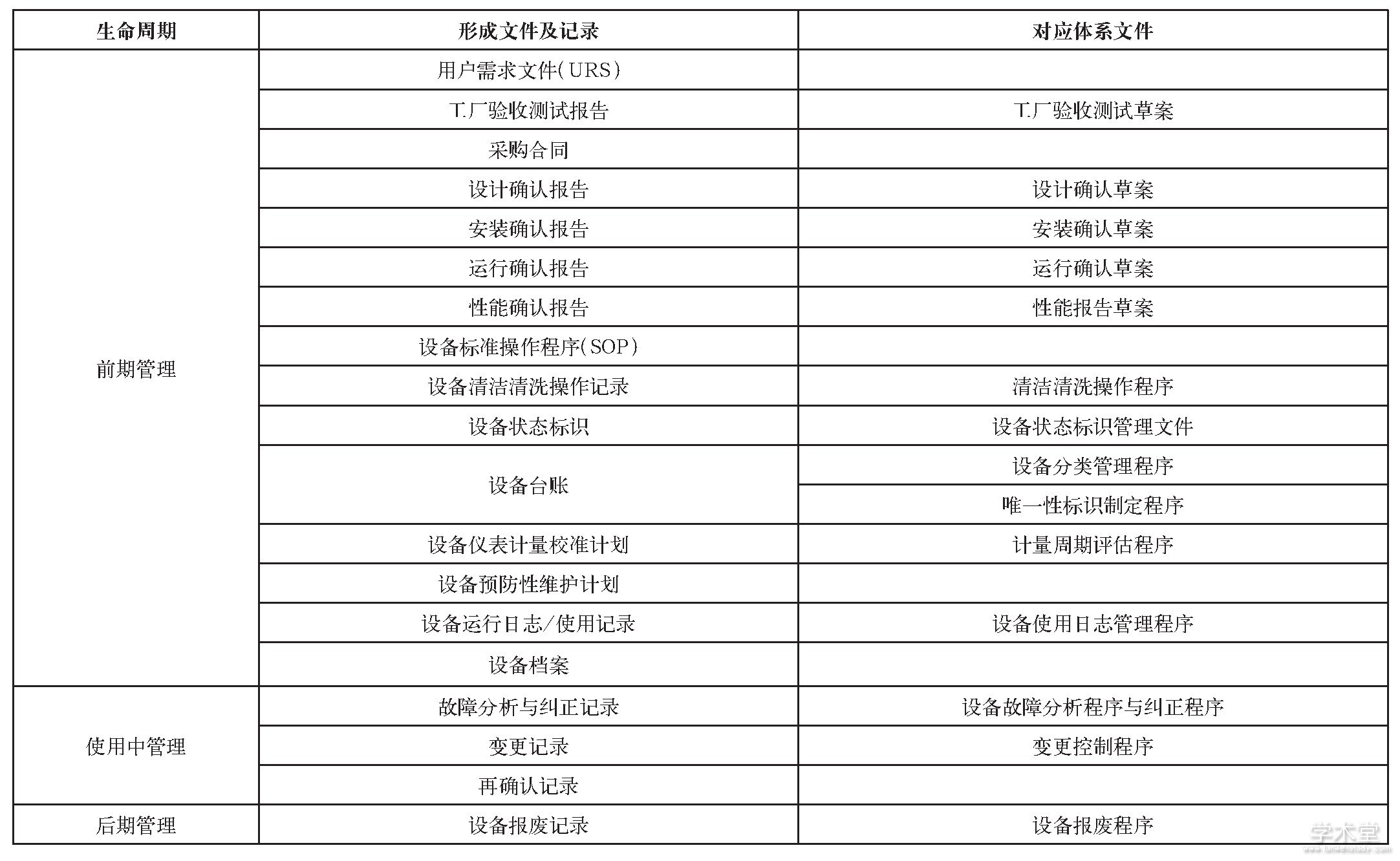
表4 设备管理文件及记录
对于确认的范围和程度,药品生产企业应通过风险评估确定。在发生变更的情况下,产企业应执行变更管理程序,同时是否应进行再确认应通过风险评估确定。
3 文件及记录
文件和记录是支持设备管理有效持续统一运行的体系保障和有效凭证。
首先,应当遵循药品GMP对于文件管理的原则,设备管理相关的文件起草、修订、审核、批准应由适当人员签名并注明日期,按照文件操作规程管理。其次,建立健全药品生产设备的管理制度并持续改进,达到设备的采购、安装、验收、使用维护、退役等工作标准流程化,有序化。比如,对于复杂设备建立设备使用的标准操作程序并在药品生产过程中严格执行,可以降低人员因素对于设备影响,降低故障率;而形成设备维护维修标准操作程序,可以减少停机时间,从而尽可能减少因设备停机而影响药品生产。最后,建立健全设备档案,使得管理有档可查,使用有文可守,维护有据可查。可以在前期管理时就建立起设备档案,主要包括但不限于:设备项目计划、购销合同、技术要求、用户需求(URS)、使用说明书、维修手册、备件手册、外购件技术资料、到货箱清单、生产许可证明、仪表鉴定证明、设计、制造、安装过程施工纪录和确认记录、竣工图纸以及设备在使用过程中的使用记录、计量证书等。
根据药品GMP对于设备处于不同生命周期的文件要求,应形成的文件及记录列表如下表4所示。
4 结语
设备是药品生产的重要生产要素,因此,企业应当建立设备管理体系作为其质量管理体系的一部分,使得设备的全生命周期处于受控状态。同时设备管理体系不是独立的,在对设备的管理过程中,涉及到风险评估和变更控制,是与企业的质量管理体系动态结合的。药品GMP的实施是一个持续改进的过程,同时,得益于技术的进步,生产设备也在不断升级换代。因此,药品生产企业对于生产设备的管理应当不断改进,以符合药品GMP的要求。
参考文献
[1] 药品GMP指南厂房设施与设备国家食品药品监督管理局药品认证管理中心编写中国医药科技出版社
点击查看>>制药设备论文(精选范文8篇)其他文章









