摘要:左旋多巴是治疗帕金森氏病的首选药物, 生物酶法合成左旋多巴具有工艺简单、条件温和、立体选择性高和环境友好等优点。本论文以实验室前期构建的表达具核梭杆菌 (Fusobacterium nucleatum) TPL (Fn-TPL) 的重组大肠杆菌为基础, 采用单因素实验通过对5 L发酵罐发酵工艺优化以及补料策略的研究, 确定了分批发酵的工艺参数:pH 6. 5, 诱导温度30℃, 诱导剂乳糖20 g/L。在5 L发酵罐中, 进一步研究了10 mL/h、20 mL/h、30 mL/h三个速率的恒速流加对菌体生物量和TPL酶活的影响。结果表明, 补料速率为20 mL/h时, 生物量最高为30. 43 g dcw/L, 体积酶活最高为9 420 U/L, 较摇瓶发酵培养活力提高了3. 3倍。
关键词:酪氨酸酚裂解酶; 左旋多巴; 发酵工艺优化; 分批补料培养;
Study on fermentation process for recombinant tyrosine phenol lyase
TANG Xiaoling YANG Jian WANG Zhichao SUO Hui ZHENG Renchao
Institute of Biological Engineering, Zhejiang University of Technology
Abstract:Levodopa ( 3, 4-dihydroxyphenyl-l-alanine, L-DOPA) is the first choice of drug for the treatment of Parkinson's disease. Compared with plant extraction and chemical synthesis, biosynthesis of L-DOPA has the advantages of simple process, mild reaction condition, high stereoselectivity and environmental friendliness. In this study, the fermentation process was optimized for the recombinant E. coli strain harboring TPL from Fusobacterium nucleatum ( FnTPL) in a 5 L fermenter. The process parameters for batch fermentation were determined as follows: pH 6. 5, induction temperature 30 ℃ and inducer lactose 20 g/L. Fed-bath process with constant feeding was further applied and the results indicated that with 20 mL/h of constant feeding strategy, both the biomass and volumetric activity of Fn-TPL reached highest, which were 30. 43 g dcw/L and 9 420 U/L, respectively.
帕金森综合症 (Parkinson’s disease, PD) , 是一种常见的中老年人神经系统变性疾病。据报道, 40岁以上人群中发病率超过0.1%[1]。在国内调查发现, 近年来国内6个城市63 195人口的资料表明, 帕金森病患病率为57/10万[2]。在世界范围内大多数的研究调查发现, 帕金森病的患病率为0.1%~0.3%, 其中在老年人群中患病率更高[3]。左旋多巴是多巴胺的前体药物, 能够通过血脑屏障, 到达中枢神经系统, 并在脱羧酶的作用下, 转变为多巴胺, 进而发挥治疗帕金森氏病的作用[4]。目前, 用于合成左旋多巴的方法包括天然植物提取法、化学合成法和生物酶催化法。提取法因原料来源较少、提取步骤复杂繁琐等因素的限制, 产量小、生产成本高, 难以实现大规模生产, 远不能满足市场需求。化学合成过程中需要大量的金属催化剂, 并且反应条件苛刻, 产物转化率及手性选择性低, 同时具有成本高、环境不友好等问题[5], 在工业生产上受到限制。生物酶法合成左旋多巴具有工艺简单、条件温和、立体选择性高和环境友好等优点, 越来越受到青睐。酪氨酸酚裂解酶 (tyrosine phenol lyase, TPL, E.C.4.1.99.2) , 又名β-酪氨酸酶, 它是一类磷酸吡哆醛 (pyridoxal-5'-phosphate, PLP) 依赖型裂解酶。TPL能够催化L-酪氨酸发生α, β-消去反应, 生成丙酮酸、苯酚和氨。此反应为可逆反应, 若以邻苯二酚替代苯酚, 该酶可逆向催化生成左旋多巴[6,7]。和氨基酰化酶、酪氨酸酶、羟化酶等具有催化合成左旋多巴能力的酶相比, TPL合成左旋多巴催化效率高, 过程不需要添加NADH等辅助因子[8,9,10]、成本低, 有利于左旋多巴的工业化生产。
本实验室前期构建了表达有具核梭杆菌TPL的重组E.coli BL21 (DE3) /pET-28b-Fn-TPL, 底物转化率高, 左旋多巴合成能力较强。但由于该重组菌在发酵过程中生物量较低, 产酶水平不高, 限制了工业化应用。为了进一步提高酪氨酸酚裂解酶活力和产量, 适应工业化生产需求, 本论文对来源于具核梭杆菌的Fn-TPL发酵工艺进行了研究。目前, 补料工艺已是工业发酵领域中研究最多, 最广的技术之一[11], 本实验通过单因素试验, 在5 L发酵罐中研究了诱导温度、诱导剂浓度及p H对菌体生长及产酶的影响。确定最佳的发酵培养条件后, 为了进一步探究补料策略对重组E.coli Fn-TPL发酵的影响, 通过考察不同速率的恒速流加对重组E.coli发酵产酪氨酸酚裂解酶的影响, 确定最优发酵条件。
1 实验部分
1.1 材料
1.1.1 菌种
重组酪氨酸酚裂解酶产生菌E.coli BL21 (DE3) /pET-28b-Fn-TPL, 由本实验室构建并保藏。
1.1.2 仪器及试剂
丙酮酸钠、邻苯二酚、磷酸吡哆醛 (PLP) 为上海阿拉丁生化科技有限公司产品;左旋多巴标准品由浙江杭州手心制药有限公司提供;进口蛋白胨、进口酵母粉、琼脂粉购买自北京Oxoid公司;15-150 kDa双色预染蛋白Marker、卡那霉素 (Kan) 、异丙基-β-d-硫代半乳糖苷 (IPTG) 购买自上海生工生物技术股份有限公司。
往复式水浴摇床 (上海精密科学仪器有限公司) ;气相色谱仪 (Agilent Technologies) ;高速冷冻离心机 (德国Beckmin公司) ;超净工作台 (苏州净化设备有限公司) ;Bio-tech 5 L立式发酵罐 (上海保兴生物器材有限公司) 。
1.1.3 培养基与缓冲液
(1) LB (Luria-Bertani) 培养基 (g/L) :蛋白胨10, 酵母粉5, NaCl 10。
(2) 发酵培养基 (g/L) :蔗糖10, 蛋白胨25, 酵母粉5, NaCl 10, MgSO40.6, PLP 0.05, KH2PO41.36。
(3) 补料培养基 (g/L) :蛋白胨125, 酵母粉20, 蔗糖300, (NH4) 2SO45, NaCl 50, PLP 0.5, K2PO43, MgSO46。
(4) 50 mmol/L Tris-HCl缓冲液:6.05 g Tris溶解于超纯水中, 用HCl调pH至8.0后用超纯水定容至1 000 m L。
1.2 方法
1.2.1 一级种子液培养方法
平板划线:将-80℃保藏的重组E.coli BL21 (DE3) /pET-28b-Fn-TPL在LB固体培养基上划线活化、分离, 于37℃恒温培养箱培养14 h。
摇瓶培养:挑取平板上的单菌落接种到250 m L摇瓶, 培养基为50 m L LB培养基, 并加入100μL的卡那霉素 (50 g/L) , 37℃、150 r/min过夜培养约10h, 作为种子液备用。
1.2.2 二级种子液培养方法
取上述种子液按2%接种量接种于100 m L LB培养基中, 37℃、150 r/min培养2 h, 加入IPTG诱导后于28℃条件下培养10 h。
1.2.3 发酵罐培养
5 L发酵培养:先将发酵罐进行空消 (121℃, 20min) , 待发酵罐罐体冷却配制3 L发酵培养基, 再进行实消灭菌 (121℃, 20 min) 。灭菌完成后按照说明安装好p H电极、溶氧电极、温度电极和搅拌转子等附件, 连接好冷凝水管路及通气设备, 冷却至37℃。接种100 m L二级摇瓶种子液, 搅拌转速450r/min, 通气量0.45 m3/h (通气比约为1.5 vvm) , 罐压0.05 MPa, pH控制为6.5, 用40%氨水和50%磷酸调节p H。按1.5%的接种量将摇瓶培养的种子液接种到5 L发酵罐中 (转接的过程中, 在进样口套上火圈, 火圈内加入用酒精浸湿的酒精棉, 点燃, 打开进样口, 倒入摇瓶中的种子液, 旋紧进样口, 熄灭火圈) , 37℃培养3 h, 溶氧降为0%, 降低温度至30℃, 加入乳糖 (终浓度20 g/L) 诱导, 流加40%氨水和50%磷酸调节p H为6.5, 待溶氧值上升至100%后稳定1 h停止发酵, 离心收集菌体。
1.2.4 菌体浓度的测定
以空白培养基作为参照, 紫外分光光度计在波长600 nm下测量菌液的吸光度, 菌体密度用相对密度OD600表示。
1.2.5 酶活的测定
以含TPL基因的大肠杆菌静息细胞破碎后的粗酶液作为合成左旋多巴的酶源, 通过测定由丙酮酸钠、邻苯二酚和氨转化合成左旋多巴的量来评价酪氨酸酚裂解酶合成左旋多巴的能力。将产酶培养基获得的细胞离心后, 称取0.25 g菌体加入50mmol/L Tris-HCl缓冲液重悬, 取1 m L溶解后的菌悬液加入10 m L转化体系中 (丙酮酸钠8 g/L、邻苯二酚5 g/L、氯化铵34.7 g/L、亚硫酸钠1 g/L、EDTA2 g/L, 氨水调节体系pH至8.0) , 15℃下在封口三角瓶中进行反应。30 min后取反应液离心, 稀释, 用高效液相色谱仪测定反应体系中左旋多巴的浓度。
2 结果与讨论
2.1 诱导温度的优化
诱导温度对菌体的生长和酶活力的影响是多方面的。诱导温度与细胞的蛋白转录、细胞的代谢能力及包涵体的形成有着密切的联系, 在较高的温度下, 氨基酸快速翻译导致产生无活性的蛋白质及包涵体[12];而诱导温度过低, 则降低了细胞的代谢速率, 延长发酵周期。
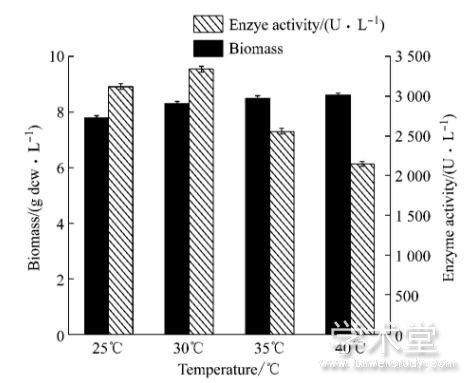
本实验选择25℃、30℃、35℃和40℃四个诱导温度, 分析不同诱导温度条件下菌体生物量及产酶的影响。如图1所示, 随着温度的升高, 酶活也随之提高, 当温度达到30℃时, 体积酶活最高为3 340U/L。温度继续升高时, 酶活迅速降低。分析可知, 较高的温度有利于菌体的生长, 但是不利于菌体的诱导表达, 而温度较低又不利于菌体的生长, 综合生物量和菌体产酶等因素, 选择30℃为最佳诱导温度。
图1 5 L发酵罐水平上诱导温度的变化
2.2 诱导剂及浓度的选择
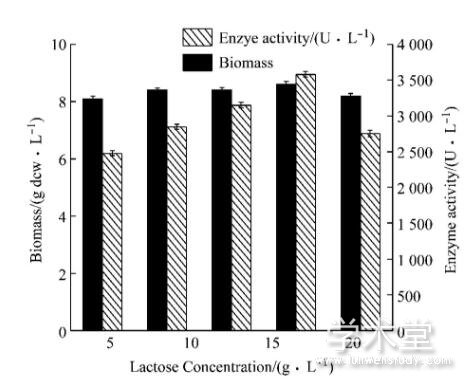
对于工业化生产来说, 乳糖作为诱导剂时可以降低生产成本, 本实验选择5 g/L、10 g/L、15 g/L、20 g/L和25 g/L乳糖浓度, 研究不同乳糖浓度对菌体产酶的影响。如图2所示, 随着乳糖浓度的增加, 酶活随之增加, 当乳糖浓度达到20 g/L时, 体积酶活最高为3 580 U/L, 随着乳糖浓度的继续升高, 生物量及酶活开始下降, 这与乳糖的诱导特性有一定关系, 当乳糖浓度达到一定值时, 会加速蛋白质的翻译, 形成包涵体, 进而影响酶活。因此, 确定20 g/L的乳糖为最适诱导剂浓度。
图2 5 L发酵罐水平上乳糖浓度优化
2.3 发酵过程p H的控制
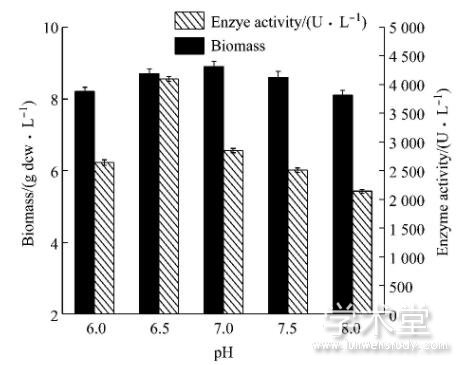
发酵过程中pH将影响培养基中某些物质的解离和中间代谢产物的解离, 从而影响微生物对营养成分的吸收和代谢[13]。本实验考察发酵过程中不同pH对酪氨酸酚裂解酶产酶的影响, 由图3可知, 在不同的p H条件下, 菌体生物量变化较小, 体积酶活变化较大, p H 6.5时, 体积酶活最大为4 100 U/L, 随着p H的升高, 在发酵环境偏碱性条件下, 酶活迅速降低。因此, 确定发酵过程中pH恒定为6.5。
图3 5 L发酵罐水平上的pH优化
2.4 恒速流加对发酵的影响
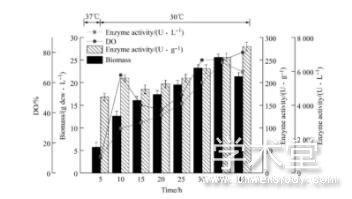
确定了补料培养基的组成后, 选择10 m L/h、20m L/h和30 m L/h三个补料速率进行恒速补料。37℃分批发酵维持5 h左右, 营养物质基本耗尽时, 溶氧短时间内迅速上升, p H也略有上升, 此时开始补料 (生物量8.3 g dcw/L左右) ;发酵8 h后进行诱导, 诱导剂乳糖, 浓度20 g/L, 诱导温度30℃, 诱导时机选择在细胞指数生长中前期 (生物量10.3g dcw/L) 。发酵过程中流加40%的氨水和50%的磷酸使pH维持在6.5, 转速维持450 r/min。
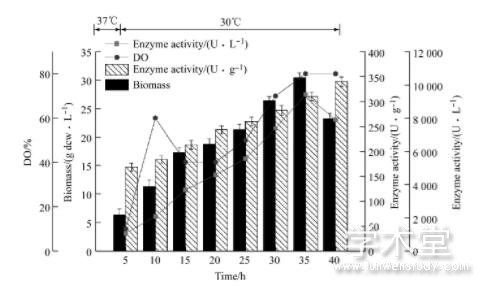
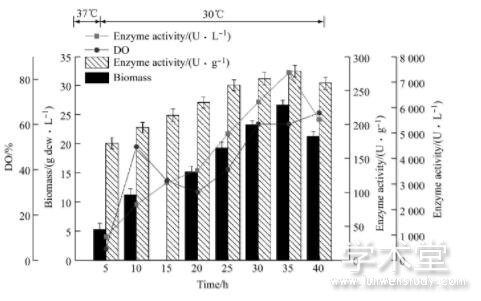
由图4、图5和6图可知, 恒速补料过程中, 前期发酵进程大体一致, 培养基中的碳源蔗糖快速代谢消耗, 很快进入菌体的对数生长期。由于大肠杆菌生长迅速, 代谢活动旺盛, 对能量需求较高, 同时乙酸不断积累, 但由于分批培养基中营养物质有限, 乙酸积累浓度不会太高, 且分批发酵末期由于营养成分消耗殆尽, 而维持菌体代谢过程需要丰富的营养物质, 由于碳源饥饿引发应激效应会代谢掉一部分乙酸, 所以发酵前期乙酸积累虽然对发酵带来一定的影响, 但危害不会太大。在细胞生长指数生长中前期 (生物量10.3 g dcw/L) 进行补料, 补料速率恒定在10 m L/h时, 菌体的生长状况较为稳定。但菌体生长速率在持续缓慢的下降, 发酵周期为40h, 发酵过程中生物量最高为25.56 dcw/L, 体积酶活最高为6 532 U/L。由于随着生物量的增加, 菌体自身代谢和维持生长所需要的能量不断增加, 而补加的速率恒定不变, 且补料速率较慢, 发酵至中后期时补料营养成分的速率已经满足不了细胞代谢对于能量的需求, 该速率未能充分利用大肠杆菌自身的生长潜力, 导致最终的生物量不高, 10 m L/h补料时酪氨酸酚裂解酶体积酶活最高为6 532 U/L。
图4 10 m L/h恒速流加补料发酵进程
图5 20 m L/h恒速流加补料发酵进程
图6 30 m L/h恒速流加补料发酵进程
补料速率为20 m L/h时, 补料前期菌体生长较快, 发酵周期为40 h, 生物量最高为30.43 g dcw/L对菌体生长及酪氨酸酚裂解酶的表达有较大的影响, 补料时酪氨酸酚裂解酶体积酶活最高为9 420U/L。
补料速率30 m L/h时, 补料前期菌体生长过快, 可能会导致乙酸较快的积累, 由图4~6可知发酵25 h菌体的生长过程较为缓慢, 发酵周期为40h, 体积酶活最高为7 359 U/L。
综上可知, 恒速流加补料培养时, 补料速率10m L/h的速率过慢, 菌体生物量较低, 导致菌体产酶量偏低。补料速率30 m L/h菌体生物量增长较快, 代谢过程中会产生较多的乙酸, 会影响酪氨酸酚裂解酶的活力。补料速率20 m L/h时生物量达到30.43 g dcw/L, 体积酶活最高为9 420 U/L, 是分批发酵所得产量的2.7倍, 较好的提高了菌体的生物量和产酶水平。
3 结论
本文针对重组TPL工程菌合成左旋多巴酶活低、产量不高等问题, 通过5 L发酵罐上发酵工艺的优化及补料策略的研究, 确定了最佳的发酵工艺参数:发酵过程中p H维持在6.5左右, 诱导温度选择30℃, 诱导剂为乳糖20 g/L。在补料策略的研究中, 本文对比了不同流速的恒速流加, 当补料速率为20 m L/h时, 生物量达到30.43 g dcw/L, 体积酶活最高为9 420 U/L, 是分批发酵所得产量的2.7倍, 较摇瓶发酵培养活力提高了3.3倍, 较好的提高了菌体的生物量和产酶水平, 提高了酪氨酸酚裂解酶活力和产量, 为工业化生产打下了坚实的基础。
参考文献
[1] SIDEROWF A, STERN M. Update on parkinson disease[J].Ann Intern Med, 2003, 138 (8) :651-658.
[2]孙怡, 杨任民.实用中西医结合神经病学[M].北京:人民卫生出版社, 1998:511.
[3] DE RIJK M C, TZOURIO C, BRETELER M M, et al. Prevalence of parkinsonism and Parkinson’s disease in Europe:the EUROPARKINSON Collaborative Study. European Community Concerted Action on the Epidemiology of Parkinson’s disease[J]. J Neurol Neurosurg Psychiatry, 1997, 62:10-15.
[4] NAGATSUA T, SAWADAB M. L-DOPA therapy for Parkinson’s disease:past, present, and future[J]. Parkinsonism Relat Disord, 2009, 15 Suppl 1:S3-S8.
[5] VALDS R H, PUZER L, JUNIOR M G, et al. Production of LDOPA under heterogeneous asymmetric catalysis[J]. Catalysis Communications, 2004, 5 (10) :631-634.
[6] KUMAGAI H, YAMADA, MATSUI H, et al. Tryosine phenol lyase:purification, crystallization and properties[J]. J Biol Chem, 1970, 245 (7) :1767-1772.
[7] ENEI H, MATSUI H, YAMASHITA K, et al. Distribution of tyrosine phenol lyase in microorganisms[J]. J Agric Chem Soc Japan, 2008, 36 (11) :1861-1868.
[8] KRISHNAVENI R, RATHOD V, THAKUR M S, et al. Transformation of L-tyrosine to L-DOPA by a novel fungus, Acremonium rutilum, under submerged fermentation[J]. Curr Microbiol, 2009, 58 (2) :122-128.
[9] LEE J Y, XUN L. Novel biological process for L-DOPA production from L-tyrosine by p-hydroxyphenylacetate 3-hydroxylase[J]. Biotechnology Letters, 1998, 20 (5) :479-482.
[10] SURWASE S N, PATIL S A, APINE O A, et al. Efficient microbial conversion of l-tyrosine to L-DOPA by Brevundimonas sp.SGJ[J]. App Biochem Biotechnol, 2012, 167 (5) :1015-1028.
[11]菜谨, 孙章辉, 王隽, 等.补料发酵工艺的应用及其研究进展[J].工业微生物, 2005, 35 (1) :42-48.
[12]叶勤.发酵过程原理[M].化学工业出版社, 2005.
[13]姚汝华.微生物工程工艺原理[M].广东:华南理工大学出版社, 1996.