摘要:生物医药在医药行业中占比逐渐增大,现代生物制药对产品质量和一致性控制提出了更高的要求,越来越多的过程研究工作致力于此。过程分析技术基于研发生产人员对产品属性及生产工艺的充分理解,融入到质量源于设计理念中,代表着未来生物医药行业的发展趋势。从质量源于设计理念及智能制造角度出发,阐述了过程分析技术在生物制品上游工艺、收获阶段、下游工艺、成品制备等过程中的最新应用研究。从微生物发酵、细胞培养、离心、复性、层析、配制、灌装、冻干等环节分析了过程分析技术应用的难易程度,并提出过程分析技术应用的挑战与前景。
关键词:过程分析技术; 生物制品; 质量源于设计; 智能制造; 生物工艺;
Research and Application of Process Analysis Technology in the Development of Biological Products
LI Xiaofang WU Hongbin MA Zhaotang
New Drug Application Center of Taizhou Medical Hi-tech Zone Jiangsu Vaccine Engineering Research Center
Abstract:The proportion of biopharmaceuticals in the pharmaceutical industry has been increasing gradually. Modern development of biopharmaceuticals place higher demands on product quality and consistency control, with more and more attention to process research. Based on the full understanding of product properties and production processes by R&D and production personnel, process analysis technology(PAT) has been integrated with the concept of quality by design(QbD), which represents the development trend of pharmaceutical industry in the future. In this paper, we expound the latest application of PAT for the production of biological products in the upstream, harvest, downstream and drug production in the biotechnological industry, from the view point of QbD and intelligent manufacturing. The difficulties of PAT application are discussed in microbial fermentation, cell culture, centrifugation, refolding, chromatography, formulation, filling and lyophilization, with the challenges and prospects for PAT application.
美国FDA于2004年发表了关于过程分析技术(process analysis technology,PAT)的指南:《PAT——创新药物的研发、生产和质量保证框架》,指明PAT是通过对相关原材料、中间物料及工艺的关键参数和指标进行实时监测,集设计、分析和生产控制为一体的系统,和传统质量保证手段相比,具有非常明确的优势。该指南鼓励研发创新,代表着FDA对未来医药产品研发和制造的愿景。2011年,FDA发布《工艺验证指南》,强调了对质量源于设计(QbD)和PAT的支持。我国2010版《药品生产质量管理规范》中明确指出:药品生产管理和质量控制的基本要求,旨在最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合既定用途和注册要求的药品。
全球生物医药产业迅速发展,据美国相关机构统计,全球生物医药产值在2010—2020年间保持年均增速约13.5%[1]。中国生物医药市场未来5~10年的发展主流也将会与世界同步,尤其是新型疫苗和单抗药物获得显著发展。PAT作为一个新的技术、理念和方法,在国内发展较晚,其主要被用于化药合成和中药生产,而生物制品由于工艺复杂性,PAT研究应用相对较少。近年来,国家从战略和政策层面不断加大对医药产业的转型升级,从药品一致性评价、药品管理法修订,到关联审评、全面药品上市许可持有人(MAH)制度。在历史性变革发展的新形势下,医药企业正面临解决技术升级、提升产品质量、提高环保标准、降低安全风险等在优化技术工艺过程中的各种问题。2018年,具有重大影响的“疫苗事件”,充分暴露了国内生物制品企业在生产中风险控制和质量管理的缺失,因此亟需更先进的过程控制策略。PAT作为规范生产过程的有效工具,在提高效率的同时可降低药品质量风险。本文从生物医药产业的发展趋势、监管要求以及PAT工具入手,探讨了PAT在生物制品研发生产工艺中最新进展和前景,旨在为我国生物制药行业质量控制的发展提供参考。
1 质量源于设计理念
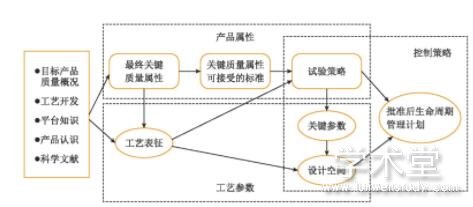
人用药品注册技术要求国际协调会关于药品研发的指导原则(ICH Q8)指出,质量不是通过检验注入到产品,而是通过设计赋予。FDA认为,QbD是从产品开发到工业化生产的精心设计,是对产品属性及其与生产工艺关系的透彻理解,另外QbD也是药品动态生产质量管理规范(current Good Manufacture Practices,cGMP)的基本组成部分,有助于GMP在药企中更好的实施。QbD通过合理的实验设计,研究原料、产品质量属性和工艺参数之间的关系,目的是加强对产品和工艺的理解以及过程控制[2]。QbD关注设计、工艺、材料、设施等,将风险评估应用到产品全周期中[3],如图1所示。
图1 QbD风险评估工具决策架构
2 过程分析技术工具应用
在药品生产质量控制中,将PAT贯彻于QbD,两者相辅相成,可以缩短生产周期,防止产生废品及增加返工程序,提高自动化水平,实现实时放行,减少人为错误,加强操作安全性,优化能源与原料利用率,提升过程可控性,确悉关键的可变参数,实施持续性管控药品质量属性[4]。表1介绍了PAT工具的应用情况[5],这种应用与目前大多数制药企业在生产后期分析测定产品质量的运营方式不同,但是与FDA的观点相符,通过对整体生产过程进行更深入的管理和控制,将质量根植于产品。
3 生物医药智能制造
我国政府提出“中国制造2025”规划,以应对新一轮科技革命和产业变革,立足于我国转变经济发展方式的实际需求,围绕创新驱动、智能转型、绿色发展,提出加快制造业转型升级、信息技术融合发展、拓展“智能+”的重大战略任务和重大政策举措。生物医药制造业的变革方向也将往自动化、信息化和智能化发展。自动化可以避免人工操作带来的生产偏差及因此引起的一系列成本,使生产出来的产品稳定;信息化是智慧车间的重要手段,基于大数据分析对生物医药制备过程进行有效诊断监管;智能化是终极方向,生物医药企业将使用计算机网络人工智能(artificial intelligence,AI)技术融合智能制造装备,构建高效节能、质量可靠的智慧工厂,实现智能生产[6]。Li等[7]介绍了一个PAT案例,通过四元隔膜泵、计算机、可编程逻辑控制器(PLC),联合在线传感器,对疫苗产品纯化层析中pH值及电导率实行自动化精准控制。
表1 过程分析技术工具在工艺质量控制中的应用
不少国际知名制药企业已经走在了“工业4.0”的前沿,例如辉瑞公司一直致力于先进创新技术与解决方案的研究,基于智能生产理念,利用最新自动化和相关学科知识,将实时放行(RTR)与连续化生产变成现实;诺华公司与麻省理工大学合作在巴塞尔建立试验工厂,研发的新药从向FDA申报注册时,即为连续化生产工艺,提高设备使用效率,实现更高的生产率并确保最终产品的高质量[8]。我国生物医药公司应当与国际企业站在同一个制高点,推动国内生物医药行业升级,实现生物医药智能生产的新目标,逐渐完善智能制造体系建设。
4 上游工艺研究应用
上游流程重点在发酵或细胞培养阶段,由于发酵和细胞培养工序是产物和杂质产生的关键步骤,极具重要性,在此步骤控制好杂质将极大地有助于后期处理工艺。发酵和细胞培养液的特点是组成复杂,通常气、固、液三相共存,其组分和含量不断变化。由于生物制品的复杂性和特异性,以及缺乏在线评估其质量属性的仪器,PAT在生物制品领域的应用受到限制。通过测定发酵或细胞培养中微生物/细胞数量、活性、营养物、代谢物、产物等指标,及其与温度、体积、pH、溶氧、流速、电导的关系,研究微生物/细胞培养过程的主要影响因素,并考察关键因素与产品表达的相关性,从而保证发酵和细胞培养的稳定性,降低传统的取样离线分析带来的污染风险,提升药品质量管理水平。
4.1 微生物发酵工艺
通过传感器、傅里叶变换红外光谱(FTIR)、流动注射分析(FIA)、高效液相色谱(HPLC)、电化学分析、质谱、2D荧光光谱、多元线性回归(MLR)、近红外光谱技术(NIR)等技术单独或联合使用,对微生物的发酵过程进行监测,提供实时数据,研发过程中优化发酵工艺,生产过程中确保产品稳定均一。Van de Merbel等[9]利用微孔超滤膜联合色谱系统进行在线监测,通过监测生物量、比生长率、产物和副产物浓度等参数变化,控制发酵过程。Gnoth等[10]在大肠埃希菌发酵过程中,利用蛋白产率与菌体比生长速率、发酵温度之间的相关性,建立了混合模型,结果显示,最优化条件下可提升目标蛋白25%产量,同时避免了包涵体的形成。常晓慧[11]利用NIR分析菌株发酵过程中原料消耗量和产物生成量,建立定量模型,判断菌株的发酵能力,该模型具有很好的拟合度和预测性能,因此NIR可开发成为高通量筛选菌株的有效工具。Ghader等[12]利用顶空-固相微萃取技术(HS-SPME)联合气相色谱-质谱技术(GC-MS)对发酵罐尾气中含硫化合物等挥发性有机物(VOC)含量进行测定,从而在线监测破伤风杆菌发酵流程,表明通过合适的技术测定特定生物标志物可作为一种新颖的发酵过程分析方法。
4.2 哺乳动物细胞培养工艺
一次性生物反应器为细胞培养的发展趋势之一,其应用广泛,在PAT应用上正在向更大规模、更高配置以及与下游纯化技术相结合的方向发展。细胞培养分析技术方法更为丰富,往往通过不同技术间以及与传感器之间的组合来进行研究。常见的传感器包括原位传感器、生物量传感器(结合流式细胞术)、电子鼻舌传感器、膜传感器[欧洲生物技术联合会(EFB)推荐]、柔性传感器等。常用的技术包括NIR、FIA、离子迁移谱技术(IMS)、介电谱技术、二维核磁共振波谱技术、拉曼光谱技术、多波长荧光技术、射频技术(RF)、原位显微镜技术(ISM)、生物高效液相色谱技术(Bio HPLC)等[13]。
Kuystermans等[14]利用全自动样品处理器及流式细胞技术实时监测中国仓鼠卵巢(CHO)细胞培养过程中的凋亡量,从而监控培养动态、提升产物产量及质量,该方法是一种新颖而有效的技术手段。Teixeira等[15]利用原位二维荧光技术结合化学计量统计,监测哺乳动物细胞培养过程中的关键生物工艺参数,包括活细胞密度和重组蛋白浓度,据验证准确度达到91%以上,可实时监测细胞浓度和抗体滴度。Esmonde-White等[16]报道,利用表面增强拉曼光谱技术(SERS)、以及拉曼光谱联合非线性模型预测控制器(NMPC),对CHO细胞培养中营养物浓度等参数进行监控,正在从实验研究往GMP生产应用上发展。另外,利用上述技术结合多变元(MVA)数据分析手段,对生物反应器内培养液定期扫描,再通过预先建立的数学模型对过程参数实时监测,可以在实际生产中进行真正意义上的生物过程质量检测、分析与控制[17]。
5 收获阶段研究应用
微孔过滤、深层过滤、均质化、离心和沉淀是生物技术产品收获中最常用的一些单元操作。收获工艺的目标通常是对上游步骤获得的发酵液进行预处理,以便下游操作进一步精制纯化。目的就是最大限度地提高产物回收率,并避免产物的降解。在生物制品收获工艺中,PAT的应用不如其他生产阶段,与上游工艺相比,收获流程的PAT研究相对较少。这可能是因为收获步骤对最终产品质量的影响有限,因此,实施PAT技术的优势不如上游或下游流程那么重要。但是也有一些产物对稳定性等方面有独特的要求,会将PAT应用于此阶段,比如利用NIR技术监测收获过程中活性药物成分(API)浓度;再如利用中空纤维膜提取分离发酵过程中产生的单克隆抗体,通过色谱采集柱或特异性G蛋白质分析色谱柱监测收获工艺[18]。
6 下游工艺研究应用
生物技术产品下游加工常用的纯化操作包括复性、层析、过滤和制备色谱等,整个处理过程由若干个目的明确的操作单元组成,相互影响。本工艺流程对产品质量一致性具有重要影响,因此对每个步骤适当的控制以及对整个工艺的连续性评估监测,显得非常重要。生物药物的稳定性受pH、温度、离子强度、提取过程所使用的溶剂和表面活性剂、金属离子等方面的影响,相对分子质量越大,稳定性就越差。因此,在分离纯化过程中,条件应当温和。由于层析等纯化操作与下一步工艺的间隔时间相对于检测时间而言比较短暂,因此PAT在下游工艺中的应用难度更大。
常用的PAT方法,是通过在线液相色谱分析技术、NIR分析技术检测目标生物药物纯度变化,建立纯化终点判断方法,优化药物纯化工艺,提高生物药的得率,减少纯化过程中生物药的活性破坏。如纯化过程中使用在线超高效液相色谱(UPLC)组合可提升单抗纯度(由99.1%提升为99.3%)及产量(由62.4%提升为62.9%)[19]。单抗药物纯化过程中使用在线疏水层析技术,相对于离线柱分离,纯度更高,均一性更好,偏差由0.16%降低为0.03%[20]。
另外也有一些PAT新方法的研究。Durous等[21]利用表面等离子共振成像技术(SPRi)测定病毒颗粒量,该法稳定可靠,可用于流感疫苗制备和纯化过程实时监测。Ladd Effio等[22]采用反向体积排阻-超高效液相色谱技术(iSE-UHPLC)对多种疫苗病毒样颗粒(VLP)的表征进行快速精确的检验,该法用于监测VLP聚合物纯化工艺,是一个稳定而有效的PAT工具。Tseng等[23]利用电喷雾差示迁移分析技术(ES-DMA)测定蛋白类药物浓度、分子尺寸,该技术作为一个潜在的PAT工具被用于病毒清除、蛋白聚集等纯化过程中。Yu等[24]利用动态光散射技术(DLS)监测重组蛋白疫苗包涵体(IB)增溶、蛋白复性和聚集过程,该技术是一种潜在的在线PAT工具。
7 成品制备研究应用
生物制品中配制、灌装是质量控制的重要环节,利用光谱分析技术对生物药配制灌装后进行瓶内真空度在线检测,筛选出密封不佳的制剂,从而提高制剂分装的合格率,避免因密封性不佳导致药品在储藏、物流过程中效价下降的情况发生。一般生产过程中由于常规微生物检验周期太长,导致生产过程监测和药品出厂检验在产品放行评价方面具有局限性,而不能及时指导生产过程。瞬时微生物检测光谱技术可以测定存在于液体或空气中粒子的数量和大小,同时还能检测出每个粒子是否具有生物活性,并且这些工作都是瞬间完成。通过抽样连续监控生产过程,当微生物数达到警戒值时,及时采取补救措施,同时依据实时反馈数据,验证补救措施是否成功。通过此项技术的研究进而减少生物药品被微生物污染的风险,并缩短药品出厂周期。
药品制备步骤中,将辅料和活性药物等配制起来,制成最终的配方。为增加生物制品稳定性,最后一步往往通过冻干流程实现。一个良好的冻干工艺,应具有产品质量稳定、时间短、能耗低、冻干周期可控、可验证的特征。由于这一工艺步骤对最终产品质量的影响很大,以及该步骤对各种环境条件敏感,冻干一直是许多PAT应用的焦点。在药品冻干过程中,监控温度以及准确判断一次升华干燥和解析干燥结束点是冻干工艺中需要控制的关键。传统方法建立在经验和反复实验基础上,而现代冻干方法建立在工艺设计、科学实验和风险评估基础上,如利用差示扫描量热仪、冷冻显微镜、气相色谱、液-质联用仪、近红外光谱以及激光调频光谱仪等,通过不断优化验证,实施过程控制,获取理想冻干曲线,用于冻干方法开发、品质控制等[25]。
在冻干工艺的PAT应用中,常用的传感器包括热流传感器、无线温度传感器、热电偶温度传感器(TC)、电阻式温度传感器(RTD)。常用的技术方法包括动压测温技术、可调谐半导体激光吸收光谱(TDLAS)技术、无线温度测控系统(TEMPRIS)、在线称重法、压力比值法[26]。运用气体质谱分析技术和低温等离子体激发光子分析技术,可以实时监测冻干过程,准确测定出气体成分和药物的相对残余含水量,并判断一次干燥和二次干燥终点,以及系统受污染或外界泄漏程度。Awotwe Otoo等[27]利用ControLyoTM成核技术和TDLAS技术控制单抗制品冻干中冰核形成,检测一次干燥过程中水气浓度和流速,其作为非侵入式在线PAT工具,可对冻干工艺进行实时监控。
8 结语
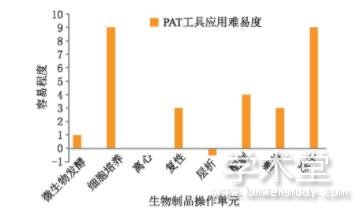
国外部分企业已将PAT成功应用于生物制品生产过程,国内在药物生产过程中的PAT研究也逐渐取得较大的观念突破,正在从生产质量一致性与QbD理念角度提升科学管理和风险管理能力。然而,实施PAT需要更高层次的工艺理解,这需要投入更多的时间和资源。图2展示了生物制品操作单元中PAT工具应用的难易程度[18],挑选了部分常规代表性步骤,以下一步工艺间隔时间与本步骤检测时间比值相对性为例,其中层析流程PAT应用上相对较难,离心流程则相对一般,而在微生物发酵、复性、灌装、配制、细胞培养、冻干等流程中,PAT的应用相对容易。
Nordon等[28]将PAT应用分为5个级别:1)通过光谱技术测定成分的浓度和其他性质;2)原材料质量检验及光谱数据分类;3)采用多元测量途径监测批次过程;4)利用批次监测数据和过程信息预测产品质量;5)通过对过程的反馈控制,保持产品质量。
据观察,尽管在我国生物医药行业,分析监测关键工艺和质量属性的能力方面(1~3级)取得了重大进展,但在利用收集到的数据进行后续工艺控制、实现最佳产量和产品质量方面仍有更多工作要做。从以上研究内容中可见,各方一直致力于生物医药PAT的应用融合。PAT加深了企业对生产过程的理解,提高了药品生产效率,加强质量均一稳定性,可以相信,后期将有更多的PAT应用投入到生物医药行业,并给企业带来良好的经济效益。
图2 生物制品常规操作单元中PAT工具应用的难易程度
参考文献
[1]Savage P,Mahmoud S.Development and economic trends in cancer therapeutic drugs:a 5-year update 2010-2014[J].Br JCancer,2015,112(6):1037-1041.
[2]Yu L X,Amidon G,Khan M A,et al.Understanding pharmaceutical quality by design[J].AAPS J,2014,16(4):771-783.
[3]Finkler C,Krummen L.Introduction to the application of QbDprinciples for the development of monoclonal antibodies[J].Biologicals,2016,44(5):282-290.
[4]省盼盼,罗苏秦,尹利辉.过程分析技术在药品生产过程中的应用[J].药物分析杂志,2018,38(5):748-757.
[5]Henriques J,Sousa J,Veiga F,et al.Process analytical technologies and injectable drug products:is there a future?[J].Int J Pharm,2019,554:21-35.
[6]孙钟毓,李连,杜冉冉,等.智能制造理念在血液制品产业的应用研究[J].中国药事,2018,32(9):1197-1206.
[7]Li M,Qiu Y X.A review on current downstream bio-processing technology of vaccine products[J].Vaccine,2013,31(9):1264-1267.
[8]Fraga-Lamas P,Fernandez-Carames T M,Blanco-Novoa O,et al.A review on industrial augmented reality systems for the industry 4.0 shipyard[J].IEEE Access,2018,6:13358-13375.
[9]Van de Merbel N C.Protein quantification by LC-MS:a decade of progress through the pages of bioanalysis[J].Bioanalysis,2019,11(7):629-644.
[10]Gnoth S,Simutis R,Lübbert A.Selective expression of the soluble product fraction in Escherichia coli cultures employed in recombinant protein production processes[J].Appl Microbiol Biotechnol,2010,87(6):2047-2058.
[11]常晓慧.QbD理念及胰岛素类似物生产中的过程控制策略[J].中国卫生产业,2018,15(10):184-186.
[12]Ghader M,Shokoufi N,Es-Haghi A,et al.Headspace solidphase microextraction(HS-SPME)combined with GC-MSas a process analytical technology(PAT)tool for monitoring the cultivation of C.tetani[J].J Chromatogr B Analyt Technol Biomed Life Sci,2018,1083:222-232.
[13]Yoshida T.Applied Bioengineering:Innovations and Future Directions[M].New Jersey:John Wiley&Sons,Inc.,2017:169-211.
[14]Kuystermans D,Avesh M,Al-Rubeai M.Online flow cytometry for monitoring apoptosis in mammalian cell cultures as an application for process analytical technology[J].Cytotechnology,2016,68(3):399-408.
[15]Teixeira A P,Duarte T M,Carrondo M J,et al.Synchronous fluorescence spectroscopy as a novel tool to enable PATapplications in bioprocesses[J].Biotechnol Bioeng,2011,108(8):1852-1861.
[16]Esmonde-White K A,Cuellar M,Uerpmann C,et al.Raman spectroscopy as a process analytical technology for pharmaceutical manufacturing and bioprocessing[J].Anal Bioanal Chem,2017,409(3):637-649.
[17]孙杨,聂简琪,刘秀霞,等.生物过程工程研究在创新生物医药开发中应用的驱动力--生物反应器[J].化工进展,2016,35(4):971-980.
[18]Rathore A S,Bhambure R,Ghare V.Process analytical technology(PAT)for biopharmaceutical products[J].Anal Bioanal Chem,2010,398(1):137-154.
[19]Tiwari A,Kateja N,Chanana S,et al.Use of HPLC as an enabler of process analytical technology in process chromatography[J].Anal Chem,2018,90(13):7824-7829.
[20]Shekhawat L K,Rathore A S.Mechanistic modeling based process analytical technology implementation for pooling in hydrophobic interacton chromatography[J].Biotechnol Prog,2019,35(2):e2758.Doi:10.1002/btpr.2758.
[21]Durous L,Julien T,Padey B,et al.SPRi-based hemagglutinin quantitative assay for influenza vaccine production monitoring[J].Vaccine,2019,37(12):1614-1621.
[22]Ladd Effio C,Oelmeier S A,Hubbuch J.High-throughput characterization of virus-like particles by interlaced sizeexclusion chromatography[J].Vaccine,2016,34(10):1259-1267.
[23]Tseng Y H,Pease L F 3rd.Electrospray differential mobility analysis for nanoscale medicinal and pharmaceutical applications[J].Nanomedicine,2014,10(8):1591-1600.
[24]Yu Z,Reid J C,Yang Y P.Utilizing dynamic light scattering as a process analytical technology for protein folding and aggregation monitoring in vaccine manufacturing[J].J Pharm Sci,2013,102(12):4284-4290.
[25]郭彦伟,李保国,郭柏松,等.药品冻干工艺过程分析技术研究进展[J].流体机械,2014,42(6):75-79.
[26]Ilona V,Victoria P.Evaluation of heat flux measurement as a new process analytical technology monitoring tool in freeze drying[J].J Pharm Sci,2017,106(5):1249-1257.
[27]Awotwe Otoo D,Agarabi C,Khan M A.An integrated process analytical technology(PAT)approach to monitoring the effect of supercooling on lyophilization product and process parameters of model monoclonal antibody formulations[J].JPharm Sci,2014,103(7):2042-2052.
[28]Nordon A,Littlejohn D,Dann A S,et al.In situ monitoring of the seed stage of a fermentation process using non-invasive NIRspectrometry[J].Analyst,2008,133(5):660-666.