摘 要: 哺乳动物受精需要精子运动到雌性生殖道与卵子发生融合,精子的激活运动和超激活运动为精子到达受精部位完成受精过程提供保障。活力低下的精子或无活力的精子占比很高时将对雄性生育能力产生不利影响,因此对精子活力进行分析是评估雄性生育能力的核心部分。精子的运动性对生育能力至关重要,但目前弱精子症仍然只是一个病理性的描述,对其潜在原因还了解不多,哺乳动物精子运动的研究具有重要的应用价值。本文对精子超显微结构及精子运动的几种调控机制进行阐述,旨在对临床研究精子运动的生理过程有更全面的理解,为弱精子症的治疗提供理论基础。
关键词: 哺乳动物; 精子; 鞭毛; 雄性不育; 分子遗传学;
精子良好的运动性是雄性正常生育能力的核心部分。精子运动活力低下或无活力的个体通常没有生育能力,除非借助先进的生殖技术辅助。目前,对于临床上弱精子症的发病机制仍知之甚少,除少数单基因缺陷(主要见于人类和实验动物)和一些明显的睾丸损伤原因,如创伤、热休克或射精后精子的储存外,导致弱精子症的根本原因还不为人知,因此对其进行的治疗也是非特异性的。对于改善育种管理,比如通过配子输卵管内移植(GIFT)或体外受精(IVF)技术、单精子卵泡浆显微注射(ICSI)等在临床上使卵子受精也是较为常见的方法。因此,弱精子症通常是精子活力低下的临床表现,而不是导致不育的真正诊断。
若仅依靠辅助生殖技术解决雄性不育问题,对精子中异常的基因及合成蛋白导致的不育不重视,可能无意中会让缺陷基因遗传给后代。因此,完整地了解关于运动精子的分子过程,对临床上更有效地解决精子运动能力的降低和相关低生育能力的问题,最终使弱精子症得到治疗甚至治愈具有重要意义,如通过刺激相关信号通路或基因治疗,而不是简单地利用ICSI逃避这个问题。另外,了解装配和调节功能性精子鞭毛需要的特定蛋白,也许能够人为地破坏其关键功能,从而开发一种安全高效的雄性避孕药。本文通过回顾对哺乳动物鞭毛功能和精子运动机制的认识,通过对不同动物模型(包括小鼠、大鼠、仓鼠等物种模型)的系统分析,了解到哺乳动物精子功能的潜在机制往往高度保守,这些对于进一步研究精子导致的不育机制研究具有重要作用。
1、 哺乳动物精子运动的2种类型
大部分哺乳动物精子有2种生理性运动:(1)新射精的精子中所见的激活运动;(2)受精部位的大部分精子中可见的超激活运动[1,2]。激活运动精子鞭毛产生对称性、低振幅摆动,驱动精子在精浆或稀释精液这种相对无黏性的环境中以近直线方式运动。大鼠试验证实激活鞭毛摆动提供的动力促进精子穿过雌性生殖道[3]。即使一些无运动性的精子到达了输卵管(可能是雌性动物生殖道收缩的结果),大部分缺乏动力的精子依然不能够到达子宫输卵管交界处,因而无法在体内受精。精子到达输卵管后的某一时刻,鞭毛摆动的模式会变成具有不对称性的高振幅摆动,精子在精浆或稀释的精液中静止时呈圆形或8字形轨迹[4],这种模式被称作“超激活运动”。近年来,研究表明在输卵管较黏稠的环境中超激活精子运动呈相对直线游动。相反,激活精子鞭毛的摆动不足以推动精子通过输卵管。超激活运动的生理学作用是帮助精子摆脱输卵管上皮细胞[5],在输卵管环境中逐渐移动到受精的位置。此外,超激活运动可能有助于精子穿透卵子。在对啮齿类动物的研究中发现,超激活精子运动也与精子在体外受精的能力有关[6,7]。因此,1个精子必须具备激活运动和超激活运动的能力以使卵子受精。如果这些事件没有在适当时间和地点发生,雄性的生育能力将显着降低。

在临床中我们通常通过处理新鲜的新射精精子评估激活运动,目前还没有先进的临床方法来诱导生理性的超激活运动,因此这种运动形式也很少在临床样本上检查到。目前,在临床上主要解决的是关于激活运动问题,故本文将主要综述激活运动的调节机制,及与超激活相关的具体项目。
2、 精子鞭毛的超显微结构
精子运动的“正常的鞭毛”超显微结构对其功能至关重要。鞭毛的4个主要超微结构亚区为:连接段、中段、主段和末端[8]。连接段是鞭毛最短的部分,连接到精子头部细胞核的植入窝。在这点上,从中心粒的剩余部分开始,鞭毛轴丝延伸到鞭毛的4个亚区。鞭毛轴丝由围绕中心微管的9组二联微管组成。内、外动力蛋白臂分别由9对外周二联微管发散出来,这些蛋白臂负责产生鞭毛的动力[9]。此外,分别来源于9对外周二联微管的9个轴幅向内以螺旋状在中心微管周围排列。
中段是仅次于连接段最接近头部的部分,约占鞭毛长度的1/4~1/3。中段是由9个外周致密纤维(ODF)和包围ODF的线粒体鞘(MS)形成。ODF延伸整个中段并进入主段部分,而MS只存在于中段部分。中段的终环标志中段的结束和下一个鞭毛组成部分主段的开始,主段约占鞭毛总长度的 2/3。在主段的开始即线粒体鞘的结束部位,2个ODF被2个纤维鞘(FS)取代,ODF的数量从9个减少至7个。FS是主段独有的结构,延伸整个主段,ODF的外周圆形纵向肋保证其稳定性。当主段接近终止时,ODFs和FS逐渐变细并最终消失。鞭毛的尾端被称为末端,只包含由细胞膜包围的鞭毛轴丝。
鞭毛轴丝在所有含有纤毛和鞭毛的真核细胞中高度保守。MS、ODFs和FS是哺乳动物精子鞭毛特有的附属结构(图1)[10]。尽管组成这些结构的蛋白质的编码基因中有一些已被克隆并进行特征描述,但大多数仍只是表面上的描述或完全没有被识别。
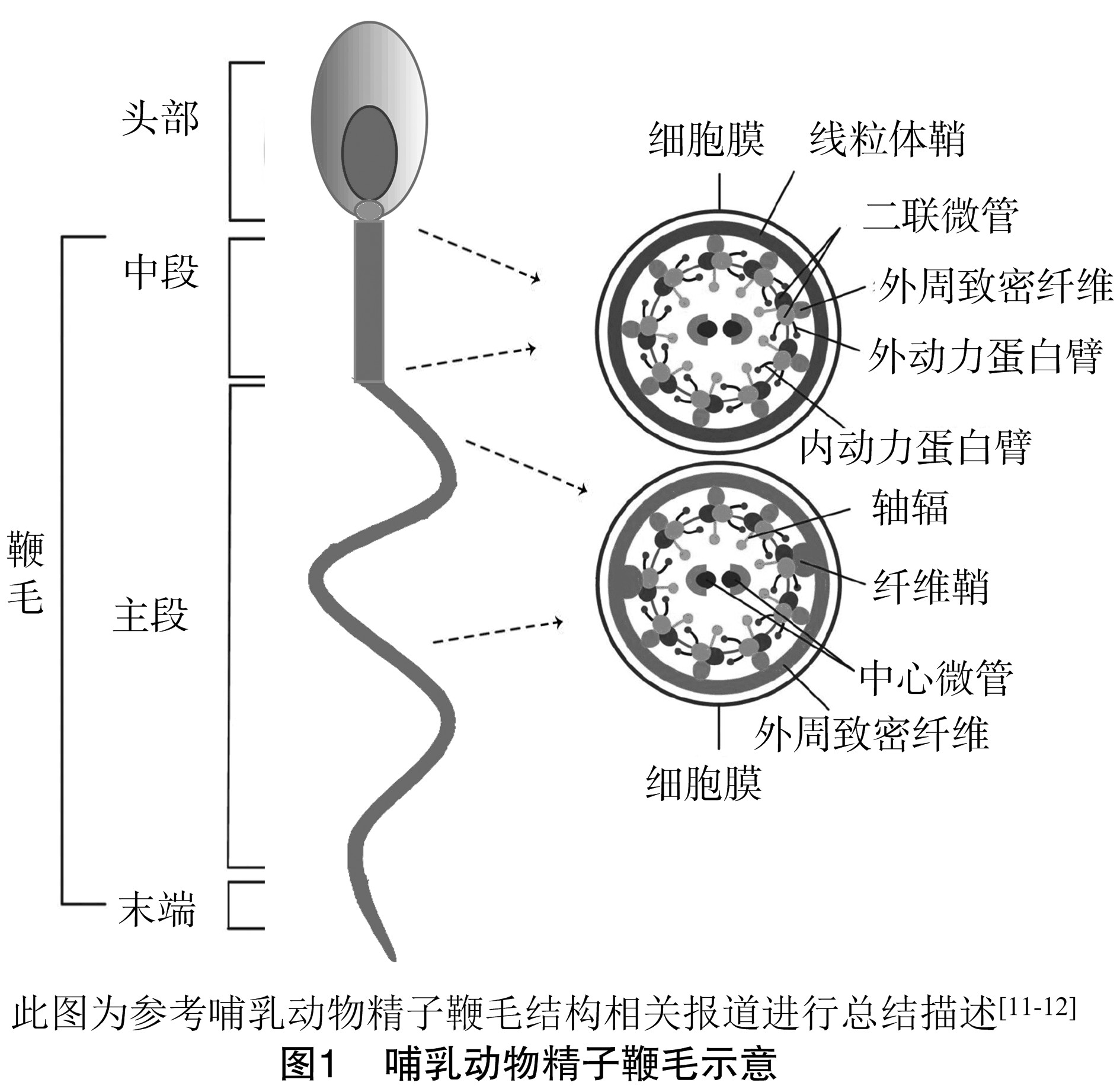
2.1、 鞭毛轴丝
鞭毛是所有真核生物纤毛和鞭毛运动的“马达”。在绿藻中,已有超过200种鞭毛轴丝和与轴丝相关蛋白被描述,哺乳动物的鞭毛轴丝与其相比复杂程度至少一样。在哺乳动物精子中α哺乳微管蛋白是迄今为止最重要的鞭毛轴丝蛋白[13],当腺苷三磷酸酶被激活时,它会导致相应外周鞭毛轴丝双微管的滑动,随着双微管一个接另一个滑动,鞭毛发生弯曲[14]。鞭毛轴丝蛋白的缺陷可导致鞭毛轴丝的异常组装和摆动,在绿藻的轴丝蛋白上进行大量的诱变试验,因此许多轴丝蛋白的缺陷已被证明可导致鞭毛缺乏运动性[15]。由于鞭毛轴丝存在于所有的真核生物细胞中,哺乳动物的鞭毛轴丝紊乱可导致临床症状,包含除精子外的其他类型的纤毛细胞。在人类和一些家畜中由轴丝排列异常导致的疾病已有研究,如鞭毛轴丝缺陷可导致精子活力低下或缺失,并伴有不育,如原发性纤毛细胞运动障碍[16];若排列异常影响到听觉毛细胞则会导致亚瑟氏综合征[17];当缺陷涉及视网膜的改良纤毛细胞时会导致失明[18]。
2.2、 外周致密纤维
ODFs第一个可疑作用是精子尾部的结构支撑,角蛋白样中间丝状体ODF蛋白编码基因的成功克隆为这一假说提供支持[19,20,21]。有研究表明,ODF对细胞骨架的构建和细胞分裂发育有重要作用。ODF与精子鞭毛功能受损有关,进而影响精子的获能,这说明ODF并非只是单一的结构蛋白。
2.3、 线粒体鞘
ATP作为鞭毛运动的能量来源,精子轴丝运动蛋白对ATP有较高需求。与其他细胞一样,精子线粒体通过有氧呼吸产生ATP。线粒体被终环限制只存在于精子中段的线粒体鞘中,而轴丝却贯穿整个鞭毛,如果线粒体ATP是轴丝唯一的能量来源,那么它必须扩散一段距离才能为整个轴丝充分供应能量。使用ATP扩散常数和地貌形态示量预估的小鼠精子鞭毛线粒体体积[22],数学模型表明,在中段产生的ATP是不足以扩散至尾端以满足动力蛋白的能源需求。此外有研究表明,小鼠不依赖线粒体的氧化磷酸化仍可发生受精[23],精子仍能产生ATP(低于野生型精子水平)且具有活力,尽管水平有所降低[24]。这些数据表明线粒体氧化磷酸化并不是支持鞭毛运动ATP的主要来源。
2.4、 纤维鞘
与ODFs一样,FS在精子运动中起着机械性作用,它为鞭毛提供有力支撑,并决定了鞭毛的平面运动[25]。FS的2个纵向肋连同外周纵向肋,形成了1个“工字梁”状结构,轴丝微管可以沿此轨道滑动,这种滑动形式具有cAMP依赖性,特别是cAMP依赖性的蛋白激酶A(PKA)参与[26]。由于越来越多参与精子运动信号通路和代谢的蛋白定位于FS,除了结构支撑作用外,FS在鞭毛运动调控中可发挥更直接作用。有研究表明,氧化应激可干扰精子活力和损伤DNA,至少有1种FS蛋白可以保护精子免受氧化应激的影响[27]。基于这些数据,现在普遍认为FS是对鞭毛功能至关重要的多种信号通路和代谢级联反应的支架和中心。
精子特异性GAPD-S是一种定位于FS上的酶,其靶向缺失可导致雄性不育,与精子活力异常紧密相关。许多哺乳动物的FS上可鉴定到糖酵解酶,如己糖激酶、乳酸脱氢酶和甘油醛-3-磷酸脱氢酶[28]。在某些情况下,这些酶的亚型是精原细胞特有的。此外,GAPD-S下游的所有糖酵解酶在去除膜后仍附着在细胞骨架上,表明它们是FS或ODFs的组成部分[29]。精子尾部最重要的ATP来源是在精子鞭毛主段上进行的糖酵解,而不是通过中段的氧化磷酸化途径[30]。基因敲除小鼠研究表明,主段上糖酵解产生ATP是超激活运动的必要条件,而抑制氧化磷酸化并不会阻碍受精[31]。
2.5、 随着鞭毛的拍击游动
当轴丝动力蛋白臂磷酸化时,动力蛋白ATP酶被激活,ATP水解驱动动力蛋白臂邻近的双微管一个接一个滑动[14,32],由于轴丝被锚定在精子头部底端,这种滑动力被转化为鞭毛的弯曲运动。钙调蛋白依赖性的磷酸酶钙调蛋白的去磷酸化可使这一过程发生逆转。
动力蛋白臂产生单向力,相关动力蛋白臂的磷酸化和去磷酸化及激活和失活在整个轴丝周围上以异步方式发生,使轴丝产生正常弯曲。每一个动力蛋白臂与邻近的双微管相互作用,产生一个动力使双微管弯曲,然后释放双微管,这样轴丝就可以回到它的原始位置并再次向相反方向弯曲。
3 、精子运动的调控机制
通常认为cAMP/PKA和钙信号通路是调控哺乳动物精子活力最重要的2个信号通路[33]。异三聚体和微蛋白介导的通路及pH值的变化也对精子运动起作用[34],但这些机制在成熟精子中还未清楚地表述。
3.1、 cAMP/PKA
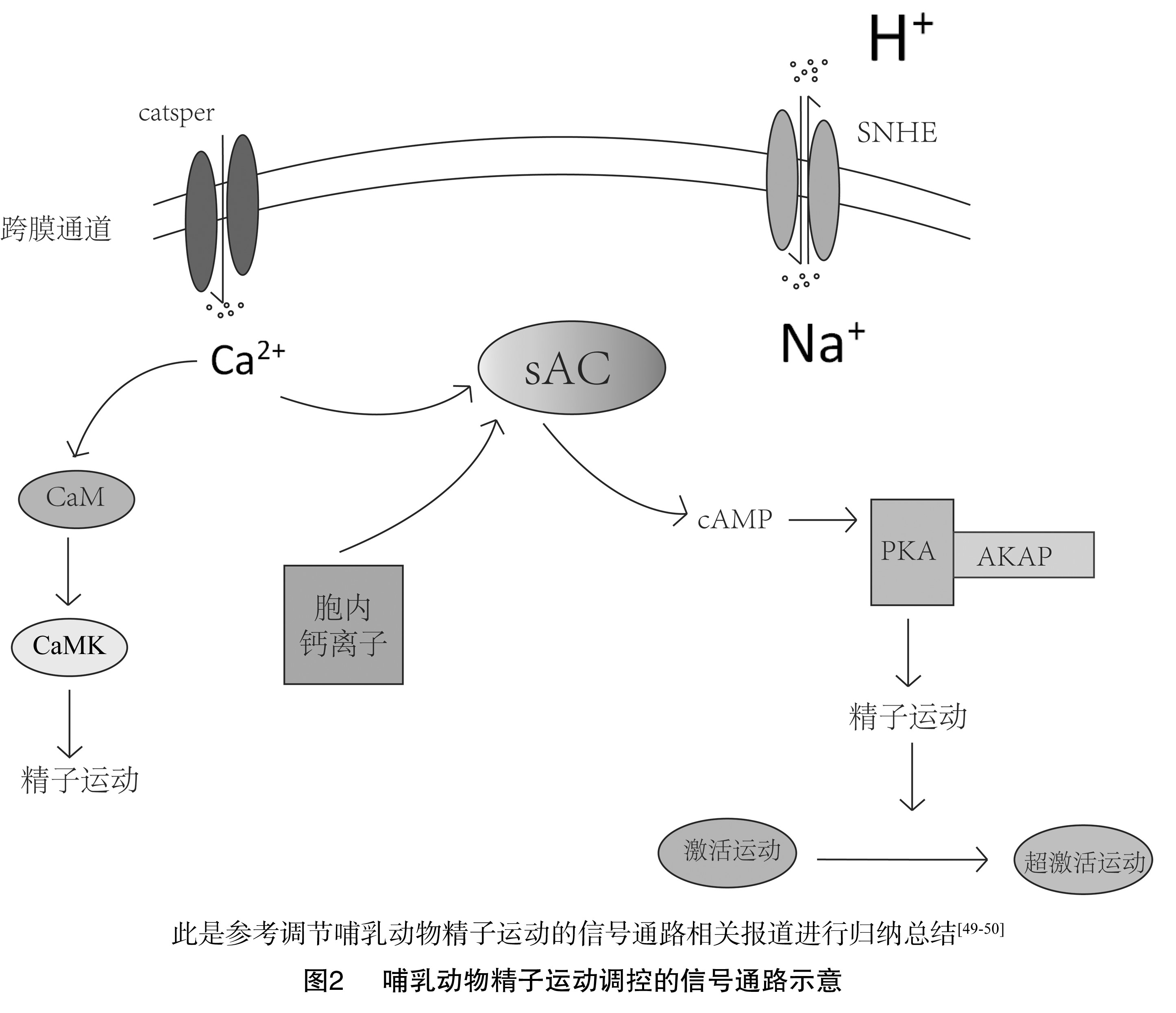
环磷酸腺苷依赖性的鞭毛蛋白负责一部分哺乳动物精子激活运动的启动和维持。在小鼠中,cAMP依赖的丝氨酸/苏氨酸蛋白激酶催化亚基的靶向缺失会表现出不育,可能是通过cAMP激活PKA影响精子的运动[35]。虽然PKA可能通过多种途径控制鞭毛功能,但其中一个作用机制是激活下游PKA靶蛋白丝氨酸/苏氨酸磷酸化传递介导胞外信号,影响精子活力。到目前为止,只有少数PKA磷酸化蛋白靶点在精子中被确定。已知的一个重要的蛋白靶点是轴丝动力蛋白臂,正如前文所述,其磷酸化是鞭毛运动启动的一个关键调节点。除调节PKA通路外,cAMP还可激活精子中的其他信号通路,如环核苷酸门控离子通道、cAMP介导的鸟嘌呤核苷酸交换因子。
鞭毛蛋白的酪氨酸酶磷酸化和去磷酸化与灵长类动物和啮齿类动物精子运动的启动和结束有关。其中一种含有酪氨酸酶磷酸化的蛋白是A激酶锚定蛋白(AKAP)。AKAPs是负责将PKA和其他蛋白锚定并作用于底物,催化靶蛋白丝氨酸/苏氨酸磷酸化的一类蛋白家族,AKAP介导的靶蛋白的变化与调节精子激活运动有关[36]。此外,pH值可通过胞内HCO3-/sNHE-sAC-cAMP-PKA信号通路调控精子鞭毛上运动相关结构蛋白的磷酸化水平从而影响精子鞭毛的摆动模式。
3.2、 钙信号
具有活力的精子样本中需要添加胞外钙,众所周知,钙可调节激活运动和超激活运动[37]。钙通过调节可溶性腺苷环化酶(sAC)影响鞭毛功能,sAC通过水解ATP生成cAMP来激活PKA。因此,钙信号通过sAC可作为通路的一部分与PKA信号连接起来,进一步引发PKA介导的cAMP/PKA信号通路调控精子活动[38],精子使鞭毛内钙含量增加的机制尚不完全清楚。细胞内部钙储备可能是原因之一,特别是在超激活化运动的调控中。与体细胞不同,除顶体外,精子鞭毛中无明显的内质网,故没有胞内钙储备。精子颈部的冗余核膜被认为是细胞内鞭毛钙的来源之一[39]。大量研究表明,除了胞内储存,胞外钙离子通过膜通道进入精子是影响细胞内钙水平变化的另一种方式[40]。
环核苷酸门控通道(CNGC)可能在鞭毛的不同微区产生不同的钙内流模式[41],这些通道的不同亚单位在精子中以不同的时间和空间模式存在。CNGC的羧基末端与cGMP和cAMP结合激活该通道,虽然在精子中CNGC对cGMP最敏感,它对cAMP的反应表明其与精子主要的运动调节通路(PKA和钙信号)有关。基因敲除研究也为胞外钙在胞膜上转运为精子运动所必需而提供强有力的证据。CatSper Ⅰ门控阳离子通道定位于成熟精子主段[42],是cAMP诱导钙离子流入精子所必需的[43]。CatSperⅠ基因的靶向缺失可导致精子细胞内的cAMP刺激消失,使胞内钙降低从而导致精子活力降低。在精子鞭毛中有另一个相关电压门控钙通道(CatSper Ⅱ),针对性地敲除CatSperⅡ基因会导致雄性不育,这与精子缺乏超激活运动有关[43]。由此可见,通道介导的胞外钙进入到鞭毛对激活运动和超激活运动均为必需。T型钙通道的亚型Cav2.3(α1E)靶向缺失的小鼠,尽管具有生育能力,但在精子胞内钙瞬时转变过程中表现异常,与野生型精子相比其精子线性度也存在差异。以上数据为膜通道在鞭毛功能调控发挥重要作用提供了进一步的证据。
3.3、 钙/钙调蛋白-钙调蛋白激酶
钙调蛋白是一种在真核细胞中普遍存在的胞内钙受体,因为抑制CaM会降低精子的活力[44],钙对鞭毛的某些影响可能通过CaM实现。研究表明,ATP可刺激PKA恢复CaM抑制的精子的活力。sAC作为Ca2+的传感器,激活sAC可使cAMP浓度升高调节精子运动,但CaM对精子运动的影响并不是通过sAC实现,所以钙对sAC的影响与CaM无关。
综上所述,这些数据显示至少存在2个不同的钙通道,其中一个是通过sAC这种环化酶实现(如sAC/PKA),另一个是通过CaM。由于sAC基因的缺失导致精子运动性降低,由此得出钙离子/CaM不能补偿sAC丧失的功能。然而,当CaM受到抑制时,PKA通路的激动剂可恢复精子运动,故sAC通路的成分可弥补钙/钙调蛋白激酶功能的丧失。
钙调蛋白激酶(CaMK)是CaM的下游目标。钙离子和CaM结合后激活CaMK,激活的CaMK促使cAMP增加从而启动精子运动[45],使用CaMK的抑制剂可降低精子活力[46]。所以CaM对精子运动的影响可能是通过激活鞭毛中的CaMK。有研究已将CaM与T型钙通道在精子中的调节联系在一起[47,48],钙调蛋白是一种钙离子/CaM依赖的丝氨酸/苏氨酸磷酸酶,也参与鞭毛运动的调节。因此,CaM/CaMK是哺乳动物精子运动中钙通路调节的成分。
3.4、 时间与空间上的精准调控
精子是一种高度分化的细胞,参与顶体反应的蛋白质必须定位于顶体。卵质膜上的蛋白质在精子的赤道部区域结合。在精子运动过程中需要的蛋白质必须定位到成熟精子的尾部,可使用AKAPs划分蛋白质。AKAPs是一个蛋白家族,其功能是将PKA连接至特定的亚细胞区域。AKAPs将PKA栓在鞭毛FS上,从而将激酶的作用范围限制在与运动相关靶点附近的轴丝内(图2)[49,50]。
在这方面,小鼠精子FS的主要蛋白是AKAP4[46]。目前,已知AKAPs是多种哺乳动物FS/主段的主要组成部分,这表明在进化上它们在鞭毛功能中的作用是保守的[51],因此也表现出其关键性。通过AKAPs将蛋白质解离在鞭毛的不同位置,可以确保合适的蛋白质在适合时间、适合位置表现鞭毛功能。小鼠AKAP4基因靶向突变使精子活力严重降低,证明AKPA锚定蛋白对鞭毛功能的重要性。PKA 2型调节亚基的靶向缺失及与其相关的PKA催化亚基锚定缺失,对小鼠的精子活力或生育能力没有明显影响[52],这似乎与精子运动需要PKA锚定(假设是通过AKAPs)作用的观点相矛盾,其原因可能是在鞭毛中存在的其他PKA亚型,在2型调节亚基失去锚定时对鞭毛产生补偿。
在体细胞中,AKAP家族成员是和激酶、磷酸酶一样的细胞支架。如果这些锚定蛋白在精子中发挥类似的作用,那么它们可能是调节运动所需的磷酸化/去磷酸化通路中的主要调控因子。
4、 导致精子运动异常的原因
目前,研究中获得的信息很少应用到临床实践中,但我们可推测出雄性先天性弱精子症的病因。如果精子尾部的超微结构有明显的形态学缺陷,则正常鞭毛的摆动可能出现机械性问题。通常这些异常可以通过对精子的常规形态学评估来确定,或者在特殊的情况下使用电子显微镜来确定。
精子线粒体蛋白的缺失会导致ATP合成受损,这将对精子功能产生不利影响,因此线粒体功能的测定对蛋白质缺失的线粒体是有效的。目前,证据表明精子的运动并非一定需要鞭毛中段的氧化磷酸化,所以线粒体功能低下未必是精子运动能力弱的主要原因。如果主段中正常糖酵解的临床试验能够发展起来,可证明糖酵解对精子运动有更直接的影响。
支持精子运动的信号通路相当复杂,信号通路任何异常都会导致精子活动性下降。例如,细胞膜钙通道的问题(如敲除catsper的小鼠精子显示不运动[53])及PKA信号通路中cAMP数量的变化(如敲除sAC的小鼠精子表现出不运动[54])和任何信号通路组成部分发生的问题(如发现CaM或CaMK受到抑制的精子运动能力降低[45,55])。如果类似的问题发生,那么在临床病例上极有可能表现为不育。
5 、结论
根据对精子运动分子基础上的探讨,我们已经了解精子运动所需的基因和蛋白质种类,这些蛋白包括参与精子结构、鞭毛组装、钙信号传导、蛋白磷酸化和靶向蛋白。但我们还没有研究精子发生过程中(例如无精子症基因DAZ的缺失)或正常生殖道的发育过程中(如囊性纤维跨膜转导调节子CFTR基因)涉及的基因,在全面解决先天性弱精子症之前依然还存在许多问题尚待解决。本研究从鞭毛生理学研究中获得的信息,将使临床上治疗弱精子症时,改进其对不育的诊断和具体治疗方法。另一方面,也可以通过抑制鞭毛的功能作用从而降低精子的活力,这可以引导我们开发出一种有效和安全的雄性避孕药。精子运动调节机制的研究在畜牧生产上也具有重要应用价值,为人工授精提供理论基础。
参考文献
[1] Suarez S S,Osman R A.Initiation of hyperactivated flagellar bending in mouse sperm within the female reproductive tract[J].Biology of Reproduction,1987,36(5):1191-1198.
[2] Katz D F,Vanagimachi R.Movement characteristics of hamster spermatozoa within the oviduct[J].Biology of Reproduction,1980,22(4):759-764.
[3] Gaddum-Rosse P.Some observations on sperm transport through the uterotubal junction of the rat[J].The American Journal of Anatomy,1981,160(3):333-341.
[4] Yanagimachi R.The movement of golden hamster spermatozoa before and after capacitation[J].Journal of Reproduction and Fertility,1970,23(1):193-196.
[5] Ishijima S.Dynamics of flagellar force generated by a hyperactivated spermatozoon[J].Reproduction,2011,142(3):409-415.
[6] Fraser L R,Quinn P J.A glycolytic product is obligatory for initiation of the sperm acrosome reaction and whiplash motility required for fertilization in the mouse[J].Journal of Reproduction and Fertility,1981,61(1):25-35.
[7] Boatman D E,Robbins R S.Bicarbonate:carbon-dioxide regulation of sperm capacitation,hyperactivated motility,and acrosome reactions[J].Biology of Reproduction,1991,44(5):806-813.
[8]Ounjai P,Kim K D,Lishko P V,et al.Three-dimensional structure of the bovine sperm connecting piece revealed by electron cryotomography[J].Biology of Reproduction,2012(73):1-9.
[9]Fiedler S E,Dudiki T,Vijayaraghavan S,et al.Loss of R2D2 proteins ROPN1 and ROPN1L causes defects in murine sperm motility,phosphorylation,and fibrous sheath integrity[J].Biology of Reproduction,2013,88(41):1-10.
[10] Turner R M.Moving to the beat:a review of mammalian sperm motility regulation[J].Reproduction Fertility and Development,2006,18(1/2):25-38.
[11] Barratt C L,Publicover S J.Sperm are promiscuous and catsper is to blame[J].EMBO Journal,2012,31(7):1624-1626.
[12]Du Plessis S S,Agarwal A,Mohanty G,et al.Oxidative phosphorylation versus glycolysis:what fuel do spermatozoa use?[J].Asian Journal of Andrology,2015,17(2):230-235.
[13] Lin J,Okada K,Raytchev M,et al.Structural mechanism of the dynein power stroke[J].Nature Cell Biology,2014(5):479-485.
[14] Ishijima S.Self-sustained oscillatory sliding movement of doublet microtubules and flagellar bend formation.[J].PLoS One,2016(2):e148880.
[15] Luck D,Piperno G,Ramanis Z,et al.Flagellar mutants of chlamydomonas:studies of radial spoke-defective strains by dikaryon and revertant analysis[J].Proceedings of the National Academy of Sciences of the United States of America,1977,74(8):3456-3460.
[16] Linck R W,Chemes H,Albertini D F.The axoneme:the propulsive engine of spermatozoa and cilia and associated ciliopathies leading to infertility[J].Journal of Assisted Reproduction and Genetics,2016,33(2):141-156.
[17] Weil D,Blanchard S,Kaplan J,et al.Defective myosin VIIA gene responsible for usher syndrome type 1B[J].Nature,1995,374(6517):60-61.
[18] Hunter D G,Fishman G A,Kretzer F L.Abnormal axonemes in X-linked retinitis pigmentosa[J].Archives of Ophthalmology,1988,106(3):362-368.
[19] Gastmann O,Burfeind P,Gunther E,et al.Sequence,expression,and chromosomal assignment of a human sperm outer dense fiber gene[J].Molecular Reproduction and Development,1993,36(4):407-418.
[20] Morales C R,Oko R,Clermont Y.Molecular cloning and developmental expression of an mRNA encoding the 27 kDa outer dense fiber protein of rat spermatozoa[J].Molecular Reproduction and Development,1994,37(2):229-240.
[21]Zarsky H A,Tarnasky H A,Cheng M,et al.Novel RING finger protein OIP1 binds to conserved amino acid repeats in sperm tail protein ODF1[J].Biology of Reproduction,2003,68(2):543-552.
[22] Du J,Tao J,Kleinhans F W,et al.Water volume and osmotic behaviour of mouse spermatozoa determined by electron paramagnetic resonance[J].Journal of Reproduction and Fertility,1994,101(1):37-42.
[23]Lindemann C B,Lesich K A.Functional anatomy of the mammalian sperm flagellum[J].Cytoskeleton,2016,73(11):652-669.
[24] Lindemann C B,Lesich K A.Functional anatomy of the mammalian sperm flagellum[J].Cytoskeleton,2016,73(11):652-669.
[25] Lindemann C B,Orlando A,Kanous K S.The flagellar beat of rat sperm is organized by the interaction of two functionally distinct populations of dynein bridges with a stable central axonemal partition[J].Journal of Cell Science,1992,102(Pt 2):249-260.
[26] Si Y,Okuno M.Extrusion of microtubule doublet outer dense fibers 5-6 associating with fibrous sheath sliding in mouse sperm flagella[J].The Journal of Experimental Zoology,1995,273(4):355-362.
[27] Fulcher K D,Welch J E,Klapper D G,et al.Identification of a unique mu-class glutathione S-transferase in mouse spermatogenic cells[J].Molecular Reproduction and Development,1995,42(4):415-424.
[28] Bunch D O,Welch J E,Magyar P L,et al.Glyceraldehyde 3-phosphate dehydrogenase-S protein distribution during mouse spermatogenesis[J].Biology of Reproduction,1998,58(3):834-841.
[29] Storey B T,Kayne F J.Energy metabolism of spermatozoa.V.The Embden-Myerhof pathway of glycolysis:activities of pathway enzymes in hypotonically treated rabbit epididymal spermatozoa[J].Fertility and Sterility,1975,26(12):1257-1265.
[30] Lhuillier P,Rode B,Escalier D,et al.Absence of annulus in human asthenozoospermia:case report[J].Human Reproduction,2009,24(6):1296-1303.
[31] Tash J S.Protein phosphorylation:the second messenger signal transducer of flagellar motility[J].Cell Motility and the Cytoskeleton,1989,14(3):332-339.
[32] Suarez S S,Vincenti L,Ceglia M W.Hyperactivated motility induced in mouse sperm by calcium ionophore A23187 is reversible[J].The Journal of Experimental Zoology,1987,244(2):331-336.
[33] Puga Molina L C,Luque G M,Balestrini P A,et al.Molecular basis of human sperm capacitation[J].Frontiers In Cell And Developmental Biology,2018,6(6):00072.
[34] Kleinboelting S,Diaz A,Moniot S,et al.Crystal structures of human soluble adenylyl cyclase reveal mechanisms of catalysis and of its activation through bicarbonate[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(10):3727-3732.
[35] Teijeiro J M,Marini P E.The effect of oviductal deleted in malignant brain tumor 1 over porcine sperm is mediated by a signal transduction pathway that involves pro-AKAP4 phosphorylation[J].Reproduction,2012,143(6):773-785.
[36] Visconti P E,Krapf D,Vega-Beltran L L,et al.Ion channels,phosphorylation and mammalian sperm capacitation[J].Asian Journal of Andrology,2011,13(3):395-405.
[37]Dirami T,Rode B,Jollivet M,et al.Missense mutations in SLC26A8,encoding a sperm-specific activator of CFTR,are associated with human asthenozoospermia[J].American Journal of Human Genetics,2013,92(5):760-766.
[38]Ho H C,Suarez S S.Characterization of the intracellular calcium store at the base of the sperm flagellum that regulates hyperactivated motility[J].Biology of Reproduction,2003,68(5):1590-1596.
[39] Tanaka H,Iguchi N,Toyama Y,et al.Mice deficient in the axonemal protein tektin-t exhibit male infertility and Immotile-Cilium syndrome due to impaired inner arm dynein function[J].Molecular and Cellular Biology,2004,24(18):7958-7964.
[40] Wiesner B,Weiner J,Middendorff R,et al.Cyclic nucleotide-gated channels on the flagellum control Ca2+ entry into sperm[J].Journal of Cell Biology,1998,142(2):473-484.
[41]Chung J J,Shim S H,Everley R A,et al.Structurally distinct Ca2+ signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility[J].Cell,2014,157(4):808-822.
[42]Vicente-Carrillo A,Alvarez-Rodriguez M,Rodriguez-Martinez H.The CatSper Channel modulates boar sperm motility during capacitation[J].Reproductive Biology,2017,17(1):69-78.
[43]Si Y,Olds-Clarke P.Evidence for the involvement of calmodulin in mouse sperm capacitation[J].Biology of Reproduction,2000,62(5):1231-1239.
[44] Nguyen T M,Combarnous Y,Praud C,et al.Ca2+/Calmodulin-dependent protein kinase kinases(CaMKKs)effects on AMP-Activated protein kinase(AMPK)regulation of chicken sperm functions[J].PLoS One,2016,11(1):e147559.
[45] Marin-Briggiler C I,Jha K N,Chertihin O,et al.Evidence of the presence of calcium/calmodulin-dependent protein kinase IV in human sperm and its involvement in motility regulation[J].J Cell Sci,2005,118(Pt 9):2013-2022.
[46]Lopez-Gonzalez I,Vega-Beltran L L,Santi C M,et al.Calmodulin antagonists inhibit T-type Ca2+ currents in mouse spermatogenic cells and the zona pellucida-induced sperm acrosome reaction[J].Developmental Biology,2001,236(1):210-219.
[47] Ickowicz D,Finkelstein M,Breitbart H.Mechanism of sperm capacitation and the acrosome reaction:role of protein kinases[J].Asian Journal of Andrology,2012,14(6):816-821.
[48]Luna C,Colas C,Perez-Pe R,et al.A novel epidermal growth factor-dependent extracellular signal-regulated MAP kinase cascade involved in sperm functionality in sheep[J].Biology of Reproduction,2012(93):1-11.
[49] Visconti P E.Understanding the molecular basis of sperm capacitation through kinase design[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(3):667-668.
[50] Carrera A,Gerton G L,Moss S B.The major fibrous sheath polypeptide of mouse sperm:structural and functional similarities to the A-kinase anchoring proteins[J].Developmental Biology,1994,165(1):272-284.
[51]Jha K N,Shivaji S.Identification of the major tyrosine phosphorylated protein of capacitated hamster spermatozoa as a homologue of mammalian sperm a kinase anchoring protein[J].Molecular Reproduction and Developent,2002,61(2):258-270.
[52] Burtan K A,Treash-Osio B,Muller C H,et al.Deletion of type Ⅱ alpha regulatory subunit delocalizes protein kinase A in mouse sperm without affecting motility or fertilization[J].The Journal of Biological Chemistry,1999,274(34):24131-24136.
[53] Ren D,Navarro B,Perez G,et al.A sperm ion channel required for sperm motility and male fertility[J].Nature,2001,413(6856):603-609.
[54] Esposito G,Jaiswal B S,Xie F,et al.Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect[J].Proc Natl Acad Sci U S A,2004,101(9):2993-2998.
[55]Ignotz G G,Suarez S S.Calcium/calmodulin and calmodulin kinase Ⅱ stimulate hyperactivation in demembranated bovine sperm[J].Biology of Reproduction,2005,73(3):519-526.





