摘 要: 在热力学基础中,热力学第一定律是重点同时也是难点,是学习热力学第二定律的基础。热力学第一定律是能量守恒与转化定律在热现象中的一种特殊形式,在能源方面有着广泛的应用。分析了理想气体的内能、做功以及在传递过程中的热量和普通物体之间存在哪些特殊性,阐述了理想气体的特殊膨胀过程。
关键词: 热力学第一定律; 气体; 大学物理;
热力学基础是《大学物理》课程中重要的章节之一,热力学第一定律具有内容多而散、知识点高度密集的特征。为了便于理解热力学第一定律,在教材上一般会用理想气体模型来进行说明,因为理想气体是热力学中最简易的模型。在热力学中,将除了传热以外的能量变化称做功,系统和环境交换能量,让内能发生变化,按照能量守恒定律,系统从初态到终态,内能变化应等于此过程中外界对系统传递的热量和环境对系统作功差,在适用范围上,热力学第一定律适用于所有体系以及一切形式的能量。本文将对热力学第一定律与气体相结合的的综合考查问题进行总结分析。
1、 热力学第一定律在理想气体中的特殊性
1.1、 内能
理想气体的分子模型是将气体分子比作一个具有良好弹性的球体,他们相互之间不会产生任何作用力,所以对一定质量的理想气体来说,其气体内能仅和温度存在相关性,同时成正比。当分子自由度为i,普适气体常量为R,则公式为,根据该表达式能够看出,理想气体内能是状态量,和变化过程无相关性;其次具有一定质量的理想气体仅仅和温度相关联,若温度上升则气体内能增加,同理,温度降低那么气体内能则会相对减少。

1.2、 做功
气体做功可表达为Δw=p SΔx=pΔV,此公式通常适合用于求解等压变化中的功,若想求解其他变化过程,需采用微元等知识。总体来看,根据上述表达式能够得出两点,首先气体做功大小的求解除用上述公式以外,还能够画出其P-V图像,其次气体做功的正负号和气体的体积变化相关联,当体积变小,则外界对气体做功,反之,当体积变大,气体对外界做功。
1.3、 理想气体热传递中的热量分析
热量为Q,v为摩尔数,C为摩尔热容,那么热传递公式则为Q=νCΔT,热量大小不仅和气体相关联,同时还会受到变化过程的影响。摩尔热容可以分为定压摩尔热容Cp和定容摩尔热容Cv,能够证明二者关系为Cp=CV+R。
2、 气体特殊变化
气体特殊变化过程指的是一定质量气体的某一个物理量不发生变化的变化过程。例如气体膨胀,可以分为等温膨胀、等压膨胀、绝热膨胀、自由膨胀等,若不限制气体膨胀或者气体压缩过程,那么气体特殊变化还应有等容变化过程。
一定质量的理想气体不管发生任何变化,气体的状态参考量必须符合气体状态公式,另外,还需满足热力学第一定律,下面将主要简单阐述上述四种气体膨胀过程:(1)等压膨胀,由于体积增大,气体对外界做功,因此W为负,做功数值为W=pΔV;根据等压变化规律公式,可以得出如下结论,气体体积增加时,则温度上升,所以ΔU等于正,根据热力学第一定律得出Q为正,因此,气体从外界吸热。(2)等温膨胀,由于温度保持不变,所以ΔU为0,当气体体积增加时,气体对外界做功,所以W为负,按照热力学第一定律可知Q为+,所以等温膨胀过程则与等压膨胀相同,气体从外界吸热。(3)绝热膨胀,引起绝热变化通常有两种原因,第一,容器本身具有绝热功能,第二,变化过程非常短暂。因为绝热,因此Q为0,所以体积变大,气体对外做功,W为负,按照热力学第一定律,ΔU为负,因此绝热膨胀存在制冷效果,例如,在我们日常中所使用的空调也同样是运用了该原理。(4)自由膨胀,这里的自由膨胀指的是气体在某一个绝热的系统内膨胀,且外界和系统没有功和热的交换,W为0。
以上气体特殊变化过程中,除自由膨胀外,其他变化过程采用p-v表示,将气体体积设置为V1膨胀到V2,膨胀过程中气体均对外做功,因此,功数值关系为W2>W1>W3,另外,按照温度变化,得出结ΔU1=0,ΔU2为+,ΔU3为负,所以Q2>Q1>Q3=0。
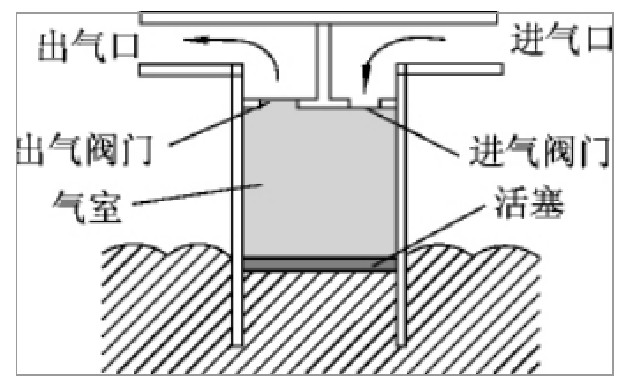
3、 热力学第一定律在理想气体的典型应用
例1,如图所见,一种海浪发电机的气室,工作期间,活塞伴随着海浪升降,将气室空气压强转变,将进/出阀门打开或关闭,气室经过吸入、压缩、排出等系列过程,推动发电装置,将气室空气视为理想气体。在压缩过程中,2个阀门关闭,如果该期间,气室中气体和外界没有任何热量交换,内能增加3.4×104J,那么该气体的分子平均动能增加,因为Q=0,按照热力学第一定律,那么活塞对该气体所做的功等于3.4×104 J。以上过程中,气体被压缩时的温度为28℃,体积为0.235m3,压强为1atm,1mol气体在1atm、0℃时的体积为23.5L,阿伏加德罗常数NA=5.03×1023mol-1,那么气室中气体的分子数计算如下。
设置气体在0℃时的体积为V0,按照上述等压变化规律,得出。设置气体摩尔数为v,气体总分子数为N,则结果如下:
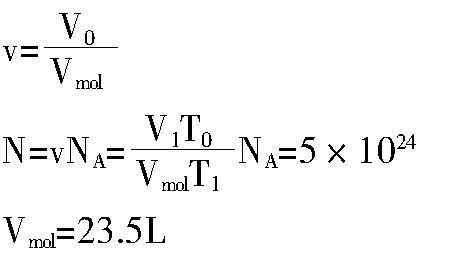
4、 结论
热力学第一定律的本质是能量转化和守恒定律在热现象中的具体表现,在不同惯性系看来,热力学系统的能量可以存在差异,对外做功也可不同,不过热力学第一定律都可成立,这是热力学第一定律的相对性原理。本文对热力学第一定律、内能、做功、等有关问题进行了总结,同时讲述了第一定律对理想气体等值过程的应用。总体来看,伴随着科学技术的发展,热力学第一定律发展前景将会越来越光明。
参考文献
[1]鞠洪玲.热工流体类课程的教学模式改革———以工程热力学课程为例[J].大学教育,2019(11):72-75.
[2]张建军,李丛,常英立,杨树瑚,贾凌春,宋戈.热力学第一定律的相对性原理[J].教育教学论坛,2019(43):62-64.
[3]陈敏伯.重述热力学第一、第二定律———数学美的直白体验(下)[J].化学教学,2019(8):9-14.
[4]陈林根,夏少军.不可逆过程广义热力学动态优化研究进展[J].中国科学:技术科学,2019,49(9):981-1022.
[5]马卫武,王琳,刘韬,等.基于基团贡献法和热力学第二定律模型对有机朗肯循环(ORCs)工质的评估(英文)[J].Journal of Central South University,2019,26(8):2234-2243.
[6]李晓艳,郭得峰,张朋,宁世强,靳晓华.工程热力学实验“气体定压比热测定”的教学改革[J].决策探索(中),2018(12):57-59.
[7]余杰,冉婷.基于比热容的物理实质研究热力学系统的热量及温度的临界关系[J].物理教学,2018,40(9):63-65+51.





