摘 要: 人类遗传资源是开展健康相关研究的不可替代资源, 中国丰富的人类遗传资源具有重要的研究开发价值。目前, 美国已经建立起了较完善的管理体系, 在重要管理环节制定了明确的指南和规范, 确保个体隐私安全和国家生物安全的同时, 最大限度地促进资源的开发利用。现通过对美国人类遗传资源管理现状进行研究分析, 提出对我国人类遗传资源管理的建议, 为完善我国人类遗传资源保护, 促进人类遗传资源的开发利用, 实现监管和创新的平衡提供决策参考。
关键词: 人类遗传资源; 美国; 中国; 管理; 启示;
Abstract: Human genetic resources are irreplaceable resources for health related research. China's abundant human genetic resources have important value. At present, the United States has established a relatively complete human genetic resources management system, and formulated clear guidelines in important management links, to ensure individual privacy security and national biological security while maximizing the development and utilization of resources. Basing on the research and analysis of the current situation of human genetic resources management in the United States, this paper puts forward some suggestions on the management of human genetic resources in China, so as to provide decision-making reference for improving the protection of human genetic resources in China, promoting the development and utilization of human genetic resources, and achieving the balance between supervision and innovation.
Keyword: human genetic resources; United States; China; management; enlightenment;
人类遗传资源是指含有人体基因组、基因及其产物的器官、组织、细胞、核酸、核酸制品等遗传材料及其产物的信息资料。自20世纪80年代以来,基因编辑技术不断发展,人类遗传资源保护的问题随之出现。近年来,人类基因组计划取得突破性技术进展,人工智能、大数据等新兴技术涌现,人类遗传资源的价值更加凸显,作为国家重要的战略资源,在寻找难治愈疾病和罕见疾病的治疗方案,揭示群体多态性与人类疾病的关系等方面具有重要作用,其合理使用和保护不仅与我国医学事业发展息息相关,更在保障国家生物安全与国防安全上具有重要意义。1998年,我国就制定了《人类遗传资源管理暂行办法》,但目前还存在监管效力位阶不够、管理细则不够明确、对不同类型的研究监管“一刀切”,以及数据管理和共享缺乏必要的标准和规范等问题。
1、 管理概况
美国政府高度重视人类遗传资源的管理和利用,已通过联邦政府立法明确管理机构和职责,出台配套的管理规定、指南和标准,建立起了较完整的管理体系,最终目标是要实现资源有效保护与有效利用之间的平衡。
1.1、 人类遗传资源管理机构
美国人类遗传资源的宏观管理由美国卫生与人类服务部 (Department of Health and Human Services, HHS) 负责,其下设的人类研究保护办公室 (Office of Human Research Protections, OHRP) 主要对涉及人类受试者的有关法律法规进行解释、监督、认证、指导等。美国食品与药品监督管理局 (Food&Drug Administration, FDA) 作为重要的监管机构,对获取人类遗传资源的基因检测研究和使用人类遗传资源开展的研究活动进行监管;美国国立卫生研究院 (National Institutes of Health, NIH) 作为人类遗传资源重要的研究利用机构,主要负责制定相关的管理指南以及样本资源库/数据库的建设和管理等。
1.2、 对人类遗传资源保护的立法
目前美国还没有联邦层次的关于人类遗传资源保护的单一立法。

在基因专利的立法上,美国最高法院在2013年6月13日的第12-393号案件中做出最后的裁定,分离出的未经修饰的基因 (DNA片段) 属于自然产物,不符合美国专利法第35章第101条规定,因此不能被授予专利,但是对cDNA和合成的DNA分子,虽然保留了天然形成的DNA外显子,但仍与衍生源DNA不同,确实涉及到一个创新的步骤而不是自然界的产物,因此具有专利的资格。
在人类遗传资源的隐私安全方面,主要的法律包括1996年由美国国会颁布的《健康保险携带和责任法案》 (Health Insurance Portability and Accountability ACT, HIPAA) 和2008年美国总统签署的《反基因歧视法》。HIPAA隐私规则的目的是既实现对个人健康信息的保护,又确保研究人员可以持续获得必要的信息来进行重要的研究。HIPPA对生物医学研究中如何保护受试者的隐私做出了详细的规定,提出了受保护的健康信息去识别的标准、可去识别后使用和公开的标准,使用和公开受保护健康信息,或从另一个受管辖机构或其商业伙伴获取受保护健康信息的最低必要标准及实施规范[1]。《反基因歧视法》以维护人类尊严、平衡人的尊严和技术的开发利用之间的风险和受益,促进遗传科学发展并最终造福人类为宗旨,通过联邦立法建立了保护个人免受基因检测带来的遗传信息歧视的统一标准,对个人遗传信息的披露和保密要求做出了明确规定,提出了不伤害原则、知情同意原则、维护个人遗传机密性等人类遗传资源管理和保护的原则[2]。
在涉及人类遗传资源的研究管理方面,现有的法律主要包括美国联邦法规第45章46部分“对人类受试者的保护通则”[3]和《胚胎组织移植研究公法》[4]。对使用带有遗传信息的人体生物样本和组织进行研究时获得组织捐赠者/受试者的知情同意标准、保护个人隐私信息的标准、伦理原则和规范、批准开展研究的要求以及禁止开展研究的范围、机构开展研究的政策依从性保证等做出了明确的规定。
1.3、 管理规定和指南
除联邦政府出台了比较完善的立法规制外,美国HHS和NIH遵照联邦法规的原则,颁布了相配套的管理规定、指南和标准,对人类遗传资源的管理涉及隐私保护、知情同意、数据存储、数据共享、研究使用等要点,包括:HHS《研究中使用编码的隐私信息或样本的指南》[5]、HHS《研究中使用存贮数据或生物样本的指南》[6]、HHS《涉及人胚胎干细胞的研究指南》[7]、HHS《个人可识别健康信息的隐私标准》[8]、HHS基于《反基因歧视法》制定的《研究人员和机构审查委员会反基因歧视执行指南》[9],以及NIH先后发布的3项基因组研究数据共享政策[10,11]、NIH《涉及重组或合成核酸分子的研究指南》[12] (以下简称NIH指南) 等。这些管理规定和指南对美国人类遗传资源管理中的实践操作制定了更细化和明确的规范和要求。
2、 美国对人类遗传资源获取和存储的管理
在对遗传资源采集和存储的管理上,美国已经就人类遗传资源获取的审批条件、审批流程、获取过程中的隐私保护和数据储存的要求等出台了具体的实施指南。
2.1、 HHS对人体组织储存库样本采集的管理
HHS下属的研究风险保护办公室 (Office for Protection from Research Risks, OPRR) 负责提供关于人体组织储存库相关活动的操作指导[13]。
首先,样本采集活动的开展必先经过机构审查委员会的批准 (Institution Review Board, IRB) ,正式开始前需提交由当地IRB批准的样本采集协议,协议中应有充分的条款来保护受试者的隐私,维护数据的机密性。其次,样本采集机构应参照美国联邦法规第45章46.116条的要求获得每个样本捐赠者的书面知情同意书,知情同意书中需要说明: (1) 细胞储存库运作情况的概述; (2) 要进行的具体研究类型; (3) 将数据和标本发放给样本接收者的条件; (4) 保护受试者隐私和维护数据机密性的程序。第三,采集机构还要提供合规性保证。
2.2、 HHS反基因歧视法指南对基因检测研究的隐私保护要求
反基因歧视法指南的制定依据是2008年颁布的《反基因歧视法》,所有由HHS资助、界定为涉及人体受试者的研究都需要遵守该指南,包括所有进行基因检测和获取受试者遗传信息的基因研究。指南明确了IRB批准研究的标准和获得受试者知情同意的要求[14]。
IRB审批研究的要点包括: (1) 是否达到对受试者造成的风险最小化的要求; (2) 是否对研究预期受益和受试者承担的风险进行了合理的平衡; (3) 是否制定了充分的条款来保护受试者的隐私和维护数据的机密性。研究机构制定知情同意书需要考虑的首要原则是,《反基因歧视法》提出的对人体受试者的保护原则是否已经体现及如何体现在知情同意书中对试验风险的描述和确保数据机密的条款中。
此外,指南对《反基因歧视法》中的违规条例进行了解读,为开展研究的科研人员和履行监督职责的管理人员明确了有关遗传信息歧视的法律禁令。
2.3、 FDA对基因检测的监管
美国基因检测相关活动的监管由医疗保险和医疗补助服务中心、FDA和美国联邦贸易委员会负责,其中,FDA拥有基因检测监管的最高权威[15]。
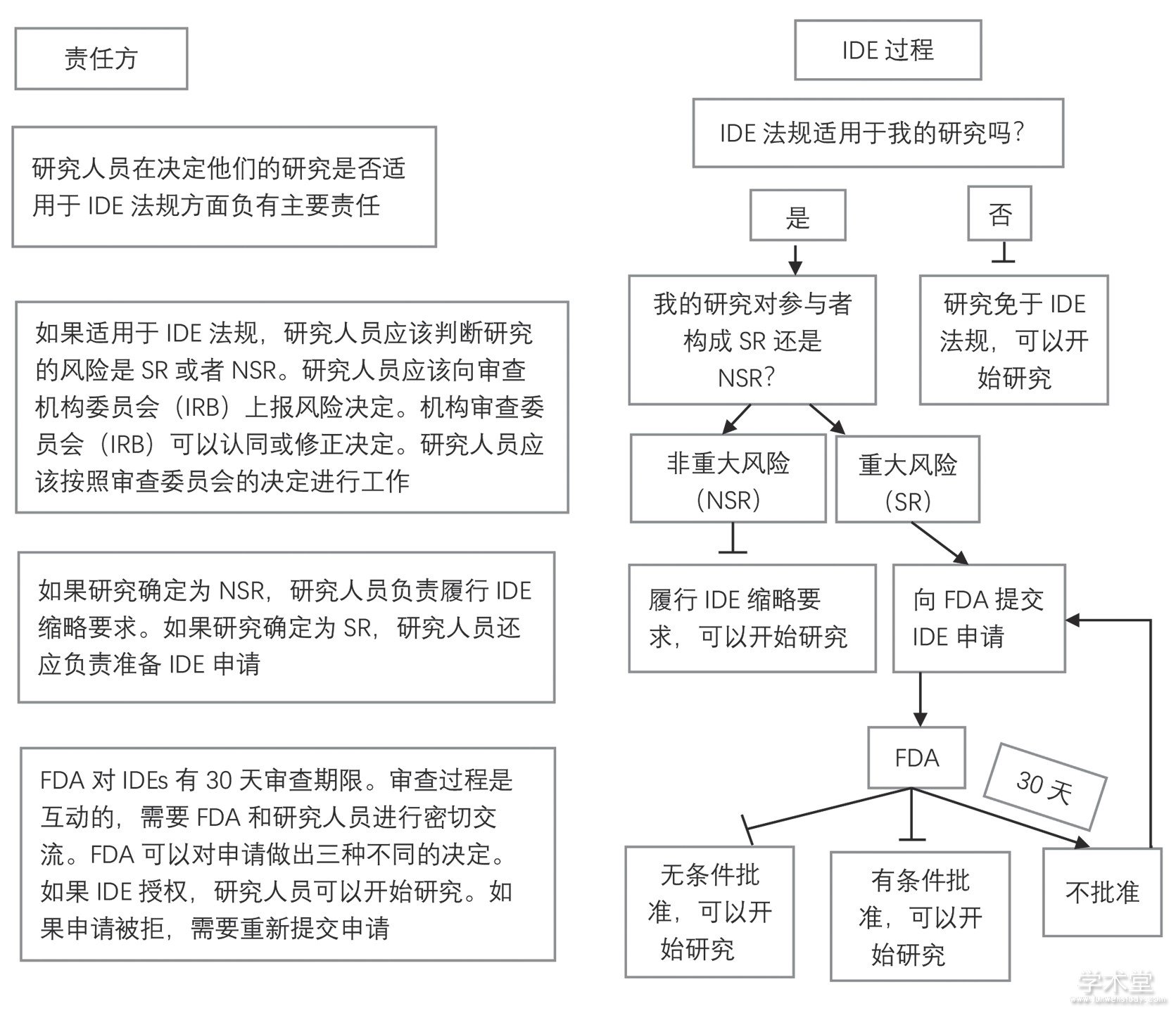
2010年起,FDA宣布对在美国开展的所有基因检测活动进行监管。对于涉及基因组、外显子组测序等技术的基因组研究,在招募受试者之前需要先向FDA申请“医疗器械豁免 (investigational device exemptions, IDE) ”[16]。IDE类似于“新药临床试验申请 (investigational new drug, IND) ”, IDE过程的目的是要证明该项检测技术/手段的有效性以及保护研究受试者的利益。如果一项研究提出使用未经FDA批准的基因组检测技术,那么在招募受试者前,必须考虑FDA的IDE规定。对于一些特殊情况,临床基因组学研究可以免于IDE规定,也就是“IDE豁免”。如果是适用于IDE规定的基因组研究,首先要确定研究的风险,当涉及基因检测的研究确定对受试者构成“重大风险 (SR) ”时,研究者必须在开始研究之前向FDA申请IDE;而确定为“非重大风险 (NSR) ”的研究可以在没有FDA审查的情况下开始,但仍需遵守“IDE缩略要求” (图1) 。
2.4 、NIH基因组数据存储的管理
根据NIH的基因组数据共享政策 (genomic data sharing policy, GDS) [17],无论是向哪个数据库提交数据,只要属于GDS政策范围,研究人员都应当在实施数据清洗和质控措施之前在NIH基因型和表现型数据库 (database of genotypes and phenotypes, dbGaP) 上注册此项研究。在dbGaP注册后,再向NIH指定的数据库 (如GEO、SRA等) 提交数据。
为促进数据共享,不需要将NIH指定的数据存储库作为数据的唯一来源,还可选择非NIH指定的数据存储库提交数据,但无论选择何种提交途径,都必须确保采取了适当的数据安全措施,且数据保密性、隐私和使用方法均符合GDS政策的要求。
3、 美国对人类遗传资源研究使用的管理
在人类遗传资源的使用管理方面,要点也主要围绕在受试者的隐私保护、受试者的知情同意、保障数据安全几个方面,无论是出于何种研究目的和用途,始终以保护受试者的利益为首要原则。
3.1 、HHS对研究使用存储数据或生物样本的相关规定
3.1.1 、HHS关于使用编码的个人隐私信息和生物样本的指南
该指南由HHS下属的OHRP制定,适用于所有由HHS开展或资助的、使用编码的个人隐私信息或人体生物样本开展的研究[18]。该指南在HHS关于保护研究中人体受试者的管理框架下,为判定使用编码的个人隐私信息和生物样本是否属于涉及人体受试者的研究提供了明确的指导,阐明了涉及使用个人隐私信息或生物样本但不属于人体受试者研究范畴和不受HHS规定约束的人体试验研究的区别。其中一些由HHS资助的相关研究,还需要接受美国FDA的监管,但由于FDA法规第21章50.3 (g) 条和56.102 (e) 条与美国联邦法规第45章46.102 (f) 条对人体受试者的定义有所不同,因此,该指南不适用于FDA监管下的此类研究。
根据美国联邦法规第45章46.102 (f) 条对人体受试者的定义,指南中界定的属于使用可识别的个人隐私信息或生物样本开展的人体临床试验的情况主要包括但不限于: (1) 使用、研究或分析可识别的个人隐私信息或从任何来源提供给研究人员的可识别身份的生物样本; (2) 使用、研究或分析研究人员已拥有的可识别身份的个人隐私信息或生物样本。如果研究人员属于以下情况,则不适用于该指南中的相关规定: (1) 不是通过活体获取的个人隐私信息或生物样本; (2) 无法通过编码系统直接或间接地将个人隐私信息或生物样本与特定的个体联系起来。指南对个人隐私信息和生物样本的界定既包括相关存储库中已有的,也包括超出当前协议的研究目的以外,未来可能会采集的个人信息和样本,如个人医疗记录和样本库中在持续采集的样本等。
图1 美国FDA对基因检测监管的IDE流程
3.1.2、 HHS关于数据或样本使用的协议规定
根据HHS对研究使用样本库存储数据或组织的相关规定,接收样本的研究机构应当在使用前签署一份书面的样本使用协议[19]。使用协议应包括以下内容: (1) 样本接收者承诺使用该样本材料的条件将根据HHS的规定由细胞储存库及其IRB决定; (2) 接收者同意严格遵守所有条件,并及时向细胞储存库报告任何拟采取的变更,以及包括对受试者或其他人产生风险在内的任何未预料到的问题; (3) 样本接收者仍然受为捐赠者提供额外保护的国家或地方法律、法规和机构政策的约束; (4) 本研究材料只能按照细胞储存库的IRB规定的条件使用,材料的额外用途需要通过IRB的事先审查及批准,并且召开审核会议制定OPRR认可的承诺书。
3.2、 NIH对基因组数据研究使用的管理
3.2.1、 GDS政策
NIH提出,基因组研究数据应当充分地共享,加快研究结果向有助改善人类健康的知识和产品转化。GDS对基因组数据使用的管理包括“知情同意”、“分级管理”、“知识产权保护”3个要点[20]。 (1) 知情同意。GDS政策的一个关键原则是期望研究人员能够获得参与者的知情同意,以便于在未来使用去识别的数据进行研究和广泛共享而加速研究。GDS政策特别指出,希望提交数据的任何机构都能证明数据是以符合法律和伦理的方式来收集的,个人身份标识符 (如姓名或地址) 已被除去。 (2) 数据分级管理。从2007年起,NIH就对dbGaP采用两级数据发布系统进行管理,不受限制的数据直接对公众公开,受限制的数据仅可用于研究性目的,需得到数据相关原始研究者的授权后方可使用。2014年,新发布的GDS政策继续沿用了已有的两级数据发布系统,数据分级的依据是数据的敏感度和隐私性。对于受控级别的数据,研究人员只能在经过批准的研究中使用,并保证数据的机密性,其中包括不与未经授权的人员共享数据;同时,在相关研究的展示和出版物中致谢提交相关数据的研究人员。 (3) 知识产权保护。由NIH资助的研究产生的基因组数据采用《NIH基因组专利发明授权最佳实践》[21]和《NIH基金资助政策声明》[22]关于共享研究资源提出的框架,对从下游研究发现中取得的知识产权进行管理。NIH禁止利用基因专利阻止使用或访问NIH资助产生的基因组或基因型-表型数据。
3.2.2、 NIH指南
早在1976年,NIH就制定了关于重组DNA分子的研究指南 (NIH指南) ,要求所有接受NIH或美国联邦政府资金资助开展的涉及DNA重组的研究,或即使是由私人资金资助,但开展研究的机构曾接受过NIH在相关领域的项目资助,都必须遵守该指南。
该指南对开展重组DNA研究时所必需的生物安全和防护措施提出了明确要求,描述了在开展人体临床试验研究时需要遵循的伦理准则和研究过程中不良反应事件安全报告的规定。在附录M中[23]特别明确了在出现严重不良反应事件或其他生物安全问题时向NIH生物技术研究管理办公室 (NIH Office of Biotechnology Activities, OBA) 和FDA提交情况报告的要求,包括:研究机构必须在出现问题后的15个工作日内向OBA报告,如果是危及生命的紧急情况,则时间缩短在7个工作日内,其他所有的不良事件也需要每年提交一次总结报告。指南还提出,开展重组DNA研究的机构必须建立一个机构生物安全委员会 (Institutional Biosafety Committee, IBC) ,并在OBA注册备案,机构在开展研究前必须获得IBC的审查和批准。
3.3、 FDA关于使用不能鉴别身份的剩余人体标本进行体外诊断研究的管理
剩余人体标本是指为常规临床护理或分析收集的,已完成其原本研究目将被丢弃的标本残留物,同时还包括来自标本库的标本或以前为其他无关研究收集的剩余标本等。FDA发布的指南表明[24],FDA将在某些情况下对符合规定的使用人体标本进行的体外诊断 (in vitro diagnosis, IVD) 研究执行强制性酌处权,但在开展研究前必须获得知情同意。如果使用的剩余标本存在以下情况,则不符合指南中实行强制酌处权的要求: (1) 能够鉴别身份,不是常规临床护理或分析收集的标本残留物; (2) 不是其他研究的剩余标本; (3) 研究所需要的标本数量远超过为常规临床分析收集的标本残留物数量; (4) 实验结果将告知受试者的医疗保健提供者。
4 、我国人类遗传资源的管理现状
4.1、 我国人类遗传资源管理工作起步较早,相关政策在不断完善
我国拥有56个民族,人口众多,历史悠久,人类遗传资源丰富。早在1998年就成立了中国人类遗传资源管理办公室 (以下简称“遗传办”) ,首次发布了《人类遗传资源管理暂行办法》 (以下简称《暂行办法》) (国办发[1998]36号) ,这是我国第一个全面管理人类遗传资源的规范性文件。2015年7月,科技部又发布了《人类遗传资源采集、收集、买卖、出口、出境审批行政许可事项服务指南》[25],对我国人类遗传资源采集、收集、出口出境行为的审批流程作进一步规范和完善,强化全过程监管与服务。2016年,最新的《人类遗传资源管理条例》 (送审稿) (以下简称《条例 (送审稿) 》) 出炉[26],国务院面向社会公开征求意见。《条例 (送审稿) 》保留了《暂行办法》中规定的基本原则和关于人类遗传资源国际合作与出境管理的主要规定,并强化了一些管理制度,加大了行政处罚的力度。2017年12月,科技部研究制定的利用我国人类遗传资源开展国际合作临床试验的优化审批流程正式实施[27]。这些管理制度和措施对于加强中国人类遗传资源的管理和保护,推进我国人类遗传资源研究,促进平等互利的国际科技合作和交流发挥了积极作用。
4.2、 正在积极推进人类遗传资源相关的基础设施建设
随着基因编辑技术的发展,各国对人类遗传资源“宝库”的争夺愈发激烈。目前,通过科技部“生物安全关键技术研发”重点专项的支持,国家已投入4 000余万元建设统一标准与规范的人类遗传资源样本库、共享网络与信息化平台,研究相应的标准规范、质量控制体系等[28]。中国科学院、华大基因等开展基因组学研究的重点单位也牵头建立了相应的基因组学原始序列归档库 (genome sequence archive, GSA) 、国家基因库生命大数据平台 (深圳) 等生物信息数据平台,目的是要解决以往我国科学家对国外相关数据资源的利用受到限制,以及我国科学研究的宝贵数据提交到国外在某种意义上带来的我国人类遗传资源外泄的问题。
4.3、 我国人类遗传资源管理存在的问题
尽管我国人类遗传资源的管理起步较早,但随着我国基因组技术的不断发展,国际合作不断增多,现有的管理机制不能满足对有效保护和利用的需求,主要存在以下3方面的问题。 (1) 监管效力位阶不够,管理细则不够明确。目前已有的最高级别管理规定是《人类遗传资源管理条例 (送审稿) 》 (以下简称《条例》) ,尚未出台正式的保护立法。《条例》虽然加强了对收集、保藏和研究利用我国人类遗传资源活动的行为规范和监督管理措施,但与美国的管理相比,在管理细则上还不足够明确,特别是在资源采集过程中的知情同意和惠益分享方面。 (2) 存在对不同类型的研究监管“一刀切”的问题。无论是对于药物临床研究,还是涉及基因分析及测序、特定地区人类资源采集的人类遗传资源研究开发活动,目前采取的是统一的管理方式,没有体现出对不同研究活动的监管重点和审批方式,应当分类施策。 (3) 遗传资源的管理和共享缺乏必要的标准和规范。目前我国生命科学研究人员主要依赖国际生物信息数据库提供的服务,我国资源保藏中的生物样本质量参差不齐,缺乏统一的标准和规范,阻碍了资源库之间的信息共享,达不到国际认可的研究质量标准。此外,在资源共享过程中涉及的伦理问题、商业化后的获益分享等问题,也缺乏明确的标准和规范。
5、 我国人类遗传资源管理的建议
5.1、 通过立法加大我国人类遗传资源保护效力
随着基因测序成本的降低和大数据、人工智能等技术的兴起,人类遗传资源不仅凸显学术价值、社会价值,更蕴含了巨大的经济价值,同时还关乎一个国家的生物安全问题。人类遗传资源境外组织攫取我国人类遗传资源的方式花样翻新、违规违法手段隐秘,我国人类遗传资源仍然面临流失风险。因此,需要加快立法进程,尽快正式出台《人类遗传资源管理条例》,明确细则和各方的法律责任,加大对违法行为的处罚和约束,并与现行相关法律做好衔接和协调,为我国的人类遗传资源提供切实有效的保护,减少带来生物安全风险的可能。
5.2、 推行人类遗传资源的全链条管理和分类管理
2015年3月,国务院审改办把依据《暂行办法》设定的原“涉及人类遗传资源的国际合作项目审批”行政许可名称和审批任务变更为“人类遗传资源采集、收集、买卖、出口、出境审批”,即体现出全链条管理的思路。当前违规事件屡禁难止,监管难度不断加大,一方面需要管理部门关口前移,在各个环节放下抓手,明确相应的部门职责和管理规范,建立起全链条、全方位的防线,把人类遗传资源的管理延伸到科研和生产的全链条当中,加强事中、事后监管;另一方面,对于不同类型的科技研发活动,需要在法律法规管理的范围内有不同的侧重和倾斜,优化审批流程,调动科研工作的积极性,实现监管和创新的平衡。
5.3、 通过标准建设和平台建设加强人类遗传资源的保护和利用
保护不是人类遗传资源管理的最终目的,只有将保护和开发利用有效结合起来,才能成为国家真正的战略资源。目前我国还没有建立起具有规模的、国家统一管理、国际认可的国家级资源平台,缺乏统一的数据共享标准和规范,因此,现有的生物数据资源无法整合,数据资源质量不高,不同研究对样本数据的共享意愿也不强,在一定程度上制约了资源的高效利用和开发。因此,我国应该加强总体布局,建立起国家级的资源战略保藏平台,重点做好样本和数据安全存储、标准化质控和数据共享的标准建设工作,为我国生物医学研究的科技创新提供资源保障。
参考文献
[1]刘抒悦, 高上知, 商瑾, 等.美国《健康保险携带和责任法案》中关于生物医学研究的规定及其影响.中国医学伦理学, 2016, 29:1011-4
[2]黎志敏, 蒋川, 王萍.刍议美国《2008年遗传信息反歧视法》及其启示.医学与哲学, 2015, 36:12-5
[3] Federal Government of the United States.Federal Regulations (Title 45:Public Welfare PART 46-PROTECTION OFHUMAN SUBJECTS 45 CFR 46) [EB/OL]. (2018-07-16) [2018-11-21].https://www.hhs.gov/ohrp/regulations-andpolicy/regulations/45-cfr-46/index.html#46.101
[4] Federal Government of the United States.Research on Transplantation of Fetal Tissue, Public Law:103-43[EB/OL]. (1993-06-10) [2018-11-21].https://www.hhs.gov/ohrp/regulations-and-policy/guidance/public-law-103-43/index.html
[5] HHS.Coded Private Information or Specimens Use in Research, Guidance (2008) [EB/OL]. (2008-10-16) [2018-11-21].https://www.hhs.gov/ohrp/regulations-and-policy/guidance/research-involving-coded-private-information/index.html
[6] HHS.Issues to Consider in the Research Use of Stored Data or Tissues (1996, 1997) [EB/OL]. (1997-11-07) [2018-11-21].https://www.hhs.gov/ohrp/regulations-andpolicy/guidance/issues-to-consider-in-use-of-stored-dataor-tissues/index.html
[7] Office for Human Research Protections.Department of Health and Human Services.Guidance for Investigators and Institutional Review Boards Regarding Research Involving Human Embryonic Stem Cells, Germ Cells and Cell-Derived Test Articles[EB/OL]. (2001-11-16) [2018-11-21].https://www.hhs.gov/ohrp/sites/default/files/ohrp/archive/references/HESCGuidance.pdf
[8] HHS.Standards for Privacy of Individually Identifiable Health Information, Final Rule[EB/OL]. (2000-12-28) [2018-12-29].https://www.hhs.gov/sites/default/files/ocr/privacy/hipaa/administrative/privacyrule/prdecember-2000all8parts.pdf
[9] HHS.Genetic Information Nondiscrimination Act Guidance (2009) [EB/OL]. (2009-03-24) [2018-11-21].https://www.hhs.gov/ohrp/regulations-and-policy/guidance/guidance-on-genetic-information-nondiscriminationact/index.html
[10] NIH.Final NIH Statement on Sharing Research Data[EB/OL]. (2003-02-26) [2018-11-21].https://grants.nih.gov/grants/guide/notice-files/NOT-OD-03-032.html
[11] NIH.Genomic Data Sharing (GDS) Policy[EB/OL]. (2018-04-06) [2018-11-21].https://osp.od.nih.gov/wpcontent/uploads/NIH_GDS_Policy.pdf
[12] NIH.NIH Guidelines for Research Involving Recombinant or Synthetic Nucleic Acid Molecules (NIH Guidelines) [EB/OL]. (2016-04-01) [2018-12-29].https://osp.od.nih.gov/wp-content/uploads/2013/06/NIH_Guidelines.pdf
[13] HHS.Issues to Consider in the Research Use of Stored Data or Tissues (1996, 1997) [EB/OL]. (1997-11-07) [2018-11-21].https://www.hhs.gov/ohrp/regulations-and-policy/guidance/issues-to-consider-in-use-of-stored-data-ortissues/index.html
[14] HHS.Genetic Information Nondiscrimination Act Guidance (2009) [EB/OL]. (2009-03-24) [2018-11-21].https://www.hhs.gov/ohrp/regulations-and-policy/guidance/guidanceon-genetic-information-nondiscrimination-act/index.html
[15] FDA.Regulation of Genetic Tests[EB/OL]. (2018-11-17) [2018-11-21].https://www.genome.gov/10002335/regulationof-genetic-tests/
[16] FDA.Points to Consider Regarding the Food and Drug Administration’s Investigational Device Exemption Regulations in the Context of Genomics Research[EB/OL]. (2017-07-27) [2018-11-21].https://www.genome.gov/pages/policyethics/genetictesting/final_ide_ptc.pdf
[17] NIH.Genomic Data Sharing (GDS) Policy[EB/OL]. (2018-04-06) [2018-11-21].https://osp.od.nih.gov/wpcontent/uploads/NIH_GDS_Policy.pdf
[18] HHS.Coded Private Information or Specimens Use in Research, Guidance (2008) [EB/OL]. (2018-10-16) [2018-12-28].https://www.hhs.gov/ohrp/regulations-and-policy/guidance/research-involving-coded-private-information/index.html
[19] HHS.Issues to Consider in the Research Use of Stored Data or Tissues (1996, 1997) [EB/OL]. (1997-05-21) [2018-12-28].https://www.hhs.gov/ohrp/regulations-andpolicy/guidance/issues-to-consider-in-use-of-stored-dataor-tissues/index.html
[20] NIH.Final NIH Statement on Sharing Research Data[EB/OL]. (2003-02-26) [2018-11-21].https://grants.nih.gov/grants/guide/notice-files/not-od-03-032.html
[21] Federal Register.NIH Best Practices for the Licensing of Genomic Inventions[EB/OL]. (2005-04-11) [2018-11-21].https://www.ott.nih.gov/sites/default/files/documents/pdfs/70fr18413.pdf
[22] NIH.NIH Grants Policy Statement[EB/OL]. (2018-10) [2018-11-21].https://grants.nih.gov/grants/policy/nihgps/nihgps.pdf
[23] NIH.NIH Guidelines for Research Involving Recombinant DNA Molecules, Appendix M[EB/OL]. (2016-04) [2018-12-28].https://osp.od.nih.gov/wp-content/uploads/NIH_Guidelines.html#_Toc446948489
[24] FDA.Informed Consent for In Vitro Diagnostic Device Studies Using Leftover Human Specimens That Are Not Individually Identifiable[EB/OL]. (2006-04-25) [2018-11-21].https://www.fda.gov/downloads/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/ucm071265.pdf
[25] 中华人民共和国科技部.关于发布《人类遗传资源采集、收集、买卖、出口、出境审批行政许可事项服务指南》的通知[EB/OL]. (2015-07-03) [2018-11-21].http://www.most.gov.cn/tztg/201507/t20150703_120547.htm
[26] 中华人民共和国国务院法制办公室.国务院法制办公室关于《人类遗传资源管理条例 (送审稿) 》公开征求意见的通知[EB/OL]. (2016-02-04) [2018-11-21].http://www.most.gov.cn/tztg/201602/t20160204_123997.htm
[27] 科技部办公厅.科技部办公厅关于优化人类遗传资源行政审批流程的通知[EB/OL]. (2017-10-26) [2018-11-21].http://www.most.gov.cn/mostinfo/xinxifenlei/fgzc/gfxwj/gfxwj2017/201710/t20171027_135781.htm
[28]苏月, 何蕊, 王跃, 等.加强我国人类遗传资源保护和利用.中华临床实验室管理电子杂志, 2017, 2:9-11





