摘 要: 丛枝菌根(AM)共生体系能够改善植物营养状况,增强植物对各种逆境胁迫的耐受性,其在农业和生态中的应用得到广泛关注。近年来,在AM真菌(AMF)应用技术和田间试验方面取得了许多重要成果,本文在介绍AMF种质资源库、商业化菌剂生产及相关专利申报情况的基础上,结合实例从菌剂生产、接种技术、接种效应影响因素等方面综述了AMF应用技术的理论与实践,包括国内外近年来菌根技术在农业、园艺、生态修复等方面的应用,最后提出尚待系统深入研究的 AMF应用领域中的关键科学和技术问题,旨在为菌根技术的发展和推广应用提供参考。
关键词: 丛枝菌根真菌; 菌根技术; 生物肥料; 接种; 根际管理; 可持续农业; 生态恢复;
Abstract: Arbuscular mycorrhizal (AM) symbiosis facilitates acquisition of mineral nutrients by plants and plays key roles in plant adaptation to various environmental stresses. The application of AM fungi has been recognized as a component of sustainable agriculture and ecological restoration. This paper introduced the current status of AM fungi collections, production of commercial inocula and AM fungi related patents, summarized the research advances in inoculum production, inoculation techniques, and factors influencing the success of inoculation practice in the field, based on case studies of mycorrhizal technology in agriculture, horticulture and ecological application. Finally, we proposed some basic scientific questions and technical bottleneck that deserve systematic studies, to promote advances in development and application of mycorrhizal technologies.
Keyword: arbuscular mycorrhizal fungi; mycorrhizal technology; bio-fertilizer; inoculation; rhizosphere management; sustainable agriculture; ecological restoration.;
农业生产中不合理地施用化肥、农药等化学品不仅造成资源浪费,还会带来一系列的生态环境问题。要在逐步减少化学产品使用的同时不影响农作物的产量和品质,微生物技术作为一种环境友好的可替代技术,在农业可持续发展中显示出巨大的应用潜力[1,2]。在农业生态系统中,微生物参与有机残体矿化和养分循环,在维持生态系统结构功能稳定和系统生产力方面具有不可替代的地位。有些微生物与植物建立共生体系,帮助植物吸收土壤养分,抵御各种逆境胁迫,从而促进植物生长,在农业生产中发挥着重要的积极作用。随着农业微生物基础科学和应用研究的发展,很多微生物产品包括微生物肥料、生物防治剂、生物修复剂、植物促生菌等被开发出来并广泛应用于农业生产[3,4]。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)作为广泛存在于陆地生态系统中的植物共生真菌,因其在植物适应各种逆境胁迫中的积极作用及重要生态功能而受到日益广泛的关注[5]。在漫长的进化过程中,AMF失去了降解有机物质的酶系[6],无法营腐生生长,与宿主植物之间形成了依赖于碳水化合物-矿质养分交换的专性共生体[7]。在菌根共生体系当中,植物将一部分碳水化合物分配给AMF支持其生长,作为回报,AMF根外菌丝帮助植物吸收土壤中的矿质养分,特别是在土壤中移动性较差的植物根系吸收相对困难的养分,如磷(P)、铜(Cu)、锌(Zn)等。AMF与大多数陆地植物,包括具有重要经济意义的农业栽培物种,可建立共生体系。很多研究证明,丛枝菌根(AM)不仅能够改善植物矿质营养,同时在增强植物抗旱性,防治土传病害和调节土壤结构等方面也具有重要作用[8,9]。正是由于AMF的广谱适应性和功能多面性,近年来菌根生物技术在农林业和生态工程中的应用得以快速发展。
菌根生物技术通常是指菌根真菌接种物(菌剂)的生产和应用,以解决目标栽培基质中菌根真菌丰度下降的问题。Rillig等[10]将“菌根技术”定义为:优化土壤中菌根真菌丰度和多样性的一系列技术措施,目的在于实现可持续的农业生态系统功能。根据这一概念,AMF菌株的分离、筛选和培养技术、菌剂量化生产及构建技术、田间接种技术,以及菌根侵染调控技术等均在“菌根技术”范畴之内。近年来,AMF应用研究取得了许多重要成果,本文在介绍AMF种质资源库、国内外AMF相关专利、商业化菌剂的基础上,结合实例从菌剂生产、应用方式、配套技术方面分析AMF应用技术研发现状与发展趋势,提出优良菌株表征、AMF生态适应性和功能有效性等AMF应用中的关键科学问题,旨在为相关研究者提供参考,从而全面推进菌根技术的发展和推广应用。

1 AMF种质资源库、相关专利和商业化应用
1.1 AMF种质资源库
AMF种质资源库是专门从事AMF种质资源收集、保藏并提供相关服务的单位,主要负责AMF菌种收集、鉴定、评价、保藏、供应及国内外交流等,为AMF研究提供基本研究材料。国际AMF种质资源库主要包括国际AMF保藏中心(INVAM)和欧洲AMF保藏库(BEG)等若干保藏机构(表1)。北京市农林科学院植物营养与资源研究所建有我国最大的AMF种质资源库(BGC),保藏5属25种共136株AMF,在国内菌根研究领域具有广泛影响[11]。
1.2 AMF专利
据中国国家专利局统计结果,截止到2017年,我国有关AMF的专利共517项,其中以发明专利为主,占95.4%,实用新型专利仅占4.6%。我国关于AMF研究和应用的专利申请始于1990年,但到2000年之后关于AMF的专利申请才逐年增加,研究日渐活跃。大多数专利来自科研院校和企业,技术领域主要分布于农业、林业、微生物学、肥料等(图1)。
高校和科研院所的专利主要集中在AMF培养体系、菌种筛选、菌剂生产方法及装置等基础性技术,以及矿区、盐碱地、干旱区等的植被恢复、固体废弃物处理及资源化利用,以及土壤修复中的菌根应用技术。公司申请的专利大多为含AMF的复合生物菌肥和土壤改良剂,以及各经济树种、花卉、设施蔬菜等高附加值农林植物菌根苗的培育与应用,表明菌根技术在这些领域有较高的推广应用价值。
在Web of science上以arbuscular mycorrhiza*为主题词搜索,得到412项被授权的与AMF研究和应用相关的专利,专利归属领域与国内基本一致,主要为农业和微生物技术应用。国外有不少企业在进行AMF相关技术产品的研发和应用,如出光兴产株式会社(日本)、拜耳知识产权股份有限公司等。通过国际专利合作条约(Patent Cooperation Treaty, PCT)可提出国际专利申请,获取PCT的140多个成员国的专利保护,也可以直接申请欧洲专利,受欧洲30多个成员国的技术保护。目前我国的PCT专利很少,大多专利只在国内有保护权。国内企业的专利与国外相比,数量和被引用次数上都处于落后地位,相关企业急需加大研发投入,高度重视知识产权保护,采用合适的专利申请及保护策略,从而提高自身的市场地位,增强核心技术竞争力。
1.3 AMF商业化应用
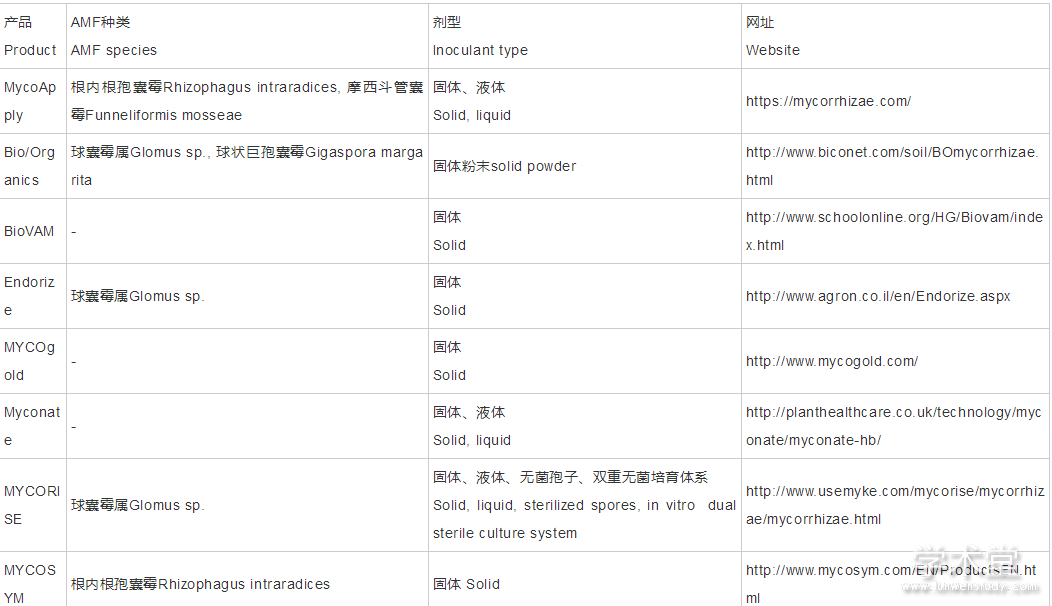
近年来,AMF商业化菌剂产品得到了快速发展,国际上很多AMF生产商都能提供固体、液体AMF菌剂,以及与其它微生物组配的混合菌剂,还可根据目标土壤和植物定制产品(表2)。目前我国也已分离获得了多个高效菌株,在AMF菌剂生产技术方面有一定积累,但由于市场需求有限,技术体系不成熟及缺乏投入,虽然尚未实现菌剂的大规模工厂化生产和广泛的商品化应用,但已有企业从事AMF相关产品的生产和销售,如北京市京圃园生物工程有限公司、淮安柴米河农业科技发展有限公司等。
表1 AMF种质资源库和保藏机构
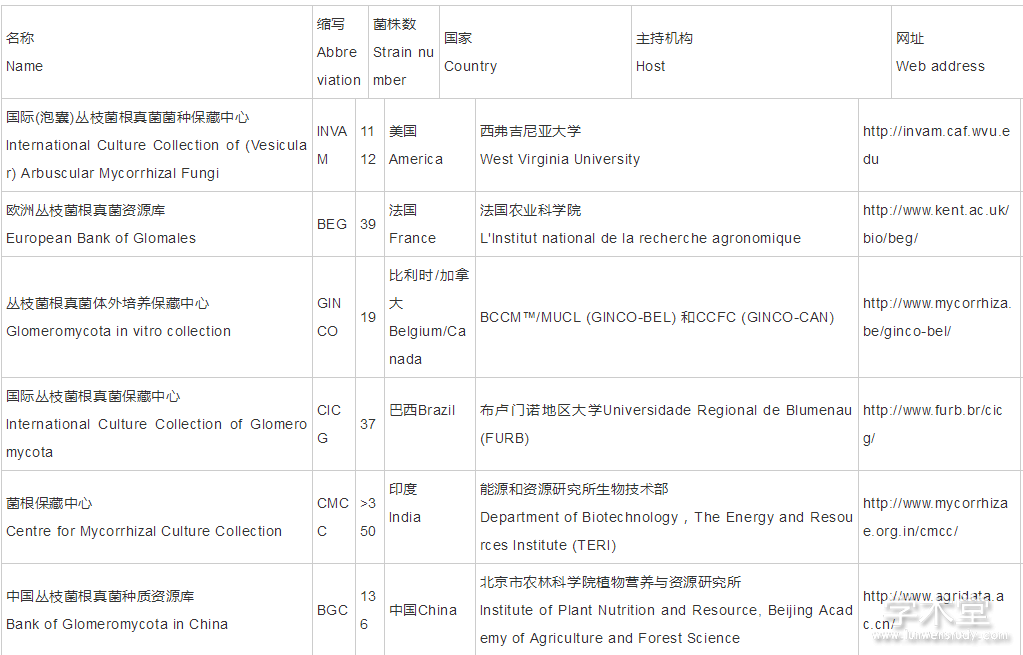
图1 我国AMF相关专利技术领域分布
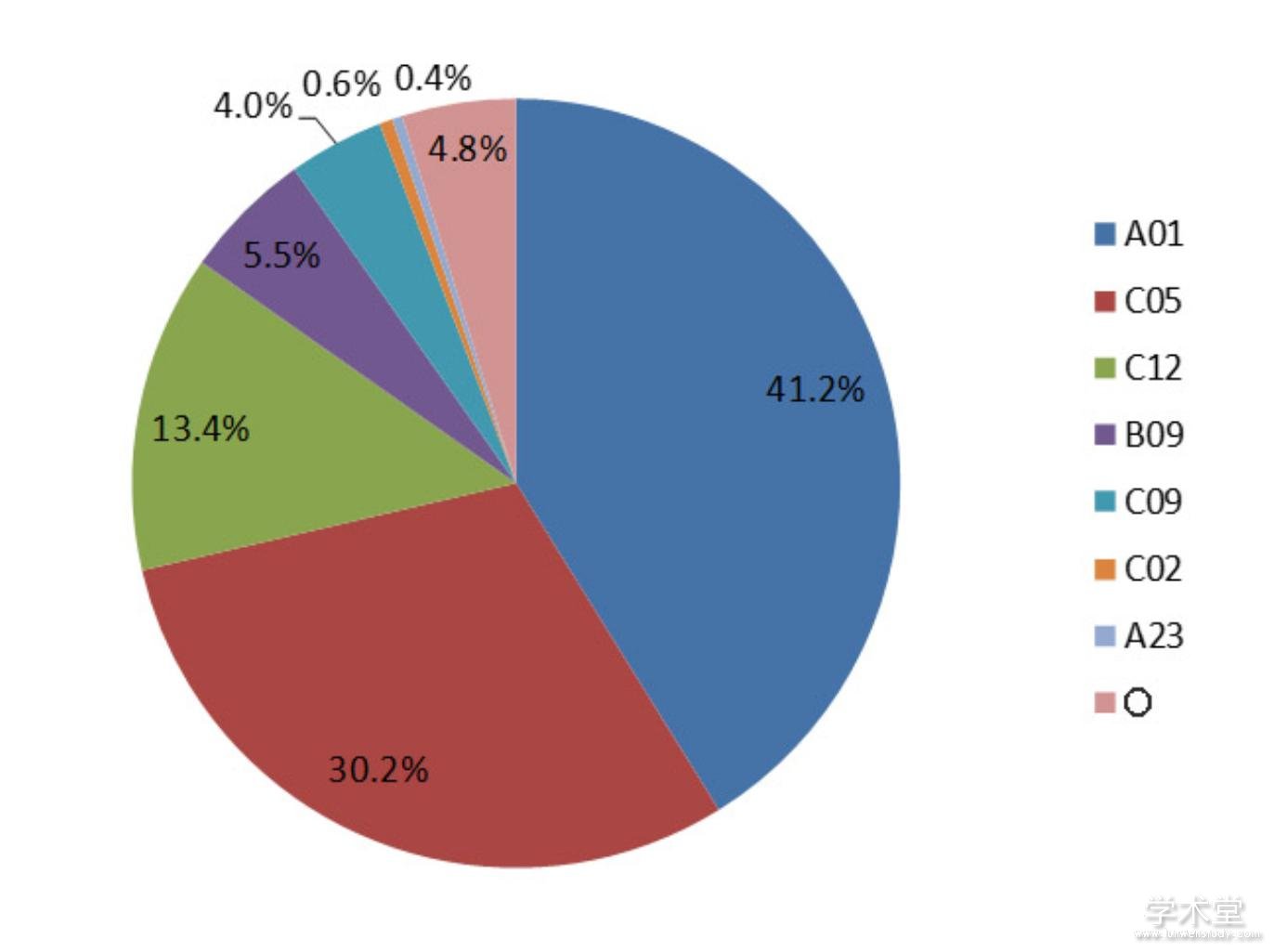
表2 代表性AMF商业菌剂产品及相关信息
2 AMF菌剂的生产及应用方式
2.1 AMF优良菌株的筛选
菌种分离筛选是AMF应用技术中的基础环节。一个优良的菌种需要有遗传上的稳定性,能有效侵染目标植物,改善植物的营养状况或品质;在与土着菌和病原菌等其它微生物的生存竞争中占优势,而且要具备适应或抵抗不利和极端环境的能力。
从自然土壤分离鉴定AMF种类时,通常采用湿筛倾析法[12]和蔗糖梯度离心法[13]从土壤中筛取孢子,在显微镜下观察孢子的颜色、大小、孢子壁、菌丝、孢子果等形态特征及孢子对特定试剂的显色反应,对照国际丛枝菌根真菌保藏中心(INVAM)数据库,对AMF孢子进行初步的形态学鉴定。随着分子生物学技术的不断发展,利用DNA体外扩增技术和特异性的分子标记,可在基因水平上更准确地鉴定AMF。筛选和鉴定不同环境下的AMF,为AMF基础和应用研究提供可靠的研究材料。
2.2 AMF菌剂生产体系
2.2.1盆栽培养法
AMF是专性活体营养真菌,盆栽培养法是获得AM菌剂的传统方法[14]。宿主植物种类、基质材料和营养状况、接种量、培养条件(光照、温湿度、氧含量)等都会影响AMF孢子的繁殖及菌剂质量。
培养AMF的宿主植物多选择一年生或多年生草本植物,如三叶草(Trifolium)、苜蓿(Medicago)、烟草(Nicotiana tabacum)、苏丹草(Sorghum sudanense)、玉米(Zea mays)、高粱(Sorghum bicolor)、葱(Allium fistulosum)等。培养基质也是AMF的载体,在AMF菌剂生产直至田间施用的整个过程中,为AMF提供了一个相对稳定的生长环境。通常选用具有疏松、保水、透气效果的混合材料,如石英砂、蛭石、珍珠岩、沸石、河沙和土壤等,基质的酸碱度一般控制在pH5~7之间,速效磷浓度以10 mg·kg-1左右为宜[11]。将植物栽种于灭菌基质中,接种目的AMF菌种,培养4~5个月,即可获得富含AMF孢子、菌丝、侵染根段的菌剂。此法生产周期长、易受污染、培养效率较低,但操作简单、成本低廉,到目前为止仍是最可靠、应用最广泛的菌剂培养方法。
2.2.2无土培养法
无土培养法获得的菌剂,菌物含量更高,也更易于收获。Crush和Hay[15]在已灭菌的培养液上放置装满沙子的网筛,种植白三叶草(Trifolium repens)并接种珠状巨孢囊霉(Gigaspora margarita),根系和根外菌丝在营养液中生长,收获的菌根和含有AMF菌丝体的营养液均可作为接种剂。流动营养液培养法、雾化营养液培养法、气培法、薄膜法等其它无土栽培技术也获得了成功[11] 。应用这些无土栽培方法可避免土壤微生物污染问题,营养液便于实时调控,还可通过浓缩技术减小菌剂体积,但需专业装置和科研人员,成本较高,并不是主要的菌剂生产手段。
2.2.3培养基培养法
Mosse[16]首先用摩西斗管囊霉(Funneliformis mosseae)[17]与红三叶草(Trifolium pratense)和番茄(Lycopersicon esculentum)离体根在培养基上成功地实现了AMF的繁殖。AMF和转移Ri T-DNA胡萝卜(Daucus carota)根双重无菌培养体系也可以在有限的空间内获得高浓度高质量的AMF孢子[18]。培养基法获得的AM菌剂纯度和浓度高,可常年在实验室环境下培养,然而菌剂保质期短,产量有限,需专业设备、实验室、技术人员,成本昂贵,目前主要应用于科学研究。
2.2.4大田培养法
大田培养法是生产AM菌剂成本最低的方法,生产上可快速获取大量菌剂。一般选用沙壤土,将宿主植物种子和AM菌剂一起播种到土壤中,待植物的生长期结束后,收集根系和土壤,即可作为菌剂使用[19]。若当地土壤所含AMF孢子和杂草较少,可直接使用;若本身含有孢子数较多,则需土壤灭菌后再进行AMF培养;也可作为AMF富集培养方法,获得土着AMF菌种。大田培养法简单、成本低,在获得目的菌剂的同时,还伴生有土着AMF和细菌等微生物,增加了AMF的本土适应性。然而,这种方法培养的AMF孢子不易收集,菌剂生产过程中易受外界环境因素影响,还容易受病原菌、虫害、杂草的污染和干扰。菌剂不够纯净,质量不高,同时培养周期较长,一般一年只能繁育一代。
2.3 AMF菌剂构建
AMF的繁殖体通常包括孢子、菌丝、侵染的植物根段,或三者的混合物[18]。目前科学研究及农业生产中,大多使用这种混合物作为菌剂,其比例达68%;使用AMF孢子的有14%[20]。根据AMF附着载体性质的不同,可将AMF菌剂分为固体菌剂和液体菌剂两大类[21]。
固体菌剂是以土壤-沙子及一定比例的添加物如泥炭、蛭石、珍珠岩等混合物为AMF繁殖体载体制成的菌剂,一般为粉状或颗粒状,是目前农业和生态上使用最广泛的菌剂类型[22]。胶囊菌剂以聚丙烯酰胺或海藻酸盐为载体,将目的AMF菌种繁殖体及生物添加剂(如营养元素、植物激素、黄酮类物质等)包埋其中,制成胶囊[23],其缓释性好,含菌量大,可与植物新生根系直接接触,提高接种成功率。固体菌剂使用方便,可针对不同的应用需求添加不同的物质,对环境有较强的缓冲力,保质期长,便于运输和储存,但施用量通常较大,运输成本高,不利于大面积推广。此外,载体成分较复杂,长期使用会对土壤造成一定的负担。
液体菌剂一般以液体如植物油、水及合成有机聚合物等为AMF繁殖体载体,其成分明确、可控。液体菌剂可以制成浓缩液,菌剂纯度高、使用剂量小,降低了运输成本,但液体基质易被微生物污染,其生产、保存、施用都较其它菌剂类型更为严格,通常需低温保藏。此外,液体菌剂对环境的变化更敏感,施用后无法像固体菌剂一样对AMF形成有效的保护,因此在农业和生态中的应用受到了很大的限制[24]。
包衣化技术在AM菌剂生产上也有一定应用,将泥炭、二氧化硅等基质磨碎及无菌化处理后加入AMF,在包衣粘合剂作用下与植物种子进行包衣化处理,按常规播种方式即可对植物进行接种[23]。由于技术要求较高,目前AMF包衣化技术尚少见报道。
低劣的菌剂会降低应用效果,使AMF技术在大面积推广时难上加难。总体上,优良的AMF菌剂应该包括以下特质:对AMF菌群有一个保护性的载体,可提供适宜的pH、水分条件,使其在一定时间内能保持最佳的活性,保质期长,在储存、运输和施用后能防止AMF繁殖体的减少;施用方便,对环境无负担,材料价廉易得,便于灭菌,同时质量轻、体积小,易于运输。在生产中,各种菌剂类型各有特点,要找到一种载体可以满足以上所有条件还比较困难,选择时应考虑就地取材,可降低成本,否则难以推广。例如Rasoamampionona等[25]在马达加斯加利用火山灰来培养AMF,获得良好效果。此外,独脚金内酯等植物激素类物质对AMF和植物的生长均有促进作用,可以作为一种刺激剂帮助建立菌根共生体系,也可以激发土着AMF对植物的侵染[26,27],因而在AMF菌剂中可考虑加入适宜含量的植物激素类物质。
2.4 AMF接种方式
目前,不少国际公司都开始研发生产AMF菌剂,并在农业、园林等领域推广应用。目前AMF菌剂主要用于植物育苗(如草莓Fragaria × ananassa 、西瓜Citrullus lanatus、甜瓜Cucumis melo、芦笋Asparagus officinalis、番茄Lycopersicon esculentum、花卉等)、苗木移栽、土壤修复等方面。园艺作物通常需要育苗,因此可在培养钵或苗床育苗时接种AMF菌剂;组培苗可在植物生根后直接给幼苗根系接种。缺肥少水的山区旱薄地、缺磷少氮的大田、矿区复垦地、各种消毒后的土壤等最适合AMF的应用。大田播种时,可对种子进行菌剂丸衣化、菌剂拌种或条播、沟施AMF菌肥,或通过菌根化育苗移栽的方法进行AMF接种。
对于粉状及颗粒状菌剂,可采用撒施、沟施或穴施的方式对植物进行接种。一般将一定量的菌剂、植物种子及生长基质混匀后施入土壤,也可以先底施菌剂后播种。固体菌剂加入水及乳化剂等可制成含AMF繁殖体的乳浊液,对植物种子、根系、扦插枝条进行浸泡及蘸根处理[28]。液体菌剂的接种方式多样,可在植物进行移栽时对植物根系进行浸泡处理;对于有灌溉条件的地方,还可将一定浓度的液体菌剂溶于灌溉水中对根系进行接种,此法适用于大面积农田作物的接种[23];利用分子手段研究发现,注射的AMF菌剂也能够成功侵染植物根系[29]。
3 AMF技术在农业、园艺、生态中的应用
3.1 AMF技术在农业中的应用
大多数农作物都对AMF表现出一定的菌根依赖性。AMF可以促进作物对土壤养分的吸收,在促进作物生长和提高农作物产量的同时,提高肥料的利用效率,减少肥料用量,有利于维持农业可持续发展。目前国际上已有研究机构和公司能够大规模生产AMF菌剂[23]。在实际应用中,选择菌根依赖性强、经济价值高的作物进行菌根生物技术的应用推广,具有巨大的生态和经济效益。
很多研究表明,接种AMF可提高玉米、小麦(Triticum aestivum)、大豆(Glycine max)等主要粮食作物的产量,改善作物营养状况,增强作物对干旱、盐碱等逆境胁迫的抗性[30,31]。使用商业菌剂MYKE?PROSG2(加拿大)对玉米进行接种,发现在土着AMF存在的情况下仍能提高宿主植物P含量[32]。AMF和化肥共施能够改善稻谷的品质,并提高稻米中铁(Fe)和锌(Zn)含量[33]。Ceballos[28]使用异形根孢囊霉(Rhizophagus irregularis)接种热带地区重要粮食作物木薯(Manihot esculenta),大幅度提高了其产量,每株木薯接种2500个孢子,即可兼顾AMF接种的有效性和经济性。
3.2 AMF技术在园艺中的应用
大多数园艺作物都可以与AMF形成共生体系,如茄科、葱科、大多数果树、草本香料、中草药、观赏花卉等。园艺作物经济价值较高,且习惯于采用苗圃和容器育苗,这就为植物苗期菌根化提供了便利条件。菌根接种后,可以缩短苗木的出圃期,提高移栽成活率、促进苗木生长、增强抗病性,最终提高产品产量和品质,增加园艺作物的经济附加值,以较小的投资获得较大的收益。
在施肥量减半的前提下,Ziane等[34]采用商业菌剂Symbivit?(法国)及土着菌剂摩西斗管囊霉和缩隔球囊霉(Septoglomus constrictum)对番茄进行接种,可提高植物生物量,并达到未接菌100%施肥量的效果。通过对果树、蔬菜等园艺作物接种,在提高产量的同时,还可提高果蔬品质,如对黄瓜(Cucumis sativus)接种变形球囊霉(Glomus trufemii),在提高单果质量和单株总产量的同时,果实中可溶性蛋白和Vc含量显着提高[35]。AMF还能促进草本香料和药用植物次级代谢产物和活性物质的生成,如对鼠尾草(Salvia japonica)接种商业菌剂和黏质隔球囊霉(Septoglomus viscosum),植物的精油含量和质量都有明显提高,泪杉醇(一种新型生物性农药的重要成分)占比增加[36]。Xie等[37]对乌拉尔甘草(Glycyrrhiza uralensis)接种AMF发现,根系中甘草酸和甘草苷的含量显着增加。在干旱、盐碱等不利条件下,菌根植物有更强的适应性,体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、愈创素过氧化物酶(GPOX)等抗氧化酶活性明显提高,可减缓植物的氧化损伤,使植物面临水分亏缺时有更强的抵抗力[38,39]。选择合适的AMF对植物进行接种,不仅可以促进植物对磷(P)的吸收,还可以提高植物中锌(Zn)、铜(Cu)、锰(Mn)等微量元素含量[40,41]。因此,菌根生物技术可实质性地减少化肥和农药的使用,避免水果和蔬菜产品的农药残留问题,同时提高果蔬品质。在国际上,果树及花卉生产中将AMF作为生物防护剂、生物促进剂、生物肥料已得到较为广泛的应用。
3.3AMF技术在环境修复中的应用
3.3.1 矿区复垦
矿区采矿活动之后废弃的土地,通常土壤结构不良、有机质及矿质养分含量低,植物生长受到限制。AMF自身的生理生态特性使菌根技术有可能成为克服矿区生态重建中障碍因素的有效途径。废弃或退化土地一般植被覆盖率低,AMF多样性和丰度也较低,引入AMF接种物,或通过种植菌根依赖性强的物种进行AMF的富集,可改善当地土壤中AMF含量低的状况,从而发挥AMF的生态功能。
在内蒙古草原对当地优势种羊草接种AMF,在灭菌土壤中接种处理能显着增加羊草生物量和养分含量,提高牧草品质[42]。AMF还可以改善采煤塌陷地土壤根际酶活,尤其是磷酸酶活性[43],改善土壤根际微生态环境。Bi等[44]估算利用菌根技术对矿区进行复垦,每公顷土地可节约2.5万元,极大地降低了复垦费用。
3.3.2重金属污染土壤修复
很多研究表明,AMF能够增强植物对各种重金属污染胁迫的抗性,促进植物在重金属污染环境中的存活和生长。一方面,重金属毒害导致植物根系生长受阻,植物难以通过根系吸收获取矿质养分和水分,而AMF能够通过根外菌丝促进植物对矿质养分的吸收,从而改善植物矿质营养促进植物生长,提高植物的生物量,由此也会稀释植物体内的重金属,减轻重金属植物毒害[45,46,47]。另一方面,AMF菌丝体可以有效吸附固持重金属,通过菌丝中结合重金属的位点,将重金属积聚在真菌体内[48]。陈保冬等[49]发现,AMF的菌丝体可以吸附相当于自身干物质质量1.6%、2.8%、13.3% 的Mn、Zn、镉(Cd),而其本身可以通过“躲避机制”在重金属胁迫条件下生存。AMF对重金属的有效固持,可以影响植物体内重金属的分配,总体上降低重金属自根系向地上部的转运[33,45,50],这也是AMF保护宿主植物免受重金属毒害的重要机制。对于某些能够发生价态和形态转化的重金属而言,比如砷(As)和铬(Cr),AMF也能通过影响重金属形态转化减轻重金属植物毒害。基于同步辐射光源的X射线近边吸收精细结构(XAFS)技术分析发现,丛枝菌根真菌能够将高毒的Cr(VI)还原成毒性较低的Cr(III)[51],并通过上调高亲和力硫酸盐转运蛋白基因的表达,促进植物对S的吸收,从而增强植物对Cr(Ⅵ)的解毒能力[52]。Zhang等[33,53]研究发现,被AMF侵染的蒺藜苜蓿(Medicago truncatula)地上部和水稻(Oryza sativa)籽粒中出现了二甲基砷(DMA)。此外,AMF能够分泌有机酸、球囊霉素等物质,从而改变根际土壤pH、氧化还原电势等土壤理化性质,进而影响土壤中重金属的生物有效性,如Spagnoletti等[54]研究发现,AMF很可能通过向土壤中分泌更多的球囊霉素从而抑制植物对砷的吸收,球囊霉素固持并隔离了铅(Pb)、Cu、Zn、As等重金属,降低了重金属对植株的毒害[55]。
AMF多方面影响植物对重金属的吸收累积,能够有效增强植物对污染环境的适应性,因而其在重金属污染土壤生态恢复方面具有广阔的应用前景。对于需要重建植被的矿区退化土壤,应用AMF可以快速建立具有物种多样性和结构稳定性的植被;对于轻度污染的农田,可以通过AM共生体系阻控重金属向作物地上部或是籽粒中的累积,维持农业生产并保障食品安全,此外也可以联合重金属超积累植物对污染农田进行生物修复。
4 AMF应用的影响因素和适用条件
农业生产中通过对作物接种外源AMF不仅可以提高作物对营养元素吸收,尤其是氮素(N)、磷素(P),还可以改良土壤结构、增强植物抗逆性、抑制农作物病虫害的发生等。研究发现,农业管理方式会影响土壤中的AMF群落结构[56],种植强度、耕作方式、化肥施用均会对AMF丰度产生影响。农业土壤中AMF多样性较低,真菌种类单一,通常以几种优势种为主。外源接种可以一定程度上改变土壤AMF的群落结构,配合适当的田间管理措施,如调整化肥施用制度、合理灌溉、减少休耕、种植AMF依赖型强的植物以及轮作等措施,可提高土壤AMF丰度和多度。总体上,AMF数量稀少群落结构较为单一的土壤类型是理想的目标土壤,如频繁耕作、贫瘠土壤、矿区复垦地及各种消毒处理后的土壤[1],接种AMF效应通常较为明显。
4.1 宿主类型和AMF种类
外源AMF是否能够成功侵染宿主植物根系并建立共生关系是由多个因素决定的,其中宿主植物和AMF种类是最重要的因素。在进行AMF接种时选择菌根依赖性强的宿主植物(如豆科植物)更易接种成功[57]。相反,种植非菌根植物会降低土壤中的AM繁殖体。田间施用AMF菌剂时,一定要注意耕地前茬作物的种植情况,因地制宜。
接种AMF时常选用对宿主植物不具有专一性且容易侵染植物根系的AMF种类,如根内根孢囊霉、摩西斗管囊霉和异形根孢囊霉等[58]。考虑到不同AMF菌株对土壤的适应性差异,目前大田土壤接种一般选用含多种AMF的混合菌剂进行接种,一些菌剂生产商还会选择多种微生物的组合来扩大菌剂的适用范围,比如AMF和根瘤菌、解磷细菌组合,但复合菌剂生产成本及技术要求较高,大规模应用菌剂也受到一定限制。
4.2 土地利用方式
土壤耕作通常会破坏菌丝网络,从而直接损伤或杀死AMF,同时间接改变土壤环境,影响AMF的多样性和群落分布,对AMF产生不利影响。彻底翻耕会显着减少AMF孢子及其它繁殖体数量[59],故翻耕后再接种会降低土着AMF的丰度,增加外源AMF的竞争优势;而接种后再进行翻耕虽有利于接种菌剂的扩散却会降低接种成功率[56]。轮作通常会增强AMF的数量和多样性,轮作形式越多元化,越有利于提高AMF多样性和丰度[60]。
4.3 管理措施
灌溉方式影响AMF的接种效应,浇水量提高会降低AMF的侵染率和对植物的促生作用,适度干旱则会强化AMF对植物的促生效应。施用化肥会在短期内大大提高土壤中的营养元素(尤其是N、P)含量,但这对AMF侵染植株是不利的,因此施用AMF菌剂时,不宜大量施用化肥,更不能简单地将两者混合施用。AMF作为一种环境友好的生物肥料,能够促进植物吸收土壤养分,降低作物生产对化肥的依赖。对于自身较为肥沃或大量施肥导致养分含量很高的土壤,一般也不推荐施用AMF菌剂。一般来说,使用有机肥或者缓释型肥料对AMF的效应有促进作用[4],但有机肥种类众多,需根据实际情况甄选使用,且不能过量,同时还要注意有机肥料中的病原菌、重金属、酸碱度等问题。在农业生产中常用杀虫剂、杀菌剂控制病虫害,这些化学物质多数对AMF来说都是有害的。除草剂在消灭杂草的同时,也会降低土壤中AMF的数量和多样性。因此,施用AMF后的土壤,应避免使用化学类的杀虫剂、杀菌剂和除草剂,尽量使用物理方法或选择生物友好型的产品,降低对AMF的毒害作用。AMF菌剂必须与专业的土壤管理模式配套使用,才能充分发挥其作用。
5 菌根应用技术研发涉及的关键科学问题
5.1 土着菌
AMF生态适应性强,从北极到南极陆地上各类生态系统中都有发现[61]。土着AMF长期自然存在于土壤中,已适应当地土壤的生态条件,具有生存优势。Labidi等[62]对地中海牧草岩黄耆(Hedysarum coronarium)接种商业菌剂和土着菌剂,发现土着AMF对植物的促生作用更显着,并提高了土壤中的磷酸酶活性,因而在菌根应用中应优先考虑土着AM菌种。通过种植菌根植物,同时配合相应的土地管理措施,如减少化肥、农药的施用,使用有机或缓释型肥料,可实现对土着AMF的富集,在提高土着AMF有效性的同时,还可降低成本,易于农民接受,实现土壤的可持续利用。此外,如前所述,独脚金内酯等植物激素类物质可作为一种刺激剂激发土着AMF对植物的侵染[26]。
5.2 外源AMF菌种的生存力、竞争力及长效跟踪监测
微生物进入土壤中的先后顺序即优先效应会影响土壤中最终的微生物群落组成[63]。农业土壤由于长期人为管理,土着AMF种类单一且丰度较高,已建立起稳定的群落结构。因此,外源AMF进入土壤后可能会与土着AMF产生强烈竞争作用导致接种失败[56]。长期撂荒且缺少植物生长或是土壤肥沃的土壤对AMF的承载力较低,外源AMF也不易接种成功。大田应用时,筛选高效的AMF应用于大田生产是非常必要的,不同生境下,应采用不同的AMF菌剂。植物菌根化后再移栽到大田土壤环境中,有利于菌根的形成和发育[64,65]。同时,提高AMF的接种量并提高AM繁殖体与根系直接接触的机率,可促进菌丝体对植物根系的侵染,也有利于外源AMF与土着AMF的竞争。
Pellegrino 等[66]开展的田间原位研究观测到作物产量增加与AMF侵染强度相关,外源接种的菌根共生体系能够保持2年。传统的染色方法难以验证和定量描述外源接种的AMF和目标作物共生状况,尽管细胞核核糖体DNA(nrDNA)的实时定量PCR正在成为定量测定AMF生物量的有效工具,但针对该基因组区域仍难以对不同AMF基因型进行特异性扩增。Krak等[29]基于线粒体DNA(mtDNA)的大亚基针对根内根孢囊霉两个生态型设计了定量PCR体系,并准确描述了二者在苜蓿根中的共存和竞争状况。当前高通量测序技术提供了更强大、灵敏和定量的方法,有可能用于监测接种的AMF的时间和空间动态,分析外源AMF是否受到土着AMF群落的影响[67]。此外,稳定同位素探针技术(stable isotope probing,SIP)可以标记并追踪13C在特定微生物群落中的流动过程,有可能实现对AMF的长效跟踪监测[68]。
5.3 逆境胁迫程度和植物的菌根依赖性
AMF必需在一定的环境条件下才能与植物形成菌根共生结构,最大程度地发挥效用。很多研究表明,高营养水平抑制AMF的侵染。植物会根据环境中养分的供应水平调节AMF对自身的侵染,土壤养分含量高时,侵染率低;土壤养分含量低时,侵染率相对较高。土壤有效P水平是主要影响因素,在高P条件下,植物根系吸收的P素即可满足自身生长的需要,菌根侵染率会降低。过量施用P肥,还会降低植物根系光合产物的分配量,使菌丝完全成为消耗光合产物的消费者[69],植物根系可能会分泌某种物质抑制AMF的侵染。然而,当环境中的其它养分如N素水平很低时,可能削弱由高P产生的不利影响。中等施N水平下,AMF能发挥最大作用,番茄的产量最高[70]。
菌根共生体的建立和发育受到环境因子、养分状况等多种因素的影响。在一定范围内,环境胁迫越严重,植物对菌根的依赖性越强。当然,逆境胁迫程度和植物菌根依赖性之间并不会是一种简单的直线相关关系,极端环境胁迫可能导致植物和AMF都无法适应生存。关于逆境胁迫程度和植物的菌根依赖性之间的关系及其普适性,还需要更为系统的研究。
5.4 “超级菌”
一些AM真菌物种具有非常广的地理分布范围和较低的环境特异性。通过对源自六大洲的摩西斗管囊霉的82个分离株的3个基因测序分析,研究其地理分布、区系特点及其与大陆板块迁移的时序,结果表明,在不同大陆均能发现相同的摩西斗管囊霉基因型,证实该AMF种缺乏明显的地理分布规律,AMF物种的形成和扩张比地球板块分离要晚,而人类活动可能对真菌的分散和种群结构有重大影响[58]。根内根孢囊霉(Rhizophagus intraradices)、摩西斗管囊霉和异形根孢囊霉等AMF对宿主植物没有明显的专一性,容易侵染植物根系形成较高的侵染率,同时对植物的促生效应通常较为显着,因而也被称为“超级菌”,意指那些适用范围广泛且应用效果良好的菌株。然而,在实际应用中还是不能忽视不同AMF菌株对土壤的适应性差异,根据植物类型、生境类型灵活选择适用的AMF菌种。
大田接种一般选用AMF的混合菌剂以拓宽菌剂适用范围,但混合接种相对减少了单一AMF菌株的繁殖体数量,同时提高了低效应的AMF孢子密度和侵染率,可能造成不同AMF菌株之间的竞争作用,故混合接种AMF时需要考虑菌种组成的种类及相对比例[20]。一些菌剂生产商还会选择AMF和根瘤菌、解磷细菌等有益微生物的组合来提高菌剂的有效性,但对于混合菌剂产品的应用效果,研究结果不一。Malusa等[18]认为混合菌剂的效果优于单一菌剂,但是Herridge等[71]认为混合菌剂的效果并不优于单一菌种,且它们的生产和商业化面临着一系列的技术难题。
5.5 优良菌株表征——多重抗逆假说
AMF不仅可以促进植物对矿质养分的吸收,还可以增强植物对盐碱、干旱、病害、重金属污染的抵抗能力[72]。AMF能够改善植物的养分状况,调节植物激素平衡,改善植物根际土壤微环境,这是AMF增强植物抗逆性的重要基础。植物自身有磷吸收通道,AMF也有磷酸转运基因,并可以诱导植物产生特异磷酸转运基因[73],从而促进植物对P的吸收。干旱胁迫下,接种AMF的高粱(Sorghum bicolor)地上部磷含量比未接种植株增加了近一倍[74]。Zhang等[33]也认为菌根植物对P的吸收是缓解重金属Cd毒害的一个重要机制。在严重As污染土壤中,菌根植物体内P浓度较不接种植株高2倍,而As浓度降低,菌根植株体内P/As比例提高,AM对P和As的选择性吸收可能在增强植物耐As能力发面起到关键作用[45]。另一方面,AMF中通常含有较高的磷酸盐含量,这些磷酸基团可能提供了重金属结合位点,这对于将重金属固持于真菌结构,阻滞重金属由根系向地上部转移,从而减轻重金属植物毒害具有重要作用[50]。由此,具有较高的P吸收效率的AM共生体系,往往也具有更强的重金属抗性,同时也可能对其它逆境胁迫具有更强的抗性。我们有可能将AMF吸收P的能力作为筛选优良AMF菌株的关键指标,这些优良的AMF菌株往往具有“多重抗逆”能力。
AMF对磷的吸收能力可能受到多种因素的影响,包括宿主植物种类、土壤环境和AMF种类等。从AMF自身特性来看,影响磷的活化、吸收、转运与传输过程的相关生物学特征都会影响到磷的吸收能力:菌丝分泌H+和酸酶的能力会影响土壤磷的活化;根外菌丝密度和磷酸盐转运蛋白类型和数量决定了磷的吸收能力;侵染率、根外根内菌丝的连通性、聚磷酸盐合成等很大程度上影响到磷的转运;丛枝数量和共生界面磷转运蛋白数量决定了磷自AMF植物的传输效率[33,45,74]。总体上,菌根共生结构,尤其是根外菌丝密度和根内丛枝着生率可能是影响AM共生体系磷营养效率的关键指征,可以作为筛选优良AMF菌株的重要指标。发达的菌根共生结构可能意味着较高的菌根侵染率,而高的菌根侵染率和植物生长响应并非简单的直线相关关系。这一点也很容易理解,在特定条件下筛选出的优良菌株,并不能在任何条件下都能对植物表现出促生效应,还必需考虑植物种类和土壤环境条件的影响。针对不同的应用范围和目标,应该在基础生理指标的基础上,综合考虑AMF特殊的生理特性,比如筛选应用于污染土壤修复的AMF,应充分考虑AMF对污染环境的适应能力。
AM共生体系对于植物的益处,也并非仅仅帮助植物吸收矿质养分。例如,AMF通过促进植株体内抗病原菌防御体系的形成,可以降低植物的发病率和病情指数[75]。此外,AMF还可以诱导植物形态、生理生化、基因表达等方面发生变化,改善植物根际微环境,从而对植食性昆虫产生影响[76,77]。AMF对病原菌和植食性昆虫的拮抗作用各异,在筛选生防菌种时,还需严格的测试与评价。
6 结论与展望
菌根技术的发展离不开基础研究的支撑,如前所述,菌根应用技术涉及的相关基础科学问题包括:1)优良AMF菌株是否具有多重抗逆能力?甄别优良菌株的关键指标是什么?2)外源菌种的生存力和竞争力及其关键影响因素?3)逆境胁迫程度和植物菌根依赖性的关系?4)AMF多样性和功能之间有什么关系?“超级菌”和混合菌群(土着菌群)孰优孰劣?这些科学问题都值得进一步系统深入地研究。企业应扩大AMF的生产效率,提高菌剂质量,降低菌剂成本,建立可持续的市场经济链。农民要提高生态文明建设的意识,减少化肥使用,当然关键还在于AMF菌肥能够使农民获得更大的经济效益。各方互相协作,共同努力,推进AMF技术在更大范围内的应用,助力生态文明建设。
为了全面推进菌根技术的发展和广泛应用,今后应着重考虑的技术研发方向包括:1)适用于不同应用范围的优良菌种(株)筛选指标体系;2)结合生产实际,研发不同菌剂产品以适应不同的应用情形,如基于菌根真菌菌剂研发生物有机肥、土壤调理剂和育苗基质等;3)不同AMF以及AMF和其它有益微生物制剂复混和量产技术;4)研发针对不同作物,如大田作物、花卉、蔬菜和药用植物的专门配套接种技术;5)菌根技术的适用条件和范围的界定,如适用作物种类和适宜的土壤、气候条件;适用生产体系,如有机农业、高附加值种植业等;6)土着菌根真菌效应激发技术,如促进菌根共生的信号物质、调节因子等;7)菌根技术配套管理技术,特别是水肥管理需要形成配套技术体系,否则菌根技术的优势无从发挥,甚或被掩盖。
菌根技术的应用还存在着一些瓶颈:1)AMF的纯培养技术还有待进一步突破。受限于AMF基础生物学研究进展,目前仍不能通过发酵技术获得高产量高品质的菌剂,传统的与宿主植物联合扩繁方法仅能暂时满足科研的需要,与大规模田间应用的需求还相差甚远,更难以进行分子水平上的遗传改造。相关科研单位应与企业加强合作,共同探索如何提高菌剂质量和生产效率,降低产品成本,建立可持续的市场经济链。2)很多AMF菌剂和产品在环境受控试验中表现优异,但在大田应用的复杂环境中,其有效性受到很大影响,这种应用效果的不稳定性是导致AMF生物制剂无法大规模应用的最主要瓶颈之一。单一的技术往往都难以解决复杂的实际问题,菌根技术的研发应该更紧密地结合实际问题,努力的方向是建立起菌根应用技术体系,包括菌剂(复合产品)生产、适宜性评估、接种技术和管理配套一整套技术,而不是简单地提供单一的产品或技术。如果不能切实保障菌剂产品的实际应用效果和效益,菌根技术的研发、应用与推广都很难向前推进。3)公众对菌根技术的认识度和接受度还非常低,需要大力地进行科学普及和推广。不恰当的使用方式降低了AMF菌剂的应用效果,也大大降低了基层工作者和农户的热情。AMF菌剂价格相对较昂贵,更使其在大面积推广时遇到阻碍。政府和相关部门若对菌根技术实施一定的价格补贴和技术支持,能够扶持和促进相关产业的快速发展。4)目前尚未出台关于AMF菌剂的质量标准和施用规程,现行的微生物肥料标准也只是规定了含菌量,且各国的标准不一,低劣的菌剂降低了菌根技术的应用效果。因此,AMF技术要想在农业、园艺、生态修复中发挥更大的作用,还有赖于政府部门、科研单位、企业、基层工作人员的共同努力。据预测,全球人口到2050年将超过90亿[78],全球面临严峻的资源危机和环境危机。菌根技术是一种环境友好型的生物技术,使用AMF作为生物肥料应用于农业和园艺中,可以有效地提高农产品的产量和品质,增加农民的收入,同时降低化肥、农药的使用量,减少对环境的污染。在生态环境领域,菌根技术也可以应用于退化生态系统和污染环境的修复和治理。可以预期,在资源和环境问题日益严峻的大背景下,菌根技术必然有着更为广阔的发展空间和应用前景。
参考文献:
[1] Wagg C, Bender SF, Widmer F, et al. Soil biodiversity and soil community composition determine ecosystem multifunctionality. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(14): 5266-5270
[2] Bender SF, Wagg C, van der Heijden MGA. An underground revolution: biodiversity and soil ecological engineering for agricultural sustainability. Trends in Ecology and Evolution, 2016, 31(6): 440-452
[3] Kuhn G, Hijri M, Sanders IR. Evidence for the evolution of multiple genomes in arbuscular mycorrhizal fungi. Nature, 2001, 414(6865): 745-748
[4] Singh RK, Dai O, Nimasow G. Effect of arbuscular mycorrhizal (AM) inoculation on growth of Chili plant in organic manure amended soil. African Journal of Microbiology Research, 2011, 5: 5004-5012
[5] Asmelash F, Bekele T, Birhane E. The potential role of arbuscular mycorrhizal fungi in the restoration of degraded lands. Frontiers in Microbiology, 2016, 7: 1095, doi: 10.3389/fmicb.2016.0109
[6] Tisserant E, Malbreil M, Kuo A, et al. Genome of an arbuscular mycorrhizal fungus provides insight into the oldest plant symbiosis. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110: 20117-20122
[7] Kiers ET, Duhamel M, Beesetty Y, et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science, 2011, 333: 880-882
[8] Salvioli A, Bonfante P. Systems biology and "omics" tools: A cooperation for next-generation mycorrhizal studies. Plant Science, 2013, 203: 107-114
[9] Gianinazzi S, Gollotte A, Binet MN, et al. Agroecology: the key role of arbuscular mycorrhizas in ecosystem services. Mycorrhiza, 2010, 20: 519-530
[10] Rillig MC, Aguilar-Trigueros CA, Bergmann J, et al. Plant root and mycorrhizal fungal traits for understanding soil aggregation. New Phytologist, 2015, 205:1385-1388
[11] Wang Y-S (王幼珊), Zhang S-B (张淑彬), Zhang M-Q (张美庆). Arbuscular mycorrhizal fungi and germplasm resources in China. Beijing: China Agriculture Press, 2012 (in Chinese)
[12] Gerdemann JW, Nicolson TH. Spores of mycorrhizal endogone species extracted from soil by wet sieving and decanting. Transactions of the British Mycological Society, 1963, 46: 235 -244
[13] Daniels BA, Skipper HD. Methods for the recovery and quantitative estimation of propagules from soi//Kormanik PP, eds. Methods and Principles of Mycorrhizal Research. Saint Paul, MI,USA: American Society for Phytopathology, 1982: 29-37
[14] Gilmore AE. Phytomycetous mycorrhizal organisms collected by open-pot culture methods. Hilgardia, 1968, 39: 87-105
[15] Crush JR, Hay MJ. A technique for growing mycorrhizal clover in solution culture. New Zealand Journal of Agricultural Research, 1981, 24: 371-372
[16] Mosse B. The establishment of vesicular-arbuscular mycorrhiza under asetic conditions. Journal of General Microbiology, 1962, 27: 509-520
[17] Wang Y-S (王幼珊), Liu R-J (刘润进). A checklist of arbuscular mycorrhizal fungi in the recent taxonomic system of Glomeromycota. Mycosystema (菌物学报),2017, 36(7): 820-850 (in Chinese)
[18] Dalpe Y, Monreal M. Arbuscular mycorrhiza inoculum to support sustainable cropping systems. Crop management, 2004, 3:1 -11
[19] Masula E, Vassilev N. A contribution to set a legal framework for biofertilisers. Appled Microbiology and Biotechnology, 2014, 98: 6599-6607
[20] Berruti A, Lumini E, Balestrini R, et al. Arbuscular mycorrhizal fungi as natural biofertilizers: Let's benefit from past successes. Frontiers in Microbiology, 2015, 6: 1559, doi: 10.3389/fmicb.2015.01559
[21] Herrmann L, Lesueur D. Challenges of formulation and quality of biofertilizers for successful inoculation. Applied Microbiology and Biotechnology, 2013, 97: 8859-8873
[22] IJdo M, Cranenbrouck S, Declerck S. Methods for large-scale production of AM fungi: Past, present, and future. Mycorrhiza, 2011, 21: 1-16
[23] Vosátka M, Látr A, Gianinazzi S, et al. Development of arbuscular mycorrhizal biotechnology and industry: Current achievements and bottlenecks. Symbiosis, 2012, 58: 29-37
[24] Oliveira RS, Rocha I, Ma Y, et al. Seed coating with arbuscular mycorrhizal fungi as an ecotechnological approach for sustainable agricultural production of common wheat (Triticum aestivum L.). Journal of Toxicology and Environmental Health Part A, 2016, 79: 329-337
[25] Rasoamampionona B, Rabeharisoa L, Andrianjaka A, et al. Arbuscular mycorrhizae in Malagasy cropping systems. Biological Agriculture & Horticulture, 2008, 25: 327-37
[26] Gomez-Roldan V, Fermas S, Brewer PB, et al. Strigolactone inhibition of shoot branching. Nature, 2008, 455:189-94
[27] Kapulnik Y, Delaux PM, Resnick N, et al. Strigolactones affect lateral root formation and root-hair elongation in Arabidopsis. Planta, 2011, 233: 209-16
[28] Ceballos I, Ruiz M, Fernández C, et al. The in vitro mass-produced model mycorrhizal fungus, Rhizophagus irregularis, significantly increases yields of the globally important food security crop cassava. PLoS One, 2013, 8(8): e70633
[29] Krak K, Janou?ková M, Caklová P, et al. Intraradical dynamics of two coexisting isolates of the arbuscular mycorrhizal fungus Glomus intraradices sensu lato as estimated by real-time PCR of mitochondrial DNA. Applied and Environmental Microbiology, 2012, 78: 3630-3637
[30] Selvakumar G, Shagol CC, Kim K, et al. Spores associated bacteria regulates maize root K+/Na+ ion homeostasis to promote salinity tolerance during arbuscular mycorrhizal symbiosis. BMC Plant Biology, 2018, 18: 109, doi: 10.1186/s12870-018-1317-2
[31] Tian H, Drijber R, Zhang J, et al. Impact of long-term nitrogen fertilization and rotation with soybean on the diversity and phosphorus metabolism of indigenous arbuscular mycorrhizal fungi within the roots of maize (Zea mays L.). Agriculture, Ecosystem and Environment, 2013, 164: 53-61
[32] Antunes PM, Koch AM, Dunfield KE, et al. Influence of commercial inoculation with Glomus intraradices on the structure and functioning of an AM fungal community from an agricultural site. Plant and Soil, 2009, 317: 257-266
[33] Zhang X, Chen B, Ohtomo R. Mycorrhizal effects on growth, P uptake and Cd tolerance of the host plant vary among different AM fungal species, Soil Science and Plant Nutrition, 2015, 61: 359-368
[34] Ziane H, Meddad-Hamza A, Beddiar A et al. Effects of arbuscular mycorrhizal fungi and fertilization levels on industrial tomato growth and production. International Journal of Agriculture and Biology, 2017, 19: 341-347
[35] Wu Y-S (吴亚胜), Guo S-R (郭世荣), Sun J (孙 锦), et al. Effects of exogenous spermidine and arbuscular mycorrhizal fungi on plant growth of cucumber. Chinese Journal of Applied Ecology (应用生态学报), 2018, 29(3): 891-898 (in Chinese)
[36] Tarraf W, Ruta C, Tagarelli A, et al. Influence of arbuscular mycorrhizae on plant growth, essential oil production and phosphorus uptake of Salvia officinalis L. Industrial Crops and Products, 2017, 107: 144-153
[37] Xie W, Hao Z, Zhou X, et al. Arbuscular mycorrhiza facilitates the accumulation of glycyrrhizin and liquiritin in Glycyrrhiza uralensis under drought stress.Mycorrhiza, 2018, 28: 285-300
[38] Ahmad H, Hayat S, Ali M, et al. The combination of arbuscular mycorrhizal fungi inoculation (Glomus versiforme) and 28-homobrassinolide spraying intervals improves growth by enhancing photosynthesis, nutrient absorption, and antioxidant system in cucumber (Cucumis sativus L.)under salinity. Ecology and Evolution, 2018, 8: 5724-5740
[39] Domokos E, Jakab-Farkas L, Darko B, et al. Increase in Artemisia annua plant biomass artemisinin content and guaiacol peroxidase activity using the arbuscular mycorrhizal fungus Rhizophagus irregularis. Frontiers in Plant Science, 2018, 9: 478, doi: 10.3389/fpls.2018.00478
[40] Lehmann A,Veresoglou SD, Rillig MC, et al. Arbuscular mycorrhizal influence on zinc nutrition in crop plants: A meta-analysis. Soil Biology and Biochemistry, 2014, 69: 123-131
[41] Lehmann A, Rillig MC. Arbuscular mycorrhizal contribution to copper, manganese and iron nutrient concentrations in crops: A meta-analysis. Soil Biology and Biochemistry, 2015, 81: 147-158
[42] Shi W-Q (石伟琦), Ding X-D (丁效东), Zhang S-R (张士荣). Effects of arbuscular mycorrhizal fungi on Leymus chinensis growth and soil carbon. Acta Botanica Boreali-Occidentalia Sinica (西北植物学报), 2011, 31(2): 357-362 (in Chinese)
[43] Zhang Y-X (张延旭), Bi Y-L (毕银丽), Zhang X-Y (张晓燕), et al. Application of arbuscular mycorrhizal fungi and its ecological effect in coal mining subsidence area. Northern Horticulture (北方园艺), 2014, 38(21): 161-164 (in Chinese)
[44] Bi YL, Li XL, Wang HG, et al. Establishment of dual culture between vesicular-arbuscular mycorrhizal fungus Sclerocystis sinuosa and transformed Ri T-DNA carrot roots in vitro. Plant and Soil, 2004, 261: 239-243
[45] Chen BD, Xiao XY, Zhu YG, et al. The arbuscular mycorrhizal fungus Glomus mosseae gives contradictory effects on phosphorus and arsenic acquisition by Medicago sativa Linn. Science of the Total Environment, 2007, 379: 226-234
[46] Dong Y, Zhu YG, Smith FA, et al. Arbuscular mycorrhiza enhanced arsenic resistance of both white clover (Trifolium repens Linn.) and ryegrass (Lolium perenne L.) plants in an arsenic-contaminated soil. Environmental Pollution, 2008, 155: 174-181
[47] Li J, Sun Y, Jiang X, Chen B, et al. Arbuscular mycorrhizal fungi alleviate arsenic toxicity to Medicago sativa by influencing arsenic speciation and partitioning. Ecotoxicology and Environmental Safety, 2018, 157: 235-243
[48] Nayuki K, Chen BD, Ohtomo R, et al. Cellular imaging of cadmium in resin sections of arbuscular mycorrhizas using Synchrotron micro X-ray fluorescence. Microbes and Environments, 2014, 29: 60-66
[49] Chen B-D (陈保冬), Li X-L (李晓林), Zhu Y-G (朱永官). Characters of metal adsorption by AM fungal mycelium. Mycosystema, 2005, 24(2): 283-291 (in Chinese)
[50] Li J-L (李景龙), Sun Y-Q (孙玉青), Zhang X (张莘), et al. Arbuscular mycorrhizal inoculation and ferrum addition synergistically reduce arsenic accumulation in Oryza sativa. Mycosystema (菌物学报), 2017, 36(7): 1037-1047 (in Chinese)
[51] Wu S, Zhang X, Sun Y, et al. Transformation and immobilization of chromium by arbuscular mycorrhizal fungi as revealed by SEM-EDS, TEM-EDS, and XAFS. Environmental Science & Technology, 2015, 49: 14036-14047
[52] Wu S, Hu Y, Zhang X, et al. Chromium detoxification in arbuscular mycorrhizal symbiosis mediated by sulfur uptake and metabolism. Environmental and Experimental Botany, 2018, 147: 43-52
[53] Zhang X, Wu S, Ren B, et al. Water management, rice varieties and mycorrhizal inoculation influence arsenic concentration and speciation in rice grains. Mycorrhiza, 2016, 26: 299-309
[54] Spagnoletti F, Carmona M, Gómez NET, et al. Arbuscular mycorrhiza reduces the negative effects of M. phaseolina on soybean plants in arsenic-contaminated soils. Applied Soil Ecology, 2017, 121: 41-47
[55] Wang J (王建), Zhou Z-Y (周紫燕), Ling W-T (凌婉婷). Distribution and environmental function of glomalin-related soil protein:A review.Chinese Journal of Applied Ecology (应用生态学报), 2016, 27(2): 634-642 (in Chinese)
[56] Verbruggen E, van der Heijden MGA, Rillig MC, et al. Mycorrhizal fungal establishment in agricultural soils: Factors determining inoculation success. New Phytologist, 2013, 197: 1104-1109
[57] McCain KNS, Wilson GWT, Blair JM. Mycorrhizal suppression alters plant productivity and forb establishment in a grass-dominated prairie restoration. Plant Ecology, 2011, 212: 1675-1685
[58] Rosendahl S, McGee P, Morton JB. Lack of global population genetic differentiation in the arbuscular mycorrhizal fungus Glomus mosseae suggests a recent range expansion which may have coincided with the spread of agriculture. Molecular Ecology, 2009, 18: 4316-4329
[59] Rouphael Y, Franken P, Schneider C, et al. Arbuscular mycorrhizal fungi act as biostimulants in horticultural crops. Scientia Horticulturae, 2015, 196: 91-108
[60] Verbruggen E, van der Heijden MGA, Weedon JT, et al. Community assembly, species richness and nestedness of arbuscular mycorrhizal fungi in agricultural soils. Molecular Ecology, 2012, 21: 2341-2353
[61] Smith SE, Read DJ. Mycorrhizal Symbiosis. 3rd Ed. London: Academic Press, 2008
[62] Labidi S, Ben JF, Tisserant B, et al. Field application of mycorrhizal bio-inoculants affects the mineral uptake of a forage legume (Hedysarum coronarium L.) on a highly calcareous soil. Mycorrhiza, 2015, 25: 297-309
[63] Hausmann NT, Hawkes CV. Order of plant host establishment alters the composition of arbuscular mycorrhizal communities. Ecology, 2010, 91: 2333-2343
[64] Mummey DL, Antunes PM, Rillig MC. Arbuscular mycorrhizal fungi preinoculant identity determines community composition in roots. Soil Biology and Biochemistry, 2009, 41: 1173-1179
[65] Pellegrino E, Bedini S, Avio L, et al.Field inoculation effectiveness of native and exotic arbuscular mycorrhizal fungi in a Mediterranean agricultural soil. Soil Biology and Biochemistry, 2011, 43: 367-376
[66] Pellegrino E, Turrini A, Gamper HA, et al. Establishment, persistence and effectiveness of arbuscular mycorrhizal fungal inoculants in the field revealed using molecular genetic tracing and measurement of yield components. New Phytologist, 2012, 194: 810-822
[67] Hijri M. Analysis of a large dataset of mycorrhiza inoculation field trials on potato shows highly significant increases in yield. Mycorrhiza, 2016, 26: 209-214
[68] Ge Y (葛 源), He J-Z(贺纪正), Zhu Y-G(朱永官), et al. Stable isotope probing and its applications in microbial ecology. Acta ecologica sinica (生态学报), 2006, 26(5):1574-1582 (in Chinese)
[69] He XL, Li YP, Zhao LL. Dynamics of arbuscular mycorrhizal fungi and glomalin in the rhizosphere of Artemisia ordosica Krasch. in Mu Us sandland, China. Soil Biology & Biochemistry, 2010, 42: 1313-1319
[70] Azcón R, Rodríguez R, Amora-Lazcano E, et al. Uptake and metabolism of nitrate in mycorrhizal plants as affected by water availability and N concentration in soil. European Journal of Soil Science, 2008, 59: 131-138
[71] Herridge F, Hartley E, Gemell G. Rhizobial counts in peat inoculants vary amongst legume inoculant groups at manufacture and with storage: Implications for quality standards. Plant and Soil, 2014, 380: 327-336
[72] Augé RM, Toler HD, Saxton AM. Arbuscular mycorrhizal symbiosis alters stomatal conductance of host plants more under drought than under amply watered conditions: a meta-analysis. Mycorrhiza, 2015, 25: 13-24
[73] Xie X, Huang W, Liu F, et al. Functional analysis of the novel mycorrhiza-specific phosphate transporter AsPT1 and PHT1 family from Astragalus sinicus during the arbuscular mycorrhizal symbiosis. New Phytologist, 2013, 198: 836-852
[74] Neumann E, George E. Colonisation with the arbuscular mycorrhizal fungus Glomus mosseae (Nicol. & Gerd.) enhanced phosphorus uptake from dry soil in Sorghum bicolor (L.). Plant and Soil, 2004, 261: 245-255
[75] Cameron DD, Neal AL, van Wees SCM, et al. Mycorrhiza-induced resistance: more than the sum of its parts? Trends in Plant Science, 2013, 18, 539-545
[76] Hao Z, Fayolle L, van Tuinen D et al. Local and systemic mycorrhiza-induced protection against the ectoparasitic nematode Xiphinema index involves priming of defence gene responses in grapevine. Journal of Experimental Botany, 2012, 63: 3657-3672
[77] Laliberte E. Below-ground frontiers in trait-based plant ecology. New Phytologist, 2017, 213: 1597-1603
[78] Rodriguez A, Sanders IR. The role of community and population ecology in applying mycorrhizal fungi for improved food security. The ISME Journal, 2015, 9: 1053-1061





