
硝化和反硝化是土壤中氮素损失的潜在途径. 随着人类活动的加剧, 土壤中的硝化和反硝化作用会向大气中释放更多的温室气体氧化亚氮. 由人为活动所产生的氧化亚氮中, 耕地土壤的释放量贡献了65%左右[1]. 反硝化作用(denitrification)是指把硝酸盐等较复杂的含氮化合物转化为氮气 、 一氧化氮和二氧化氮的过程, 这是厌氧条件下(>60%的土壤孔隙水含量)陆地氧化亚氮产生的主要生物过程. 在过去的 1 个多世纪里, 人们通常认为反硝化过程都是由进行无氧呼吸的细菌进行的, 但近年来的研究发现, 真菌也可以进行反硝化作用[2]. 在分离获得的真菌中, 已经发现很多种具有产生氧化亚氮的能力.
虽然在纯培养条件下, 真菌产生氧化亚氮活性与细菌相比要低几个数量级[3], 但是对土壤氧化亚氮产生能力的测定结果表明, 真菌产氧化亚氮的能力远超细菌[4-5]. Laughlin 等[4]研究表明: 在草地及耕作泥炭土中使用放线菌酮抑制真菌活性时, 土壤氧化亚氮排放通量减少了 80%, 而用链霉素抑制土壤细菌活性后, 土壤氧化亚氮排放通量仅减少 30%左右. 真菌在土壤氧化亚氮排放中的重要贡献可能是由于其生物量在土壤微生物中占据着非常大的优势. 土壤原位氧化亚氮排放通量与土壤真菌生物量呈显着正相关,而与反硝化细菌及其他土壤性质没有明显的相关[6]. 已经有一些关于草地、 湿地以及耕地等生态系统土壤真菌氧化亚氮排放的研究, 但是对于林地土壤的研究尚不多见[4-5, 7-8]. 部分经济林的集约经营程度越来越高, 它们对土壤微生物, 特别是对土壤真菌的干扰也非常剧烈. 由于真菌可以耐受更低的 pH 值,且在林地土壤中的生物量也往往高于细菌, 因此真菌在南方酸性森林土壤氧化亚氮排放过程中可能具有更大的贡献[9-10]. 毛竹 Phyllostachy edulis 是中国南方的主要竹种[11], 地下根鞭发达, 穿透能力极强, 可以帮助毛竹不断向周边森林蔓延并替代原有森林. 此外, 毛竹林的经济价值较高, 目前农户对其的集约经营程度也在不断提高. 由于真菌对人为干扰较为敏感, 原有天然林改变为毛竹林必将导致土壤真菌群落结构的变化, 进而导致土壤氧化亚氮排放通量的改变. 本研究利用选择性抑制方法, 研究毛竹林及阔叶林土壤细菌及真菌对氧化亚氮排放的贡献率, 揭示不同微生物在林地土壤温室气体排放中的作用及其影响机制, 从而对阔叶林演变成毛竹林进行生态风险评估, 为合理经营毛竹林, 减少温室气体排放提供理论依据.
1 材料与方法
1.1 样品采集
在浙江省临安市天目山国家级自然保护区进行野外调查, 在相似地形地貌条件下分别选取 4 块毛竹林地(moso bamboo forest, MB)和 4 块阔叶林地(broad-leaved forest, BL). 所有样地土壤均为花岗岩发育的红壤, 毛竹林地土壤为粉黏土(黏粒 43.27%, 粉粒 40.34%, 砂粒 16.39%), 阔叶林地土壤为粉黏壤土(黏粒 38.50%, 粉粒 48.68%, 砂粒 12.82%). 采用 5 点采样法采取土样, 采集表层(0~20 cm)土壤,装入自封袋带回实验室. 去除大的动植物残体及石砾后, 样品过 2 mm 钢筛混匀, 四分法后弃去多余样品. 样品分为 2 份, 1 份立即进行室内培养试验和磷脂脂肪酸分析, 另 1 份风干后测定土壤 pH 值、 有机质、 全氮质量分数等基本理化性质.
1.2 试验设置
混合后的新鲜土样用于室内培养试验, 测定细菌及真菌对土壤氧化亚氮排放通量的贡献率. 试验共分为 4 个处理: ①对照(control), 不添加任何抗生素; ②链霉素(streptomycin, strep), 土壤中添加 1.0mg·g-^1的链霉素;③放线菌酮(cycloheximide, cyclo), 土壤添加 2.0 mg·g-1放线菌酮;④链霉素+放线菌酮(both), 土壤中同时添加 1.0 mg·g^-1的链霉素和 2.0 mg·g^-1放线菌酮. 重复 3 次·土样^-1.
1.3 试验方法
1.3.1 土样培养试验 称取相当于 20.0 g 干质量的新鲜土壤放进 150 mL 棕色试剂瓶中, 加入 4.0 mL 不同抗生素溶液(对照仅加去离子水)使土壤抗生素质量分数达到试验设计要求. 试剂瓶装好土样后, 先在4 ℃条件下过夜预培养, 以使抗生素逐渐扩散至整个土壤空隙中. 之后, 将试剂瓶移至室温培养, 向土壤中分别加入 100 mmol·L^-1葡萄糖和 100 mmol·L^-1硝酸钾, 使土壤含水量达到田间最大持水量的 90%左右. 将试剂瓶用塞上橡胶塞后, 向其中充体积分数为 10%的乙炔以抑制氧化亚氮继续还原成氮气. 将土样与溶液充分混合后, 放在培养箱中 18 ℃培养 7 h 后, 开始用针筒抽取试剂瓶内气体, 岛津(GC-2014)气相色谱测定氧化亚氮通量.
1.3.2 磷脂脂肪酸分析 新鲜样品带回实验室后, 立即进行冷冻干燥, 测定土壤磷脂脂肪酸摩尔质量浓度. 磷脂脂肪酸测定参照 Wu 等[12]方法. 称取 3.0 g 冻干土样, 采用氯仿提取总磷脂后, 将样品装载硅胶柱(SPE-Si), 分别用氯仿、 丙酮和甲醇洗脱中性脂、 糖脂和极性磷脂. 将所有组分进行甲基化, 氯仿回收, 氮气吹干后气相色谱(安捷伦 6890N)测定. 总磷脂脂肪酸摩尔质量浓度用于表征土壤总微生物量. 细菌的代表性组分为: i15:0, a15:0, 15:0, i16:0, 16:1w7c, i17:0, a17:0, cy17:0, 17:0, 18:1w7c, cy19:0w8c; 真菌特征性脂肪酸为 18:2w6,9c[13]. 磷脂脂肪酸摩尔质量浓度以 nmol·g-1干土表示.
1.3.3 土壤理化性质分析 土壤有机质采用重铬酸钾外加热法测定; 全氮采用凯氏法测定; 硝态氮和铵态氮采用氯化钾浸提, 流动分析仪测定; 有效磷采用 Bray 法测定, 盐酸-氟化铵溶液浸提, 比色法测定; 速效钾采用乙酸铵提取-火焰光度法测定; pH 值采用 1∶2.5 土水比, 酸度计测定[14].
1.4 数据分析
采用 Excel 2007 和 SPSS 18.0 处理数据, Duncan 单因素方差分析法比较各处理之间的差异显着性(P <0.05), 配对样本 t 检验比较毛竹林与阔叶林土壤理化性质及土壤细菌与真菌反硝化能力的差异显着性, 采用 Pearson 相关系数检验不同微生物氧化亚氮排放能力与土壤理化性质的相关关系.
2 结果与分析
2.1 土壤理化性质
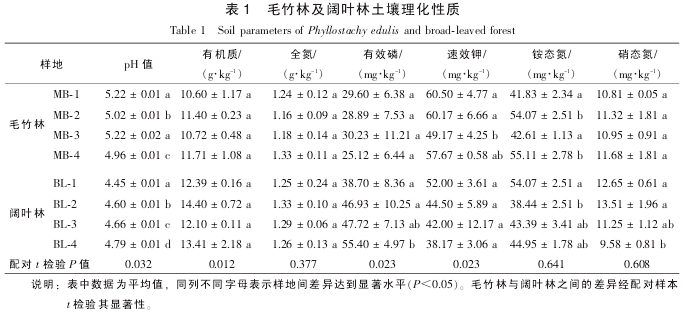
所有样地土壤均表现出不同程度的酸性, 而不同毛竹林及阔叶林样地之间土壤 pH 值差异也较大.
分析结果表明: 毛竹林不同样地土壤有机质、 全氮、 有效磷及硝态氮质量分数均没有显着差异, 而阔叶林不同样地之间土壤有机质、 全氮及速效钾也没有显着差异, 说明不同林分土壤有机质及全氮质量分数分布总体较为均一. 对比 2 种林分, 阔叶林土壤 pH 值显着低于毛竹林(P<0.05), 而有机质与有效磷质量分数显着高于毛竹林土壤(P<0.05). 相反, 毛竹林土壤速效钾质量分数显着高于阔叶林(P<0.05,表 1). 毛竹林入侵阔叶林或阔叶林人工演替为毛竹林后, 由于地上植被以及凋落物输入的改变, 土壤理化性质也发生了相应的变化. 此外, 毛竹林人为干扰程度也在不断增加, 如劈灌、 翻耕、 施肥以及伐竹等, 都会导致养分含量的改变, 如土壤有机质质量分数. 肖复明等[15]研究表明: 长期集约经营后, 毛竹林土壤有机碳逐渐下降. 而毛竹林土壤速效钾高于阔叶林, 可能是由于人为施肥所造成的.
2.2 土壤微生物量
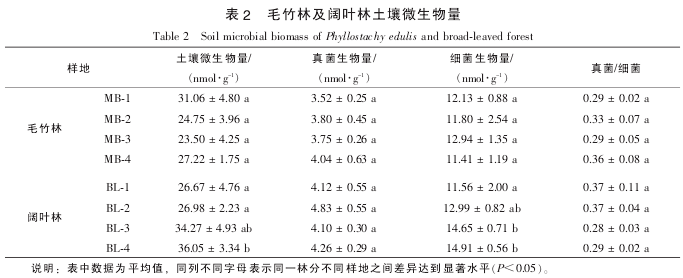
磷脂脂肪酸是几乎所有活体微生物细胞膜的主要成分, 周转速率极快且随细胞死亡而迅速降解[16].因此, 本试验采用土壤微生物总磷脂脂肪酸摩尔质量浓度作为土壤微生物量的指标, 可以最大限度地测定土壤中的活性微生物. 结果表明: 无论是总微生物量、 细菌及真菌生物量以及真菌/细菌比值, 毛竹林与阔叶林 2 种林分之间均没有显着差异. 同样, 毛竹林的不同样地之间也没有显着差异. 阔叶林土壤中, BL-4 样地总微生物量与细菌生物量均显着高于 BL^-1 样地(P<0.05, 表 2). Pearson 相关分析表明:
真菌生物量与土壤 pH 值呈显着负相关(R²=-0.752, P<0.05), 而与土壤有机质呈极显着正相关 (R²=0.965, P<0.01); 细菌生物量与土壤速效磷显着相关(R²=0.830, P<0.05), 而土壤真菌/细菌比值与硝态氮显着相关(R²=0.815, P<0.05). 与细菌相比, 真菌可以适应更广的 pH 值范围, 且酸性 pH 值有利于真菌而不利于细菌的生长[17]. 因此, 在酸性的毛竹林和阔叶林土壤中, 真菌的活性相对较强. 有机质也是影响真菌的一个重要因素. 研究表明: 森林转换为耕地之后导致土壤有机质降低, 进而降低林地土壤真菌生物量[18]. 与土壤有机质相似的是, 毛竹林真菌生物量与阔叶林相比有下降的趋势, 尽管没有显着差异。
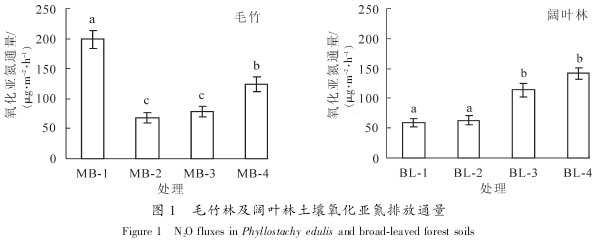
2.3 细菌及真菌氧化亚氮排放贡献
不同林分土壤以及同一种林分不同样地之间氧化亚氮的排放通量都存在较大差异, 其中毛竹林 MB-1 样地土壤氧化亚氮排放通量最高, 其次是 MB-4, BL-3 及 BL-4 等样地, MB-2 和 BL^-1, BL-2 等样地的氧化亚氮排放通量最低(图 1). 相关分析结果表明: 土壤氧化亚氮排放通量与本研究所选择测定的部分土壤理化性质没有显着相关性. 土壤氧化亚氮排放与许多因素有关, 如土壤含水量、 容重、 pH 值、 有机质质量分数、 氮肥施用量等等[19]. 因此, 本研究中不同林分甚至同一林分不同样地之间存在的巨大差异, 可能是由多种土壤环境因素共同决定的, 其影响因素还有待于进一步的研究. 统计结果表明: 毛竹林和阔叶林土壤氧化亚氮排放通量没有显着差异(t=-0.574, P=0.606). 在以往对森林土壤氧化亚氮排放通量的研究过程中, 往往将土壤温度和湿度作为关键因子[20], 但近年来的研究则发现: 氮素水平是一个关键因素[21]. 对比 2 种不同林分, 无论是土壤全氮还是矿质态氮均没有显着差异(表 1), 这可能是 2 种林分氧化亚氮排放通量没有差异的主要原因.
无论是单独添加放线菌酮、 链霉素还是同时添加 2 种抗生素, 均显着抑制了土壤氧化亚氮排放通量(P<0.05). 同时添加 2 种抗生素对土壤氧化亚氮排放通量的抑制率在 73%~83%, 但是同一林分的不同样地之间没有显着差异, 而单独添加链霉素或者放线菌酮的处理对土壤氧化亚氮排放通量的抑制率变化较大. 图 2 结果表明: 在 2 种林分的样地中, 除了个别样地外(MB-2, BL^-1), 其他所有土壤真菌氧化亚氮排放通量均显着高于细菌(P<0.05). 如在毛竹林土壤中, 真菌对土壤氧化亚氮排放的贡献率为40.8%~56.2%, 远高于细菌(9.0%~33.4%). 阔叶林土壤中也呈现同样的规律, 真菌对土壤氧化亚氮排放贡献率为 38.0%~62.8%, 而细菌的贡献率为 12.6%~32.4%(图 2). 目前, 已有研究表明, 在森林生态系统中的真菌群落对土壤氧化亚氮排放的贡献要大于草地以及人为耕作的生态系统[4-5, 8]. 同时, 真菌与细菌对土壤氧化亚氮排放的贡献比在不同的生态系统中存在着较大的差异[22]. 毛竹林与阔叶林由于其地上植被以及人为干扰程度不一样, 真菌与细菌对土壤氧化亚氮排放的贡献率也就存在着一定的差异.
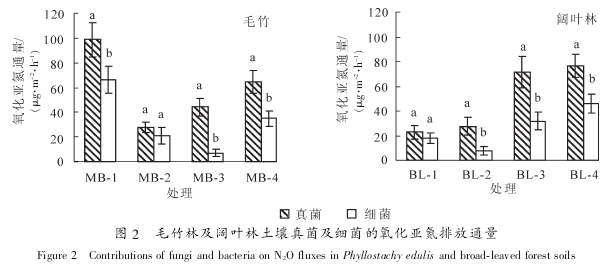
与此类似的是, 在 2 种林分的不同样地之间, 土壤真菌及细菌对氧化亚氮排放通量的贡献率也有着显着的差异(P<0.05). 如在毛竹林土壤中, 尽管氧化亚氮排放通量显着低于样地 MB-1(P<0.05), 但是MB-3 样地的土壤真菌氧化亚氮排放贡献率达到 56.2%, 显着高于 MB-1 样地真菌排放贡献率(49.7%,P<0.05). 而在阔叶林土壤中, BL-3 和 BL-4 样地土壤总氧化亚氮排放通量显着高于(P<0.05)另外 2 个样地的同时, 其真菌氧化亚氮排放贡献率也显着高于样地 BL^-1 和 BL-2(P<0.05).将土壤氧化亚氮排放通量与所有土壤理化性质及微生物生物量进行 Pearson 相关分析. 结果表明:
真菌与细菌的氧化亚氮排放贡献之间存在极显着的相关性(P<0.01), 可能与 2 种微生物群落反硝化的环境条件要求较为相似有关. 值得注意的是, 真菌及细菌氧化亚氮排放通量与其生物量之间没有显着相关性, 说明生物量并非是决定氧化亚氮排放通量的关键因素. 由于只有一些特定的真菌即细菌种类可以进行反硝化作用, 如真菌中的镰刀菌属 Fusarium spp.具有较强的氧化亚氮释放能力[23]. 因此, 真菌的氧化亚氮排放贡献主要与真菌群落及特定种群的反硝化活性相关. 今后仍然需要从微生物物种多样性以及功能基因丰度等方面来进一步研究土壤反硝化作用的主要贡献者及其关键影响因素. 以往有研究结果表明: 真菌与细菌的氧化亚氮产生活性与土壤 pH 值关系较大, 这可能是由于 pH 值对这 2 种微生物数量及活性均有着重要的影响[22, 24]. 由于真菌可以适应非常宽的 pH 值范围, 其受土壤 pH 值改变的影响相对细菌小, 而细菌生物量在酸性条件下可能会受到抑制, 因此在酸性土壤中真菌对氧化亚氮排放的贡献就会大于细菌. 然而与以往结果不同的是, 本研究发现土壤真菌即细菌氧化亚氮排放通量与土壤 pH 值没有显着相关关系, 这可能与不同样地之间 pH 值较为接近有关. 但是, 真菌氧化亚氮排放通量与土壤硝态氮含量有较强的负相关关系, 尽管并不显着(R²=-0.673, P=0.067). 通常, 氧化亚氮通量与 NO3-N呈负相关关系. 随着反硝化作用的进行, NO3-N 作为电子受体含量下降, 还原成氧化亚氮释放出来[25].
3 结论与展望
抗生素选择性抑制试验结果表明: ①无论是毛竹林还是阔叶林, 真菌都是土壤氧化亚氮排放的主要贡献者; ②阔叶林演替为毛竹林既没有改变土壤氧化亚氮排放通量, 也没有影响真菌及细菌对土壤氧化亚氮排放通量的相对贡献率; ③真菌和细菌氧化亚氮排放特征相似, 但与生物量没有相关性.
近年来, 毛竹林不断替代阔叶林的同时, 经营强度也在不断增加. 据统计, 有 40%~50%的毛竹林实行集约化栽培. 与天然状态的粗放经营毛竹林相比, 集约经营毛竹林的典型特点表现为清除林下杂草, 土壤翻耕以及施用大量化肥等. 尽管集约经营措施可以一定程度上增加毛竹地上部的生物量, 提高碳储量[26], 但也有研究表明, 使用化肥显着增加了毛竹林土壤二氧化碳和氧化亚氮的排放通量, 且毛竹林土壤温室气体的排放速率随着化肥施用量增加呈显着增加趋势[27], 但是其内在机制仍不清楚. 人为干扰如翻耕、 放牧以及氮肥施用等都会影响土壤真菌群落结构和功能[28], 继而对土壤氧化亚氮排放产生潜在影响. 本研究中, 我们只是针对阔叶林和毛竹林进行了研究, 但是不同经营年限以及经营强度对毛竹林土壤真菌氧化亚氮相对排放贡献的影响尚未涉及, 今后仍需在更加广泛的范围内针对人工经营毛竹林进行采样, 并结合稳定性同位素标记手段来研究真菌在森林, 特别是人工经营森林生态系统氧化亚氮排放中的贡献. 明确土壤真菌氧化亚氮排放相对贡献及其对毛竹林人为经营的响应特征, 对于合理经营毛竹林, 控制全球气候变化将具有十分重要的意义.
参考文献:
[1] SMITH K A, CONEN F. Impacts of land management on fluxes of trace greenhouse gases [J]. Soil Use Manage,2004, 20(2): 255 - 263.
[2] ZUMFT W G. Cell biology and molecular basis of denitrification [J]. Microbiol Mol Biol Rev, 1997, 61(4): 533 - 616.
[3] KURAKOV A V, NOSIKOV A N, SKRYNNIKOVA E V, et al. Nitrate reductase and nitrous oxide production byFusarium oxysporum 11dn1 under aerobic and anaerobic conditions [J]. Curr Microbiol, 2000, 41(2): 114 - 119.
[4] LAUGHLIN R J, STEVENS R J. Evidence for fungal dominance of denitrification and co-denitrification in agrassland soil [J]. Soil Sci Soc Am J, 2002, 66(5): 1540 - 1548.
[5] CRENSHAW C L, LAUBER C, SINSABAUGH R L, et al. Fungal control of nitrous oxide production in semiaridgrassland [J]. Biogeochemistry, 2008, 87(1): 17 - 27.
[6] KOMATSUZAKI M, SATO Y, OHTA H. Relationships between fungal biomass and nitrous oxide emission in uplandrice soils under no tillage and cover cropping systems [J]. Microbes Environ, 2008, 23(3): 201 - 208.
[7] KINNEY C A, MOSIER A R, FERRER I, et al. Effects of the herbicides prosulfuron and metolachlor on fluxes ofCO2, N2O, and CH4in a fertilized Colorado grassland soil [J]. J Geophys Res, 2004, 10 9 (D5): doi: 10.1029/2003JD003536.
[8] MCLAIN J E T, MARTENS D A. N2O production by heterotrophic N transformations in a semiarid soil [J]. Appl SoilEcol, 2006, 32(2): 253 - 263.
[9] JOERGENSEN R G, WICHERN F. Quantitative assessment of the fungal contribution to microbial tissue in soil [J].Soil Biol Biochem, 2008, 40(12): 2977 - 2991.
[10] STRICKLAND M S, ROUSK J. Considering fungal:bacterial dominance in soils-methods, controls, and ecosystemimplications [J]. Soil Biol Biochem, 2010, 42(9): 1385 - 1395.
[11] 王奇赞, 徐秋芳, 姜培坤, 等. 天目山毛竹入侵阔叶林后土壤细菌群落 16S rDNA V3 区片段 PCR 的 DGGE 分析[J]. 土壤学报, 2009, 46(4): 662 - 669.WANG Qizan, XU Qiufang, JIANG Peikun, et al. DGGE analysis of PCR of 16SrDNA V3 fragment of soil bacteriacommunity in soil under natural broadleaf forest invaded by Phyllostachy pubescens in Tianmu Mountain NatureReserve [J]. Acta Pedol Sin, 2009, 46(4): 662 - 669.





