
白纹伊蚊(Aedes albopictus)是一种重要的医学媒介昆虫,在我国分布范围很广,是传播登革热和登革出血热的重要媒介。作为一种变温动物,温度变化是造成白纹伊蚊种群季节消长的基本原因之一,耐受低温能力的高低是其种群存在与发展的重要前提,决定着它们的生殖、扩散、分布以及下一季节的发生动态。在种群向高纬度扩散的例子中,最冷月份或季度的最低温度和平均温度往往被认为是白纹伊蚊分布的生态学限制因素。在这种情况下,滞育卵的产生能提高其在温带地区冬季的存活率,有助于白纹伊蚊种群的向北扩散,是白纹伊蚊越冬的重要策略。实验室及野外实验均证实滞育能增强白纹伊蚊对低温的耐受能力。
热休克蛋白(heat shock protein,HSPs)是细胞或生物体受到热胁迫后,体内新合成或含量增加的一类遗传上高度保守的蛋白质,在原核生物和真核生物中普遍存在。低温暴露导致热休克蛋白70基因(Hsp70)mRNA表达的上调在果蝇(Drosophila melanogaster)及其他昆虫中已有报道,越来越多的研究发现昆虫在滞育期间,Hsp70mRNA表达量增加。对于冬季滞育的昆虫,Hsp70的上调表达对于越冬个体的存活十分重要,是提高昆虫越冬抗寒性的重要因子。
本研究通过模拟白纹伊蚊越冬状态的卵,研究Hsp70 的表达情况,以便分析白纹伊蚊越冬卵的抗低温能力及Hsp70在其中发挥的作用。
1 材料与方法
1.1实验种群及饲养方法
1.1.1种群来源 白纹伊蚊实验种群,2012年采自北京市昌平区,经多代饲养繁殖,已达到正常群体的自然繁殖水平。
1.1.2饲养条件 温度(27±1)℃,相对湿度(80±5)%,光照周期(L∶D)=16 h∶8 h。使用脱氯自来水,幼虫饲料用羊肝粉和馒头粉按1∶1混合而成;成蚊饲养用10%的蔗糖溶液及饲喂小白鼠血。
1.1.3非滞育卵的获得 将蛹转移到温度(21±1)℃,相对湿度(80±5)%,光照周期(L∶D)=16 h∶8 h的气候模拟室,成蚊羽化7~10 d后进食血餐,3~4 d后搜集产下的非滞育卵,保存在相同条件下6 d后完成胚胎发育。
1.1.4滞育卵的获得 将蛹转移到温度(21±1)℃,相对湿度(80±5)%,光照周期(L∶D)=8 h∶16 h的气候模拟室,成蚊羽化7~12 d后进食血餐,3~4 d后搜集产下的滞育卵,保存在相同条件下6 d后完成胚胎发育。
1.2 实验方法
1.2.1冷暴露处理 将滞育卵在-7℃处理2 h后,室温25℃分别恢复1、2、3、5、7、9 h后,冻存于-80℃备用,每个处理重复3次,以不接受低温处理的卵为对照。非滞育卵的处理方法与滞育卵相同。
1.2.2总RNA的提取与第一链cDNA的合成 取白纹伊蚊卵,采用RNAeasy Mini Kits(购自Qiagen公司)试剂盒提取总RNA。利用紫外分光光度计NanoDropND-1000 Spectrophotometer(NanoDrop Technologies,USA)检测其纯度及浓度,并经琼脂糖凝胶电泳鉴定其完整性。取1 μg总RNA为模板,应用PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒(购自TaKaRa公司),合成第一链cDNA。
1.2.3引物、探针的设计 根据GenBank数据库中公开发表的基因序列,设计Hsp70和内参基因βactin 的引物和探针(由北京天一辉远公司合成),见表1。【表1】

1.2.4扩增效率一致性检测 将合成的cDNA以3倍倍比稀释5个浓度梯度,各取1 μl进行实时荧光定量PCR(RT qPCR)反应,检测目的基因和内参基因的扩增效率是否一致。
1.2.5实时定量PCR检测 采用RT qPCR结合比较Ct 值法对白纹伊蚊卵 Hsp70 表达进行相对定量分析;采用βactin 作为内参基因,分析 Hsp70 表达的相对变化。
RT qPCR反应根据荧光定量试剂盒GoTaqProbe qPCR Master Mix(购自Promege公司)的说明,采用20 μl的反应体系:GoTaq Probe qPCR Master Mix(2×)10 μl,上、下游引物(10 μmol/L)各1 μl,探针(10 μmol/L)0.5 μl,1 μl稀释10倍的cDNA作为模板,加超纯水至总体积20 μl。在CFX 96实时定量PCR仪(Bio Rad公司)上进行RT qPCR检测,主要反应条件:95℃预变性2 min;95℃变性3 s,60℃退火/延伸30 s,40个循环。每个循环在60℃时检测荧光强度。
1.3 数据分析
数据采用SPSS 11.0软件进行t检验及单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 RNA质量控制
经过分光光度计检测,提取的总RNAA260/A280均在1.8~2.0之间。使用1%琼脂糖凝胶进行RNA电泳,28S、18S、5S条带清晰,提取的RNA符合实验要求,可用于下一步cDNA的合成。
2.2 扩增效率一致性
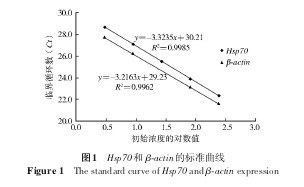
白纹伊蚊卵cDNA以3倍倍比稀释5个浓度梯度,假定最初模板浓度为243,则其他梯度稀释的样品浓度可依次认定为:81、27、9和3。以初始浓度的对数值作为横坐标,Ct值作为纵坐标建立RT qPCR的标准曲线(图1)。Hsp70和 β actin标准曲线的相关系数R2分别为0.9985和0.9962,说明线性关系良好。两标准曲线斜率分别为-3.3235和-3.2163,扩增效率分别为99.93%和104.61%,符合95%<E<105%的范围,说明Hsp70和 β actin 的扩增效率基本一致,可以利用2-ΔΔCt公式进行实验结果分析。2.3Hsp70 的表达.【图1】
2.3.1滞育卵Hsp70的表达 未经其他处理的滞育卵与非滞育卵 Hsp70 的表达,差异无统计学意义(P=0.392)(表2),表明在滞育期间,白纹伊蚊卵Hsp70表达未发生明显变化。【表2】

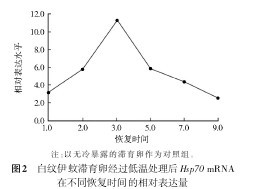
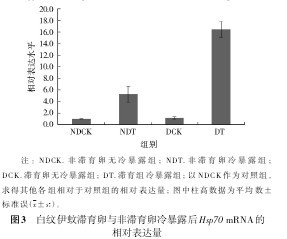
2.3.2冷暴露处理后 Hsp70 的表达 滞育卵暴露在-7℃2 h后,在25℃室温下,随着恢复时间的增加,Hsp70 的mRNA表达量明显上调,在3 h时达到最高水平,随后逐渐下降(图2)。将恢复3 h时白纹伊蚊滞育卵与非滞育卵Hsp70mRNA的表达量进行比较(图3),滞育卵与非滞育卵Hsp70mRNA的表达量分别是对照组的16.44和5.22倍,滞育卵在经过同样的低温处理和恢复过程后,Hsp70mRNA的表达量显着高于非滞育卵的表达量,且差异有统计学意义(P<0.05)。【图2-3】
3 讨 论
尽管热休克蛋白是在高温胁迫研究中发现的,但是在低温、氨基酸类似物、低氧、高盐、重金属离子、营养饥饿、紫外线、胞外pH值变化等胁迫环境下,同样会有热休克蛋白的生成,最大限度地降低胁迫对机体细胞的损伤。此外研究还发现,一些昆虫在滞育期间Hsp70 表 达 上 调 。 胚 胎 滞 育 的 舞 毒 蛾(Lymantriadiaper)和家蚕(Bombyx mori)的Hsp70表达量显着高于它们的非滞育虫期。麻蝇(Sarcophaga crassipalpis)、苜蓿切叶蜂(Megachile rotundata)、美国核桃实蝇(Rhagoletis suavis)和烟草天蛾(Manduca sexta)滞育蛹中Hsp70表达量均明显高于非滞育蛹。此外在欧洲玉米螟(Ostrinia nubilalis)滞育幼虫和科罗拉多马铃薯甲虫(Leptinotarsa decemlineata)滞育成虫中也发现有类似Hsp70表达上调的现象。
然而不是所有的昆虫在滞育期均上调表达Hsp70。在丝光绿蝇(Lucilia sericata)的滞育幼虫中,Hsp70 表达量在滞育期间无变化。以成虫滞育越冬的叔白颜果蝇(Drosophila triauraria)和淡色库蚊(Culex pipiens),滞育期间Hsp70表达量在滞育成虫与非滞育成虫之间差异无统计学意义。本研究同样发现白纹伊蚊的滞育卵与非滞育卵相比Hsp70的表达差异无统计学意义。
虽然Hsp70在白纹伊蚊滞育期并没有上调表达,但是在滞育期间受冷刺激(-7℃,2 h)后能迅速增加表达,说明冷暴露诱导的Hsp70表达并不受滞育状态的影响。这种情况在淡色库蚊滞育成虫、棉铃虫(Helicoverpa zea)的滞育蛹中也存在。在同样的冷暴露条件下,白纹伊蚊滞育卵Hsp70表达量比非滞育卵的高,而且白纹伊蚊是以滞育卵越冬的,所以我们推测在滞育期间低温诱导表达的Hsp70有助于增强白纹伊蚊卵的耐寒性。
参考文献
[1] 吴家红,程金芝,陈璐,等.白纹伊蚊βactin 基因实时荧光定量RT PCR方法的建立[J].四川动物,2010,29(5):593-595.
[2]Mcdonald JR,Head J,Bale JS,et al. Cold tolerance,overwinteringand establishment potential ofThrips palmi[J]. Physiol Entomol,2000,25(2):159-166.
[3]Hanson SM,Cralg GB Jr.Aedes albopictus(Diptera:Culicidae)eggs:field survivorship during northern Indiana winters[J]. J MedEntomol,1995,32(5):599-604.
[4]Reynolds JA,Poelchau MF,Rahman Z,et al. Transcript profilingreveals mechanisms for lipid conservation during diapause in themosquito,Aedes albopictus[J]. J Insect Physiol,2012,58(7):966-973.
[5]Hanson SM,Cralg GB Jr. Cold acclimation,diapause,andgeographic origin affect cold hardiness in eggs ofAedes albopictus(Diptera:Culicidae)[J]. J Med Entomol,1994,31(2):192-201.
[6] 王海鸿,雷仲仁.昆虫热休克蛋白的研究进展[J].中国农业科学,2005,38(10):2023-2034.





