
仿刺参(Apostichopus japonicus)具有极高的营养和药用价值[1],随着市场需求越来越大,养殖规模逐步扩大,但是,病害频发严重影响了仿刺参养殖产业的发展。药物虽能治疗动物疾病,但是产生的药物依赖和药物残留,影响人的食品安全[2-3]。
微生态制剂是根据微生态学的微生态平衡、微生态失调、微生态营养和微生态防治等理论,利用正常微生物群成员或其促进物质制成的能够调整机体微生态平衡的活体微生物制剂,因此又称为益生素或促生素[4]。自1986年,日本的Kozasa[5]
将微生态制剂应用于水产养殖以来,微生态制剂的使用在全世界范围内迅速发展。微生态制剂在仿刺参养殖中的研究一直着重于对仿刺参生长、免疫和肠道及养殖水质的影响[6-11],但有关微生态制剂对仿刺参室内苗种培育过程中换水频次的影响尚未见报道。为此,笔者研究了在仿刺参幼参培育过程中,定期投喂微生态制剂,换水频次对仿刺参生长及氮、磷收支及养殖水质的影响,以期为微生态制剂在仿刺参养殖中的应用提供参考。
1 材料与方法
1.1 材料
试验 用 仿 刺 参 幼 参 平 均 湿 质 量 (1.231±0.0046)g,山 东 好 当 家 海 洋 发 展 股 份 有 限 公 司提供。
所用微生态制剂为乳酸粉,以乳酸菌为主,菌含量2.0×109cfu/g。
饲料由威海金牌生物科技有限公司提供,主要成分为马尾藻(Scagassum natans)和海泥,适用于稚参。
试验于中国水产科学研究院南海水产研究所深圳试验基地提供的容量500L塑料桶中进行。波纹板40cm×40cm,每组20片,共18组,由山东好当家海洋发展股份有限公司提供。
1.2 方法
1.2.1试验设计试验为6个处理组,分为未换水组、3d换水组、5d换水组、8d换水组、12d换水组、15d换水组。所有组均投喂以乳酸菌为主的微生态制剂,投喂量为2.0g/m3。每组设置3个重复。1.2.2日常管理500L塑料桶中水体为300L,每个桶中放入两组附着基,每桶放400g幼参,18个桶。日投饵1次(18:00),投饵量开始为幼参体质量的3%,之后根据幼参的摄食情况和水体温度调整投饵率。试验房间内窗户用黑色织网遮住。按试验设计定期换水。每日定时测定温度、pH、溶氧、盐度,观察幼参生活状态。试验期间水温18~24℃(图1),盐度30~35(图2),连 续 充 气。每 日 测 定NH+4-N和NO-2-N的含量。全部换水时测定水体中的NH+4-N、NO-2-N、NO-3-N、活性磷的含量。用靛酚亮蓝法测定NH+4-N;用重氮—偶氮比色法测NO-2-N;用锌—镉还原法测定NO-3-N;用钼蓝比色法测定活性磷;氮、磷联合消化法测定其中总氮、总磷含量。测定方法参照《养殖水环境化学试验》[12]。
1.2.3 微生态制剂的使用方法投喂前,用海水化解微生态制剂,使之变为菌悬液,将菌悬液与适量海藻泥饲料搅拌均匀后(可以稀一些),全池泼洒。每隔5d投洒一次。
1.2.4 幼参、饲料、底质的测定在试验前、后采集幼参样品,放入烘箱60 ℃烘干,研磨过200目筛,用Vario EL Ⅲ德国元素分析仪测定总氮[13],用氢氧化钠消解法测总磷[14]。
1.2.5 生长指标的测定试验结束后,将幼参饥饿24h,称取总质量,并将所有试验桶的幼参进行数量统计。计算特定生长率和成活率:成活率/%=试验末幼参存活数/试验初试幼参总数×100%特定生长率/%·d-1=(lnmt-lnmo)/t×100%式中,m0和mt分别为试验初始时和终末时幼参的平均质量(g);t为试验时间(d)。
1.3 数据处理
试验数据均以平均值±标准差表示,用SPSS19.0软件进行相关性检验、方差分析和LSD多重比较,以P<0.05表示有显着性差异。
2 结果
2.1 温度和盐度与时间的关系
试验自2013年3月18日至2013年4月23日止,共36d。试验结果见图1。
2.2 水质
2.2.1 NH+4-N不同换水频次对水中NH+4-N的影响见图2。
由图2可见,未换水组中,NH+4-N含量均比其他换水组高,且差异极显着(P<0.01),3d换水组和5d换水组差异不显着(P>0.05),由NH+4-N在水体中含量来看,水质最好的是3d换水组。【1-2】
2.2.2 NO-2-N不同换水频次对仿刺参幼参养殖水中NO-2-N含量影响的结果见图3。由图3可见,未换水组中 ,NO-2-N含量均 极显着高于 其 他 各 换 水 组 (P<0.01),NO-2-N含量上来看,3d换水组效果最好。其中3d换水频次和5d换水频次对水中NO-2-N含量影响不显着(P>0.05),从经济成本考虑,5d换水频率较为实际。【3】
2.2.3 活性磷不同换水频次对活性磷影响的结果见图4。由图4可见,未换水组、8d、12d和15d换水组间活性磷的差异不显着(P>0.05);3d换水组和5d换水组间差异不显着(P>0.05),但是3d换水组活性磷含量极显着低于未换水组及8d、12d、15d换水组(P<0.01)。【4】
2.2.4 NO-3-N不同换水频次对硝酸盐的影响见图5。由硝酸盐的测定结果可见,未换水组>15d换水组>12d换水组>8d换水组>5d换水组>3d换水组,未换水组硝酸盐含量极显着高于其它各换水组 (P<0.01),3d、5d和8d各换水组间差异不显着(P>0.05),5d、8d和12d各换水组间差异不显着(P>0.05),12d和15d换水组差异不显着(P>0.05);3d换水组中硝酸盐的含量高于12d和15d换水组,且差异极显着(P<0.01)。
2.3 生长指标
各试验组幼参成活率显着不差异(P<0.05),特定增长率各试验组均较未换水组差异显着(P<0.05),3d与5d换水组差异不显着(P>0.05),3d与12d及15d换水组间差异显着(P<0.05)(表1)。综合水质和生长指标考虑,试验设定范围内,选择5d换水是最佳的换水频次。【5】
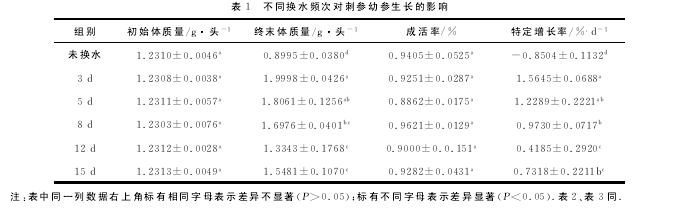
2.4 氮、磷收支
在使用微生态制剂情况下,不同换水频次下氮、磷输入见表2。氮输入量依次为:饲料(66.3%~74.5%)>仿刺参幼参(24.9%~28.5%)>海水(0.6%~6.7%),由于换水频次的不同,输入氮主要的差别在于海水,饲料中氮占主要输入氮。磷输入量:饲料(95.7%~96.6%)>仿刺参(3.3%~4%)>海水(0~0.3%),饲料中磷输入差异不显着(P>0.05),海水中磷含量较少,只有3d和5d换水组与其他组差异显着。【6】
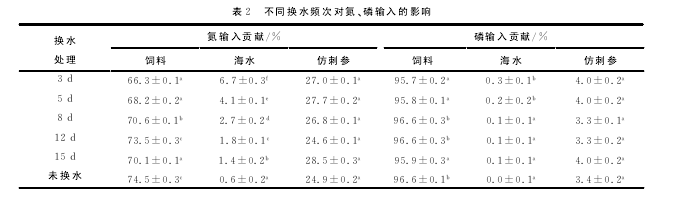
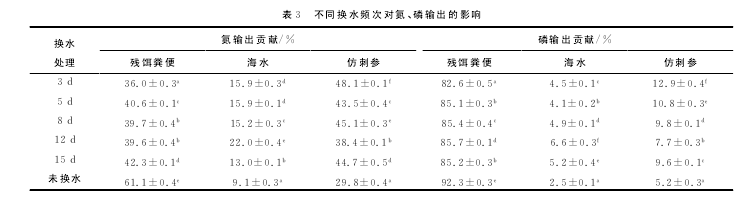
不同换水频次下氮、磷的输出量见表3。在未换水情况下,残饵粪便中的氮输出61%,比其他处理组差异极显着(P<0.01),与其他处理组相比,残饵粪便氮输出是最主要的输出。但是在换水的情况下,氮 输出主要 集中在 仿 刺 参 上,占 总 氮 输 出38.4%~48.1%,残饵粪便占总氮输出36.6%~42.3%,海水占总氮输出13.0%~22.0%。在总磷输出方面,残饵粪便(82.6%~92.3%)>仿 刺 参 (5.2% ~12.9%)>海 水 (2.5% ~6.6%)。【7】
3 讨论
3.1 换水频次对水质的影响
本试验中,1~10d,未换水组NH+4-N的含量与其他各试验组组差异不显着(图2),10d以后,不同换水频次的试验组间水质差异越来越大,由图3可见,1~15d,未换水组NO-2-N与其他各试验组组间差异不显着,15d以后,不同换水频次的试验组间水质差异越来越大。说明微生态制剂对NH+4-N的调控在10d以内,对NO-2-N的调控在15d以内,本试验所用的微生态制剂以乳酸菌为主,对降解水体中的NH+4-N和NO-2-N有很好的调控作用。随着养殖时间的延长,水体中的残饵粪便积累,15d后未换水组的水质越来越差,NH+4-N和NO-2-N持续升高,加入微生态制剂并不能起到作用,此结果与沈南南等[15-16]的研究结果类似。
本试验中,3d及5d换水组NH+4-N和NO-2-N比较稳定,8d、12d及15d换水组与3d、5d换水组差异显着(P<0.05),说明加入微生态制剂后,3d和5d换水一次能够保持仿刺参幼参养殖水质不受影响。
从硝态氮和活性磷比较可以看出,换水频次越低,硝态氮和活性磷的积累就越多。加入微生态制剂并未改变仿刺参幼参养殖水体中硝态氮和活性磷的积累。虽然硝态氮和活性磷对刺参幼参无显着影响,如长期不换水,硝态氮和活性磷累积在水体中,可分解转化为NH+4-N和NO-2-N,间接对仿刺参幼参的生长造成影响。因此,在室内培育刺参幼苗的时候,在定期添加微生态制剂的情况下,还需定期3d或5d更换一次育苗用水,才能保证育苗水质维持在一个稳定的状态,保证幼参的健康生长。
3.2 换水频次对刺参幼参生长性能的影响
由本试验的不同换水频次对仿刺参幼参生长的影响可以看出,加入微生态制剂并未对仿刺参幼参的成活率产生影响。由于微生态制剂能够分解有机质、提供菌体蛋白作为营养[17],同时本试验所用的乳酸菌制剂长期使用,能够提高水产动物体内的乳酸菌含量,达到稳定并在肠道内定殖[18],改变肠道内微生物环境,并影响消化酶的分泌[6],进而提高水产动物的生长性能。在本试验中,未换水组由于后期残饵粪便增多,水质恶化,严重影响了仿刺参幼参的生长,以至出现负增长。其他各换水组,幼参的特定生长率3d换水组>5d换水组>8d换水组>15d换水组>12d换水组,特定生长率增加0.41%/d~1.56%/d,王国霞等[19]在使用乳酸菌制 剂,样 本 量 为30尾 的 情 况 下 凡 纳 滨 对 虾(Litopenaeo vannamei)幼虾的特定生长率为2%/d~3%/d;袁成玉等[6]使用微生态制剂,在样本量为55头时仿刺参幼参的特定生长率为4%/d~5%/d。本研究当中,采用的样本量为400g/桶,养殖水体为300L,相比之下特定生长率较低。养殖密度有所不同是最大的原因,养殖密度限制了仿刺参的生长。在此情况下,3d和5d换水组特定生长率差异不显着,考虑到生产过程中换水成本的因素,故5d换水一次是最佳的换水频次。
3.3 换水频次对氮、磷输入的影响
从本试验可以看出,不同的微生态制剂在不同含量下,仿刺参的成活率差异不显着(P>0.05),特定生长率却显着差异(P<0.05)。在氮、磷输入上,由于是室内养殖,系统比较单一,不及养殖池塘的养殖环境复杂,故饲料中的氮、磷输入占最大比例,分别为66.3%~74.5%,95.7%~96.6%。由于换水频次的不同,且海水中含氮较多,含磷较少。在氮输入比较上,各组差异显着(P<0.05),磷输入上差异不显着(P>0.05)。刘峰等[20]研究池塘养殖仿刺参时发现,换水是氮、磷输入的主要途径。李玉全等[21]研究了对虾的养殖密度,饲料是养殖系统氮、磷输入的主要途径。可见,环境不同,氮、磷的输入有很大差异。
3.4 换水频次对氮、磷输出的影响
换水频次对氮收支的影响,从本试验的结果比较得知,养殖系统中,饲料中的总氮逐步转化为海水和仿刺参的氮,在不同的换水频次下,氮转化率不同,换水频次较高时,饲料中氮转移到仿刺参中效率就较高。孟雷明等[22]研究盐度对刺参碳、氮收支的影响,刺参摄取的氮主要消耗在粪便中,其次是代谢消耗,用于生长的氮最少。与本试验类似,本试验残饵粪便中的输出氮占主要比例。
关于总磷的输出贡献,残饵粪便占总磷输出最主要的部分,在未换水的情况下,残饵粪便中含磷达92.3%,转化到海水和仿刺参中的磷量相比各试验组来说要少,且差异极显着(P<0.01)。换水频次越大,转化到仿刺参中的磷越多,3d换水一次的仿刺参含磷多且高达12.9%。反之,转移到水中的磷较少。
4 总结
综上所述,在使用微生态制剂的情况下,换水频次为3d和5d的换水组对仿刺参养殖水质和幼参的生长有显着作用,且氮、磷转化效率较高。考虑到生产成本的因素,故选择5d换水一次为最佳的换水频次。本研究中,由于养殖密度与以往的研究不同,故而在以后研究微生态制剂的同时应考虑到刺参的养殖密度、养殖规格、养殖种类等,建立一套合理的健康养殖体系,为生产实际提供更有力的参考依据。





