
1 前言
泛素因标记被26S蛋白酶体降解的蛋白质而着名,其在真核生物中是普遍存在,具有很高的保守性的一种蛋白质。泛素化修饰即一个或多个泛素分子在一系列酶的作用下与底物蛋白质分子共价结合的翻译后修饰过程。现在发现,泛素的作用已不仅仅介于参与蛋白质降解的这个作用,构成泛素一蛋白酶体系统,其还参与了多种重要的细胞调控过程。近年来,随着越来越多泛素化修饰相关的蛋白质组学数据不断产生,对于泛素化修饰位点的研究也越来越多,主要是围绕泛素化修饰蛋白数据库的建立、泛素化修饰网络的构建和分析以及泛素化修饰位点的预测。泛素化系统异常可能涉及疾病的发生和发展。研究显示,泛素化途径的更改涉及几种疾病如癌症和神经退行性紊乱的发病机理。本文就泛素化位点单核普酸多态性对靶蛋白的影响的研究进行综述,从而从基因水平来展望因为单核昔酸多态性而引起的与泛素化过程有关联的疾病的治疗。
2 概述
在真核生物中,泛素(ub)为一种由76个氨基酸组成的高度保守的多肤,因其广泛分布于从酵母到人类各类细胞而得名U1.其传统的作用为其C端的Gly残基与将被26S蛋白酶体降解的靶蛋白切s残基共价结合,由Ub激活酶(E1), Ub结合酶(E2)和Ub连接酶(E3)级联催化而完成,该蛋白质降解途径具有依赖ATP、高效、高度选择性的特点.另外其还具有很多非泛素化降解功能,包括DNA损伤修复、信号转导、转录调节、胞吞作用和蛋白激酶活化等目前泛素化修饰的研究成为热点,主要体现为:
(1)泛素化修饰底物蛋白数据的收录。随着世界范围内泛素化修饰相关的研究报道越来越多,泛素一蛋白酶体系统相关蛋白质数据不断产出,对这些数据进行合理组织、储存、呈现以及更新就显得很有必要,这也为我们后面的研究提供了有力的数据支持,例如UbiProthUbiquitome等: (2)泛素化网络的构建和分析。泛素化修饰网络可被描述为参与泛素化及其后续降解过程的包括泛素、类泛素蛋白质,会发生泛素化修饰底物蛋白,关键酶以及蛋白酶体构成的系统。例如Venancio et al.构建的综合性的泛素化修饰网络: (3)泛素化修饰位点的预测。鉴于传统的得到泛素化位点的方法是在实验的基础上,这种成本较高而且时间较长,鉴定出来的位点有限,因此国内外的很多学者采用生物信息学方法来研究以便获得更多未知靶蛋白的泛素化位点,并且都取得了一定的成果,例如Chun Wei et al.开发出来的UbiPred; (4)泛素化修饰motif的研究。作为一种翻译后修饰的方式,对其修饰motif的寻找是一个非常有意义的方向。在Gygi et al.的研究中,证实泛素化修饰位点处并不存在motif特征,但是其附近的氨基酸表达呈现出一定的趋势,即泛素化修饰位点处倾向于呈现局部的净负电荷。虽然现在还没有非常理想的结果,但是该方面的尝试还会继续下去。
3 基于单核普酸多态性的泛素化位点的研究
单核昔酸多态性,即在基因组水平上由单个核昔酸的变异而引起的DNA序列多态性变化,具体是指在DNA序列中的单个碱基的变异。其分为2种,其中研究的最多的是会引起翻译后的氨基酸序列发生改变的错义突变(Non-single nucleotide polymorphisms, nsSNPs)。错义突变是造成人类遗传疾病的主要原因。在泛素化修饰过程中,泛素化修饰位点即靶蛋白上特定的Lys残基显得尤为重要,对其的了解可以扩展人们对泛素的认识,有助于对多种细胞过程的深入理解,也有助于筛选相关疾病的新靶点和新药。近来,越来越多的研究表明nsSNPs可以间接或者直接的破坏最初的泛素化位点或者是创建新的泛素化位点。例如,人类ERCC2(LTniprot AC: P18074)如果发生K751Q的单核昔酸突变(dbSNP ID: rs13181),将会造成该处的泛素化位点的丢失,影响DNA修复的功能,造成癌症的发生;人类SOX9(LJniprot AC: P48436)如果发生K173E的单核昔酸突变(dbSNP ID : rs104894647),该泛素化位点位于DNA连接域HMG,其的缺失将导致躯干发育异常(CD).因此,关于造成蛋白质泛素化修饰发生改变的nsSNPs的广泛研究有利于进一步理解遗传多态性是如何参与调节生物途径和过程,对疾病易感性的影响,个体之间表型的差异以及对药物的反应。
胞内许多蛋白质的功能也是通过动态的蛋白质翻译后修饰来调节的。蛋白质的翻译后修饰发生异常将直接影响蛋白质功能的执行,从而引发相应的疾病产生。己有研究将蛋白质的翻译后修饰位点与单核昔酸多态性联系起来从基因水平上来阐述疾病的产生,从而为因nsSNPs而引起的有关联的疾病的治疗提供一个新的视角。例如己有研究将翻译后修饰位点(例如磷酸化位点与糖基化位点)与nsSNPs联系起来通过生物信息学方法来进行研究分析。因此,通过生物信息学的方法来研究更多泛素化位点的nsSNPs具有重要现实意义。
目前很多国内外的学者在预测与疾病相关的nsSNPs方面己经取得了一定的成果。例如Prateek Kumar et al.使用基于序列同源的算法来对氨基酸替换进行分类,其预测与疾病相关的nsSNP:的准确率达到了69%;Zhi-Qiang Ye et al.在序列的基础上加入的结构方面的特征来进行预测,其准确率达到了82.6,还有的学者加入了功能方面或者蛋白网络结构方面的因素.在本研究中,我们将借鉴他们的方法来研究造成蛋白质泛素化修饰发生改变的nsSNPs 。
3.1 氨基酸残基频率和保守性
通过前面学者的研究,证明突变前和突变后氨基酸残基在同源蛋白序列中可观察到的频率差异是一个很有力的特征.差值越大,表明该nsSNPs更有可能是有害的或者与疾病相关的。同时,如果一个特定蛋白中处于一个特定位置的氨基酸残基是保守的,表明该氨基酸残基可能位于该蛋白的一个很重要的位置或者是功能域中,那么它的单核昔酸突变可能会造成蛋白质结构和功能的显着改变。序列中某个位置的保守性分数被定义为在多重序列比对中这个位置的氨基酸残基频率分布的含量。研究显示在多重比对中如果一个nsSNPs以很低的频率处于一个高度保守的位置,那么很有可能是与疾病相关的。【1】
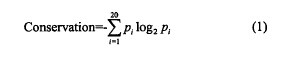
P,代表残基类型i的频率。保守性分数范围从。到4.32,值越小,这个位置越保守。
3.2 氨基酸残基的理化性质
氨基酸的理化特性对于研究蛋白质的结构和功能具有重要的作用。AAIndexlzz〕就是研究人员通过大量的实验和理论研究确定的一些氨基酸的理化特性构成的数据库,其包含氨基酸残基或者是氨基酸对的各种物化和生化特性。Atchley等人在AAIndex的基础上产生T一个关于氨基酸残基变异高维数字模型。氨基酸残基的这些高维属性被总结并转换成5个多维模型,来反映氨基酸残基的极性、二级结构、分子体积、密码子多样性和静电电荷。
3.3 蛋白质稳定性
研究表明,与疾病相关的nsSNPs例子中80%以上会造成蛋白质结构的不稳定。蛋白质稳定性依赖于折叠状态因和展开状态(仍时自由能的差值。【2-3】

ΔΔG为突变前面蛋白质稳定性的变化,j为突变前的氨基酸残基,k为突变后的氨基酸残基。一个nsSNPs如果改变了一个蛋白质的稳定性,那么很可能会造成对其功能的影响。相对的,如果一个会发生单核普酸突变的靶蛋白变得不稳定,那么其突变后构造的结构模型比起原始的结构模型的能量值将增加.因此在研究中靶蛋白的结构稳定性的前后改变差异也可以作为一个研究的方面。
3.4 溶剂可及性
蛋白质溶剂可及性是描述蛋白质疏水性的重要手段,蛋白质分子中残基的疏水性是影响蛋白质折叠的重要物理作用,并对蛋白质的空间构象以及构象的柔性有重要的影响。因此在研究中溶剂可及性也是不可缺少的方面。一般将溶剂可及性分为三类的研究中显示,当靶蛋白的结构可知时,加入nsSNPs处的结构特征(二级结构和溶剂可及性),与疾病相关的nsSNPs和中性的nsSNPs的在三态中的分布将出现很大的差别,可以很好的区分出来。在Zhi Qianget al.的研究中还分别计算了所有原子、整个侧链、主链、非极性侧链和极性侧链的相对溶剂可及性。而在Nathan O. Stitziel et a1.的研究中,使用了一个新的特征,即几何位置特征。他们将每个nsSNPs在蛋白质结构中的位置分为三类,如图1:处于口袋或者一个空隙中(类型P);处于凸区域或浅的凹陷区域(类型S);在内部完全被埋没(类型D.研究中显示与疾病相关的nsSNPs的几何位置更倾向于类型P和S,并且在类型I中分布最少。【图1】

这可能是因为埋藏在蛋白质中的氨基酸残基不容易被分子识别,并且这些位置上的突变并不直接影响蛋白质的连接,而处于表面的氨基酸残基更容易参与蛋白质的功育。
3.5 二级结构
蛋白质在形成立体结构时,其多肤链部分首先折叠成a一型螺旋(a -helix)和p一型(P -sheet)等蛋白二级结构,并由此进一步可折叠成球形或其他形状。二级结构对整个蛋白折叠的稳定性起着非常重要的作用,进而进一步影响其功能。有文献表明,泛素化连接酶易出现在无规则卷曲或是螺旋结构区域,而非泛素化位点没有明显的二级结构倾向性。在Sunyaev Set al.的研究中发现,与疾病相关nsSNPs更倾向于分布在溶剂可及性<5%或者日折叠。
3.6 序列派生信息
Jing Hu et al.在其研究中指出,如果蛋白质的结构文件得不到,那么利用结构特征的分析就是无效的,因此他们只采用了序列派生信息来进行分析。在其研究中一开始采用了686个序列派生信息,然后使用贪心算法对其进行筛选,最后得到了10个特征,分别为:包含nsSNPs的靶蛋白是否属于HLA家族、突变氨基酸残基频率和野生氨基酸残基频率的归一化差值、该nsSNPs位点与其最近的功能性位点之间的序列距离等。
在研究中,还有很多学者加入了Swiss-prot数据库中标注的功能性信息。当一个nsSNPs的位置是处于一个功能性域或是功能性位点周围,那么nsSNPs就很有可能是与疾病有关联。泛素化位点作为翻译后修饰位点,其作用尤为重要,泛素化修饰还与磷酸化修饰等其他修饰有关联。
3.7 蛋白质细胞内定位
一般来讲,蛋白质在合成之后并经过一定的修饰(例如泛素化、糖基化、乙酞化和磷酸化),通常会定位到细胞的某些特定的区域才会发挥其特定的功能,例如激素受体必须进入细胞膜中才能识别相应的激素;RNA和DNA聚合酶必须送到细胞核中才能参与核酸的合成。具有不同理化性质的细胞器内环境也会选择性的容纳不同的结构和表面性质的蛋白。蛋白质的亚细胞定位与其功能之间存在着十分重要的联系。最初认为泛素化系统只能降解细胞质中的蛋白质,后来发现,泛素化修饰作用贯穿于整个细胞的质膜系统,从细胞膜、内质网到核膜等等。
3.8 功能性分析
己经有研究表明,泛素化的修饰作用已不仅仅局限于介导蛋白质的降解,还可以直接影响蛋白质的活性和定位。蛋白质修饰及降解贯穿几乎所有细胞活动,包括基因表达、细胞增殖、分化、衰老、凋亡和自噬,也调控着个体的生长、发育和衰老。由于底物蛋白广泛存在于细胞中,泛素化修饰调控的细胞活动主要包括细胞周期、细胞凋亡、转录调控、DNA损伤修复及免疫应答等。
4 问题与展望
泛素化广泛参与翻译后修饰以调节细胞过程,因此,泛素化系统失常将导致疾病或恶性肿瘤。通过nsSNPs对靶蛋白泛素化位点的研究将从遗传的角度来理解和治疗由泛素系统紊乱而引起的各种疾病,将具有十分重要的意义。随着实验鉴定出来的泛素化位点的不断增加和因基因测序而得到的越来越多的nsSNPs,我们可以得到更多的因单核昔酸多态性而造成突变的泛素化位点,这样我们就可以更好的预测哪些泛素化位点的突变是与疾病相关的,从而从遗传的角度上为相关疾病的治疗提供一个新的视角。





