摘 要: 目的 构建人CD147胞内结构域(CD147 intracellular domain,CD147ICD)融合蛋白质粒,表达、提取、纯化CD147ICD蛋白并进行蛋白质互作分析。方法 将CD147ICD的c DNA片段插入pET-32a(+)质粒载体后,转化大肠杆菌Origami B(DE3)感受态细胞,大量培养后用异丙基硫代-β-d-半乳糖苷诱导蛋白表达,超声破碎法裂解细胞,采用Ni-Sepharose FF预装柱纯化TrxA-His6-CD147ICD融合蛋白,经凝血酶酶切、超滤后获得CD147ICD蛋白。结果 CD147ICD融合蛋白质粒经测序比对后表明构建成功;采用Ni-Sepharose FF预装柱纯化的TrxA-His6-CD147ICD融合蛋白纯度和浓度均较高,经凝血酶酶切、超滤后获得的CD147ICD蛋白纯度在95%以上,蛋白浓度为0. 74 mg/m L。结论 纯化出了高纯度的、具有生物学活性的CD147ICD蛋白,为CD147ICD互作分子的鉴定及结构解析奠定了基础。
关键词: CD147; 胞内结构域; 表达与纯化;
Abstract: Objective To express and purify the recombinant intracellular domain of human CD147( CD147ICD) and to study the interacting proteins of CD147ICD. Methods cDNA of CD147ICD was ligated into pET-32a( +) plasmid vector,then transformed into E. coli Origami B(DE3) competent cells and the transformants were induced with isopropyl-β-d-thiogalactoside. The fusion proteins were purified with Ni-Sepharose FF column in combination with thrombin digestion and ultrafiltration. Results The recombinant plasmid was confirmed with sequencing. Purified TrxA-His6-CD147 ICD protein was obtained with Ni-Sepharose FF column. After thrombin digestion and ultrafiltration,the purity of CD147ICD protein was above 95%,and the protein concentration was 0. 74 mg/m L. Conclusion CD147ICD protein was purified with high purity and activity,which would provide a basis for the future studies on characterization of CD147 ICD interacting proteins and structure determination.
Keyword: CD147; Intracellular domain; Expression and purification;
CD147是Ⅰ型跨膜蛋白,属于免疫球蛋白超家族。CD147在正常组织及胚胎组织中低表达,在上皮来源的癌组织中高表达,与肿瘤发生发展密切相关,是一个癌特异性的、新型广谱的肿瘤标志物[1]。诱导肿瘤细胞以及成纤维细胞分泌基质金属蛋白酶(matrix metalloproteinases,MMPs)是CD147最主要的功能之一[2],体内外实验表明,CD147能够促进肿瘤的侵袭和转移[3]。研究证实,CD147能够调节肿瘤细胞间充质样运动形式和阿米巴样运动形式的转换[4,5],调控肿瘤细胞的代谢和自噬[6,7]。此外,多发性骨髓瘤细胞表面的CD147能够作为骨髓内皮细胞分泌的亲环素(cyclophilin A,CyPA)的受体促进多发性骨髓瘤细胞增殖和归巢[8],胰腺癌细胞表达的CD147与Cy PA结合能够促进胰腺癌进展[9],但是CD147诱导MMPs分泌、调控肿瘤侵袭转移的分子机制尚未阐明,尤其是CD147胞内结构域(CD147intracellular domain,CD147ICD)的生物学功能和分子机制鲜见报道。
CD147分子全长269个氨基酸,N端21个氨基酸为信号肽,参与CD147分子的生物合成和转运,信号肽之后的185个氨基酸为胞外段,接下来的24个氨基酸为跨膜区,胞内结构域由C端39个氨基酸构成。CD147胞外段包含2个Ig样结构域,N端为C2结构域(2~101位氨基酸),C端为I样结构域(107~205位氨基酸),2个Ig样结构域之间由5个氨基酸连接。CD147跨膜区序列在人、小鼠和鸡之间完全保守,提示跨膜区有重要生理功能。CD147ICD在种属之间也高度保守,提示胞内结构域可能参与介导细胞外信号向细胞内的传递[10]。本实验室先后解析了CD147胞外段2.0?晶体结构[11]和CD147胞外段与Cy PA相互作用的液相结构[12],但CD147ICD的互作分子及蛋白质结构知之甚少。本研究通过构建CD147ICD重组质粒并制备纯化CD147ICD,为CD147ICD互作分子的鉴定和蛋白质结构解析提供研究基础。

1 、材料与方法
1.1、 材料
Premix PrimeSTAR DNA聚合酶、DNA限制性内切酶、连接酶购自宝日医生物技术(北京)有限公司;DH5α、Origami B(DE3)感受态细胞购自天根生化科技(北京)有限公司;二硫苏糖醇(dithiothreitol,DTT)、异丙基硫代-β-d-半乳糖苷(isopropyl-β-d-thiogalactoside,IPTG)购自美国Sigma公司;蛋白酶抑制剂购自瑞士罗氏公司;凝血酶购自Solarbio公司;Ni-Sepharose FF预装柱购自美国GE公司;引物由华大基因合成;3 KD超滤管、10 KD超滤管购自美国Millipore公司;BCA蛋白质定量试剂盒购自美国Pierce公司;其他试剂均购自生工生物工程(上海)股份有限公司。
1.2、 重组质粒的构建和鉴定
以人cDNA为模板,PCR扩增CD147ICD片段(上游引物:5'-TGGGTAC-CATGAAGCGCCGGAAGCCCGAG-3',下游引物:5'-CAGATATCTCAGGAAGAGTTCCTCTGGC-3';反应条件:98℃10 s,68℃10 s,30个循环),经KpnⅠ/EcoRⅤ双酶切后连接入pET-32a(+)质粒,将连接混合物转化DH5α感受态细胞,挑取克隆后进行测序分析。取10 ng重组质粒pET-32a(+)/CD147ICD转化Origami B(DE3)感受态细胞,挑取克隆经酶切鉴定后冻存保种。
1.3、 蛋白的表达和纯化
接种5μL pET-32a(+)/CD147ICD/Origami B菌液至5 m L Amp+/Kan+/Tet+LB培养基中,37℃振荡培养过夜。转接5 m L培养过夜的pET-32a(+)/CD147ICD/Origami B菌液至500 m L Amp+/Kan+/Tet+LB培养基中,37℃振荡培养6~7 h后(OD600=0.6),加入500μL 1 mol/L IPTG,37℃振荡培养2~5 h。6 000 r/min离心6min收集菌体,Ni-NTA A液重悬洗涤1次,-80℃冻存。室温融解菌泥,加入8 m L含蛋白酶抑制剂的Ni-NTA A液,振荡重悬。冰浴超声裂解细胞,300W,5 s/10 s,30 min。12 000 r/min 4℃离心15 min,取上清。采用快速蛋白液相色谱系统AKTA FPLC GE-048,Ni-Sepharose FF预装柱进行蛋白纯化,流速1 m L/min,30 min梯度洗脱,洗脱峰用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulphatepolyacrylamide gel electrophoresis,SDS-PAGE)鉴定组分和纯度。采用凝血酶20℃酶切过夜,经10 KD超滤管去除凝血酶后,用3 KD超滤管换液并浓缩目的蛋白。采用SDS-PAGE鉴定CD147ICD蛋白纯度。
2 、结果
2.1、 CD147ICD重组质粒的DNA测序
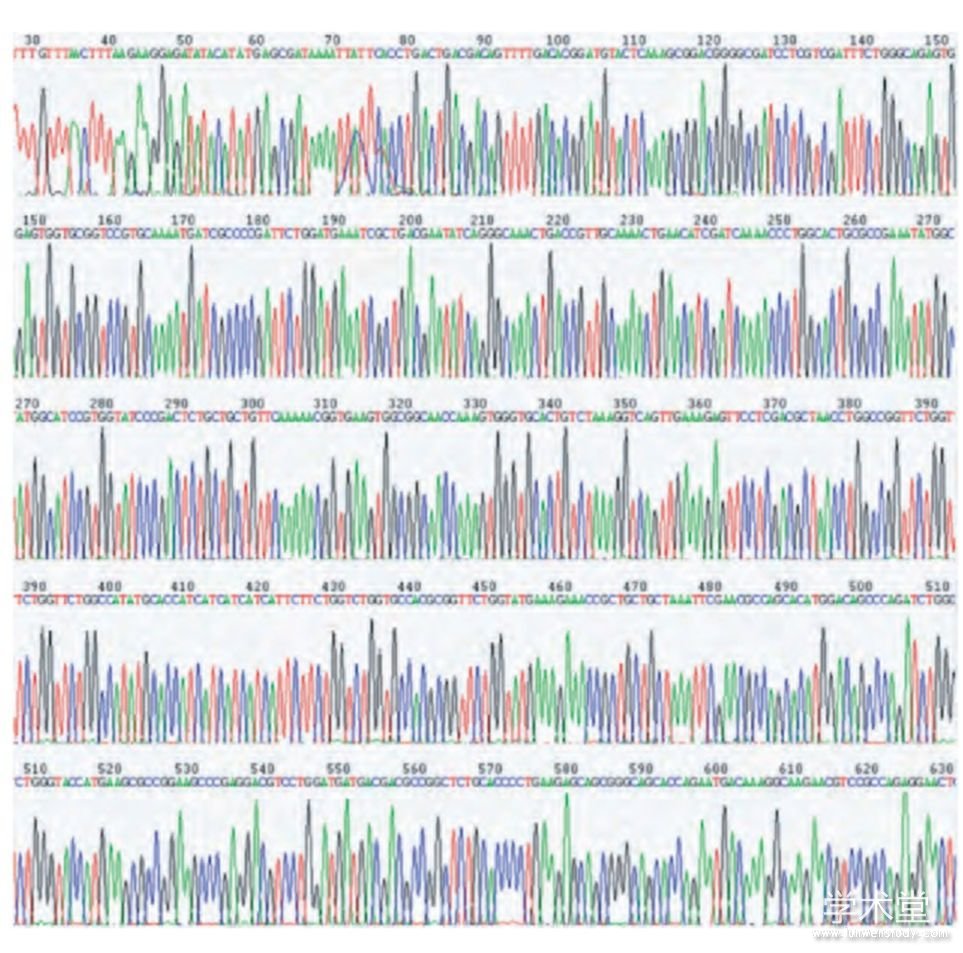
提取p ET-32a(+)/CD147ICD质粒(图1),经KpnⅠ/EcoRⅤ双酶切后在100 bp DNA ladder上方可见较弱的CD147ICD基因片段,大小符合预期(图2);测序结果如图3,经序列比对,插入序列正确,无碱基突变和移码突变,证明CD147ICD重组质粒构建成功。
图1 琼脂糖电泳鉴定p ET-32a(+)/CD147ICD质粒
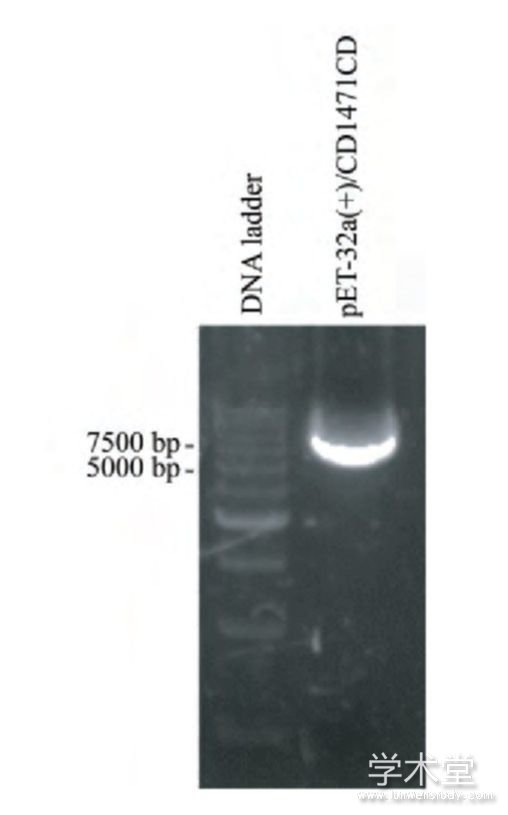
图2 酶切鉴定p ET-32a(+)/CD147ICD质粒
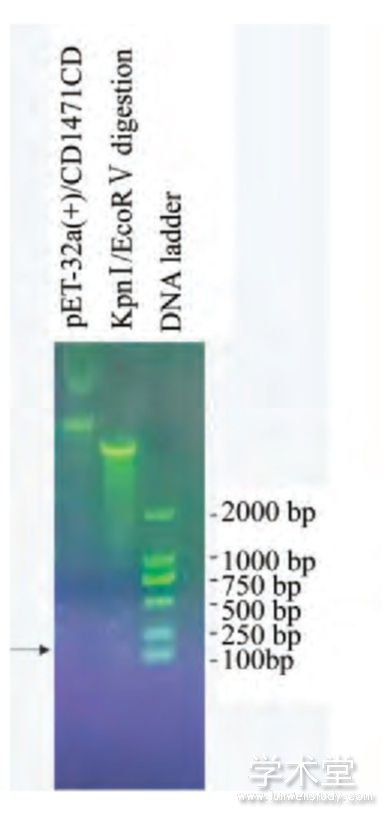
图3 DNA测序鉴定重组质粒
2.2、 Trx A-His6-CD147ICD融合蛋白的表达和纯化
经ExPASy在线工具预测TrxA-His6-CD147ICD融合蛋白的分子量是20.93 KD。采用37℃,1 mmol/L IPTG分别诱导2、3、4、5 h。SDS-PAGE电泳结果显示,与未诱导组相比,IPTG诱导2 h后重组菌即可大量表达分子量约为20 KD的目的蛋白(图4)。经超声破碎裂解,高速离心后取上清进行Ni2+亲和层析,纯化得到重组TrxA-His6-CD147ICD蛋白。
2.3、 酶切、纯化CD147ICD蛋白
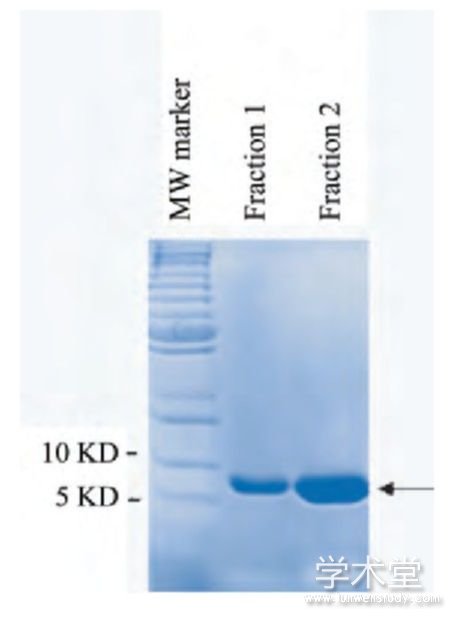
经ExPASy在线工具预测,凝血酶酶切后CD147ICD融合蛋白的分子量是7.01 KD。采用凝血酶20℃酶切过夜后,经10 KD超滤管去除凝血酶,用3 KD超滤管换液并浓缩CD147ICD蛋白。SDS-PAGE电泳结果显示,纯化后的CD147ICD蛋白在预期分子量7 KD处可见特异性条带,蛋白纯度在95%以上(图5)。采用BCA蛋白定量试剂盒测定纯化后的CD147ICD蛋白浓度,经计算其蛋白浓度为0.74 mg/m L。
图4 SDS-PAGE鉴定Trx A-His6-CD147ICD融合蛋白的表达水平
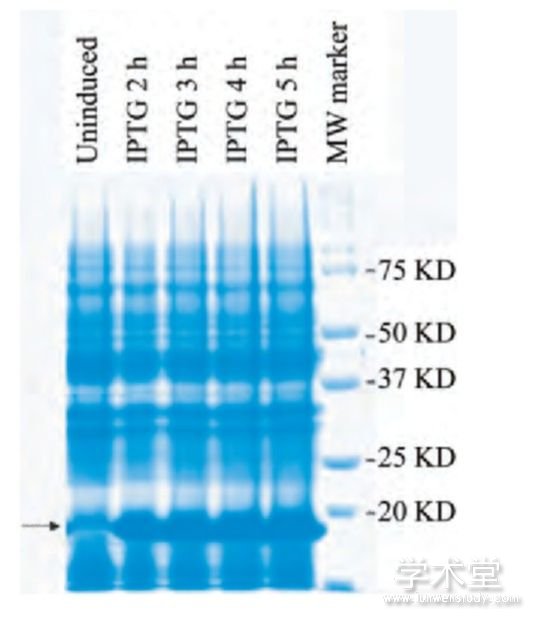
图5 SDS-PAGE鉴定纯化的CD147ICD蛋白
3、 讨论
肿瘤相关抗原CD147在肺癌、肝癌等恶性肿瘤组织中高表达,靶向CD147的肝癌抗体药物“利卡汀”已批准上市,取得了良好的治疗效果[13]。本实验室前期的研究发现,CD147能够负性调控NO/cGMP介导的细胞钙内流,促进MMP2和MMP9的分泌和活化,继而促进了肿瘤细胞的侵袭和转移,上述作用需要该分子胞内外结构的完整性,其中缺失胞内结构域的CD147对肝癌细胞MMPs分泌、侵袭的调控功能缺失[14],提示CD147ICD在促进MMPs分泌、调控肿瘤侵袭和转移中也发挥重要作用。Hibino等[15]研究发现,S100A9能够结合于黑色素瘤细胞表面的CD147,促进CD147ICD募集TRAF2,进而促进Cdc42活化和肿瘤侵袭转移,但是CD147与其配体S100A9结合后是如何调控其胞内段募集TRAF2的仍不清楚[16]。目前,针对CD147分子的研究主要集中于胞外段,CD147ICD参与信号转导的分子机制尚不明确,CD147ICD的互作分子鲜见报道。缺乏高纯度的CD147ICD蛋白是制约CD147ICD互作分子鉴定及蛋白质结构解析的重要因素。本研究采用大肠杆菌表达系统对CD147ICD实现高效表达,制备纯度较高的CD147ICD蛋白,为后续制备CD147ICD单抗或多抗、筛选CD147ICD互作分子、解析CD147ICD结构提供基础。
利用PCR扩增得到全长为117 bp的CD147ICD基因,将其连接到p ET-32a(+),获得p ET-32a(+)/CD147ICD重组质粒,将其转化Origami B(DE3)感受态细胞,重组菌能够表达20.93 KD的TrxA-His6-CD147ICD融合蛋白,利用Ni-NTA亲和层析法纯化后,采用凝血酶酶切去除TrxA-His6标签,获得纯度约为95%的CD147ICD蛋白,蛋白浓度为0.74 mg/m L。
参考文献
[1] Xin X,Zeng X,Gu H,et al. CD147/EMMPRIN overexpression and prognosis in cancer:a systematic review and meta-analysis[J].Sci Rep,2016,6:32804.
[2] Grass GD,Toole BP.How,with whom and when:an overview of CD147-mediated regulatory networks influencing matrix metalloproteinase activity[J]. Biosci Rep,2015,36(1):e00283.
[3] Weidle UH,Scheuer W,Eggle D,et al.Cancer-related issues of CD147[J]. Cancer Genomics Proteomics,2010,7(3):157-169.
[4] Zhao P,Zhang W,Wang SJ,et al. HAb18G/CD147 promotes cell motility by regulating annexinⅡ-activated Rho A and Rac1 signaling pathways in hepatocellular carcinoma cells[J].Hepatology,2011,54(6):2012-2024.
[5] Wang SJ,Cui HY,Liu YM,et al.CD147 promotes Src-dependent activation of Rac1 signaling through STAT3/DOCK8 during the motility of hepatocellular carcinoma cells[J].Oncotarget,2015,6(1):243-257.
[6] Li J,Huang Q,Long X,et al.CD147 reprograms fatty acid metabolism in hepatocellular carcinoma cells through Akt/m TOR/SREBP1c and P38/PPARalpha pathways[J]. J Hepatol,2015,63(6):1378-1389.
[7] Wu B,Cui J,Yang XM,et al. Cytoplasmic fragment of CD147 generated by regulated intramembrane proteolysis contributes to HCC by promoting autophagy[J].Cell Death Dis,2017,8(7):e2925.
[8] Zhu D,Wang Z,Zhao JJ,et al.The cyclophilin A-CD147complex promotes the proliferation and homing of multiple myeloma cells[J].Nat Med,2015,21(6):572-580.
[9] Li L,Tang W,Wu X,et al. HAb18G/CD147 promotes p STAT3-mediated pancreatic cancer development via CD44s[J].Clin Cancer Res,2013,19(24):6703-6715.
[10] Miyauchi T,Masuzawa Y,Muramatsu T.The basigin group of the immunoglobulin superfamily:complete conservation of a segment in and around transmembrane domains of human and mouse basigin and chicken HT7 antigen[J]. J Biochem,1991,110(5):770-774.
[11] Yu XL,Hu T,Du JM,et al.Crystal structure of HAb18G/CD147:implications for immunoglobulin superfamily homophilic adhesion[J]. J Biol Chem,2008,283(26):18056-18065.
[12] Song F,Zhang X,Ren XB,et al.Cyclophilin A(Cy PA)induces chemotaxis independent of its peptidylprolylcistrans isomerase activity:direct binding between Cy PA and the ectodomain of CD147[J].J Biol Chem,2011,286(10):8197-8203.
[13] Bian H,Zheng JS,Nan G,et al.Randomized trial of[131I]metuximab in treatment of hepatocellular carcinoma after percutaneous radiofrequency ablation[J]. J Natl Cancer Inst,2014,106(9)pii:dju239.
[14] Jiang JL,Chan HC,Zhou Q,et al.HAb18G/CD147-mediated calcium mobilization and hepatoma metastasis require both C-terminal and N-terminal domains[J].Cell Mol Life Sci,2004,61(16):2083-2091.
[15] Hibino T,Sakaguchi M,Miyamoto S,et al.S100A9 is a novel ligand of EMMPRIN that promotes melanoma metastasis[J].Cancer Res,2013,73(1):172-183.
[16] Sakaguchi M,Yamamoto M,Miyai M,et al. Identification of an S100A8 receptor neuroplastin-beta and its heterodimer formation with EMMPRIN[J]. J Invest Dermatol,2016,136(11):2240-2250.





