
AIM2是近些年来新发现的一种模式识别受体(pattern recognition receptors,PRR),能够感受DNA病毒或细菌感染时释放到细胞浆的dsD-NA[1],通过其C末端HIN-200区识别dsDNA后,其N末端的pyrin区与ASC的N末端的pyrin区结合,而ASC的C末端的CARD与Caspase1前体的CARD区结合,募集Caspase1前体,形成dsDNA-AIM2-ASC-Caspase1炎性复合体,即AIM2炎症小体,活化的Caspase1片段进而引起pyroptosis形式的细胞死亡,或裂解胞质内IL-1β前体和IL-18前体,促进IL-1β和IL-18的成熟和释放,从而诱发炎症反应[2]。AIM2也是唯一定位于细胞质的dsDNA感应蛋白[3]。放射治疗过程中,当细胞吸收一定的辐射能量后,射线都可能直接与细胞内的结构发生作用,直接或间接地损伤细胞DNA,导致细胞死亡。直接损伤主要由射线直接作用于DNA,引起DNA分子出现断裂、交联。
间接损伤主要由射线对人体组织间液发生电离,产生自由基,这些自由基再和生物大分子发生作用,形成不可逆损伤,导致细胞死亡。胸部肿瘤放射治疗过程中,由射线诱发的这些断裂的DNA片断是否也能被炎细胞中的AIM2识别并活化Caspase1,促进IL-1β和IL-18的成熟和释放,从而诱发放射性炎症反应呢?为了回答此问题,我们做了下述探索。
1材料与方法
1.1细胞株THP1细胞(人白血病单核细胞),来自武汉大学人民医院中心实验室。
1.2主要试剂引物由苏州金唯智公司合成,序列见表1;β-actin,AIM2抗体以及二抗,来自武汉三鹰生物技术有限公司;检测IL-1β的ELISA试剂盒,购自达科为生物技术有限公司;Caspase1活性检测试剂盒,购自碧云天生物技术研究所。

1.3细胞培养THP1细胞培养于RPMI1640培养基中,含10%胎牛血清和青霉素和链霉素,置于37℃、5%CO2培养箱,悬浮生长至一定浓度之后,接种于六孔板。
1.4细胞照射将THP1悬浮细胞充分混匀,尽量吹打成单个细胞的悬液,按照5×105/孔接种于6孔板,在Varian直线加速器下操作。选择SSD=1m,用6-MVX-线照射,剂量率600unit/min,各孔给予不同的照射剂量,剂量选择参照文献[4-5]。放入培养箱48h后做后续处理。
1.5RT-PCR总RNA的提取按照TRIzol试剂盒说明书进行。采用Fermentas公司的RevertAidFirstStrandcDNASysthesisKit做逆转录合成cD-NA。然后以cDNA为模板配置PCR反应体系,含2×PCRMasterMix,引物和水。
PCR反应条件为:94℃5min预变性,94℃变性30s,60℃退火30s,70℃延伸1min,Actin循环次数为20次,AIM2循环次数为25次。最后72℃延伸10min,4℃保存PCR产物。反应结束后,经1.1%的琼脂糖凝胶电泳,在BioRad凝胶成像系统下检测并分析PCR结果。
1.6westernblot取出6孔板,吸取各孔细胞到EP管,1800r/min离心5min后弃去培养基,用PBS洗一次,加入150μl/孔的RIPA裂解液(含1∶100PMSF和1∶100cocktail),冰浴30min之后,12000r/min离心15min,收集裂解液。吸取上清蛋白质备用。经BCA蛋白定量之后,按照1∶9比例与蛋白上样缓冲液混匀,经90~100℃处理5~10min让蛋白质变性。制作SDS-PAGE胶,下层为10%的分离胶,上层为5%的浓缩胶。
按照每孔蛋白总量一致的方式点样。电泳至溴酚蓝接近胶底。割掉多余的胶,转到PVDF膜,恒定电流200mA转膜1.5h。经TBST洗涤3次后,用脱脂牛奶封闭1h。一抗AIM2用TBST按照1∶1000稀释,actin按照1∶3000稀释,浸泡膜条,4℃过夜。二抗用稀释液按照1∶4000稀释,摇床孵育1h。然后洗膜,经ECL液暗室曝光,显影。
1.7ELISA吸取各孔培养基200μl/孔,1800r/min离心5min后,取上清。根据实验孔(空白和标准品)数量,确定所需的板条数目。加样:稀释后的细胞因子标准品按100μl/well加至标准品孔,样品按100μl/well加至样品孔,以dilutionbufferR(1×)为空白对照孔。加检测抗体:按50μl/well加入稀释的biotinylatedantibody。混匀后盖上封板膜,室温(18~25℃)孵育3h。洗板:去净孔内液体,加入1×washingbuffer,静置1min后弃去孔内液体。重复3次,每一次在滤纸上拍干。加酶标记物:按100μl/well加入Streptavidin-HRP。
贴上封板膜,室温(18~25℃)孵育20min。洗板:重复上述步骤。显色:按100μl/well加入TMB,室温(18~25℃)避光孵育5~30min,根据孔内颜色的深浅来判定终止反应。通常显色10~20min可以达到很好的效果。终止反应:按100μl/well迅速加入stopsolution,终止反应。
读板:终止后10min内,用检测波长450nm读值。
1.8Caspase1活性检测吸取细胞到对应的EP管,1800r/min4℃离心5min收集细胞,弃上清,PBS洗涤一次。按照每200万细胞加入100μl裂解液的比例加入裂解液,重悬沉淀,冰浴裂解15min。4℃16000~20000g离心10~15min。
收集上清到冰浴预冷的离心管中。按照试剂盒说明稀释pNA为6个不同浓度后绘制各孔A405标准曲线,每10μl待测样品加入10μl特异性底物Ac-YVAD-pNA(2mmol/L),加80μl检测缓冲液至总体积为100μl。空白对照孔为90μl检测缓冲液加10μlAc-YVAD-pNA(2mmol/L)。37℃孵育4~6h,等到有明显的颜色变化时,用酶标仪检测各孔A405值。样品A405值减去空白对照A405值即为样品中Caspase1催化产生pNA的吸光度。通过标准曲线对比即可计算出样品中催化产生pNA的量,从而计算Caspase1的催化活性。
1.9统计分析采用SPSS19.0软件进行统计分析,采用student’st检验,P<0.05则有显著性差异。
2 结果
2.1X线照射使AIM2在mRNA水平上调THP1细胞经过6-MVX线分别照射2、4、6和10Gy,48h后经RT-PCR检测发现AIM2在mRNA水平上调(图1)。经ImageJ软件做灰度分析,与对照组相比,P<0.05(表2)。
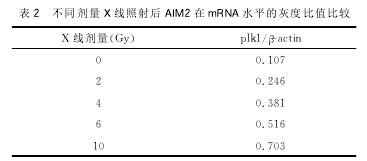
2.2X线照射使AIM2在蛋白质水平上调THP1细胞经过6-MVX线分别照射2、4、6和10Gy,48h后经westernblot检测发现,随着照射剂量的增加,AIM2的蛋白质水平逐渐上调(图2)。经ImageJ软件做灰度分析,与对照组相比,P<0.05(表3)。
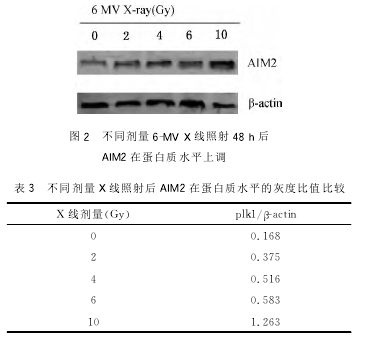
2.3X线照射使Caspase1催化活性增加THP1细胞经过6-MVX线分别照射2、4、6和10Gy,48h后检测Caspase1催化活性。结果发现随着照射剂量增加,Caspase1催化活性也增加(图3)。与对照组相比,P<0.05。
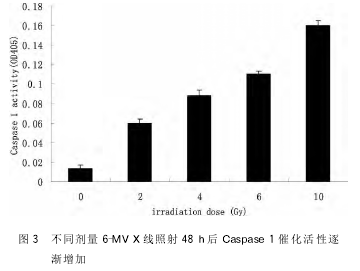
2.4X线照射使IL-1β分泌增加THP1细胞经过6-MVX线分别照射2、4、6和10Gy,48h后用ELISA检测各孔培养基上清中IL-1β的浓度,发现随着照射剂量的加大,IL-1β的水平逐渐升高(图4)。与对照组相比,P<0.05。
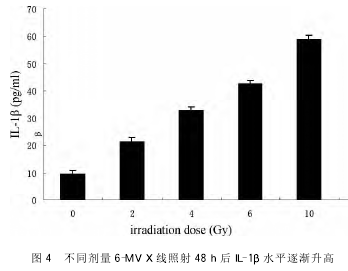
3 讨论
放射性肺损伤是胸部肿瘤放疗后的常见并发症,主要表现为早期的放射性肺炎和晚期的放射性肺纤维化,与肺的受照体积和受照剂量密切相关,与多种细胞因子的表达及信号转导也密切有关[6]。
目前尚未完全阐明放射性肺炎的发生机制。一般认为,放射性肺炎是多因素参与、多细胞因子级联效应的结果,与靶细胞损伤和活性氧自由基有关,与细胞因子的产生、表达和信号转导有关[7]。最近有报道称,放射性肺炎实质上是由放射直接损伤及放射诱导自身免疫反应等引起的一种炎细胞性肺泡炎性反应,其发生高峰期为放射治疗后2~3个月,一般不可逆[8]。因此,本实验选择THP1细胞来模拟体内单核细胞受高能X线照射后,诱发放射性肺炎,从而探索其发生机制。
炎症小体(inflammasome)是细胞内由Caspase1、ASC、NLR、AIM2等组成的多聚体蛋白复合物,可调节IL-1β和IL-18的成熟与释放,通过诱导Caspase1活化和细胞程序性死亡对外源性或内源性危险信号产生应答[9]。AIM2炎症小体是由AIM2/ASC/Caspase1/IL-1β/IL-18组成的复合物。
AIM2(absentinmelanoma2)是一种细胞质内蛋白质,能够感知胞质dsDNA而激活Caspase1,促进IL-1β和IL-18等一些炎症因子的释放,从而诱发炎症反应[10]。AIM2的N末端含有热蛋白(pyrin)结构域(PYD),其C末端为核苷酸/寡糖结合结构域。当AIM2与细胞质双链DNA结合后,它通过PYD相互作用而招募另一个细胞质蛋白质ASC,并诱导了炎性体的组装,从而引起随后Caspase1的激活和IL-1β的产生,诱导天然免疫反应甚至Pyroptosis样细胞死亡[11]。本研究发现,经过单次小剂量照射后,AIM2在蛋白质水平有所上调,说明放射线照射有助于AIM2蛋白质表达量的增加。
Caspase1是炎性体的效应蛋白,参与了炎性体的形成并在其中被激活。当细胞受到各种胞外病原体或胞内危险信号刺激时,细胞内会装配形成炎性体,并招募无活性的pro-Caspase1,形成pro-Caspase1的相对高浓度,此时酶原发生水解形成四聚体,最终成为具有活性的Caspase1。
Caspase1负责将无活性IL-1β前体剪切为成熟的IL-1β[12]。
本研究发现,经过2、4、6和10Gy的高能X线照射后,THP1细胞中Caspase1的催化活性逐渐增强,这也说明放疗有助于提高AIM2炎症小体中Caspase1的催化活性。
白细胞介素是由活化的单核-巨噬细胞及淋巴细胞等产生的一类细胞因子,它作用于淋巴细胞、巨噬细胞或其他细胞,负责信号传递,调节T淋巴细胞和B淋巴细胞的活化、增殖与分化,并在抗病毒免疫反应中发挥重要作用[13]。
IL-1β作为一种维系慢性炎症的重要生物因子,在维系局部炎症微环境中能够引起组织损伤的同时促进肿瘤的发生、发展。近年来,IL-1β与各种病理状态及肿瘤之间密切联系的证据也越来越多。研究显示,慢性肝炎、肝癌患者血清中IL-1β表达明显升高。
IL-1β与肺癌等肿瘤形成有关,能提升肿瘤免疫逃逸潜能[14]。本研究结果显示,经过单次小剂量的高能X线照射后,Caspase1的催化活性增加,从而显著促进THP1细胞分泌更多的IL-1β,从而诱发放射性肺炎。
总之,本研究采用THP1细胞在体外模拟单核细胞放疗过程中诱发放射性肺炎的过程,用不同方法探测照射后THP1细胞中AIM2炎症小体通路,包括AIM2的转录水平和蛋白质水平,Caspase1催化活性,和上清液中IL-1β水平的变化,最终发现不同剂量的X线照射能够活化THP1细胞中的AIM2炎症小体的各组成成分,可能作为解释放射性肺炎发生的机制之一。





